Введение
Новая коронавирусная инфекция (COVID-19) — недавно появившееся инфекционное заболевание, вызванное коронавирусом SARS-CoV-2. Вспышка этого заболевания с 2019 г. достигла масштабов пандемии, затронула сотни миллионов людей во всем мире и привела к гибели более 3 млн человек1 [1].
По данным литературы [2], у большинства детей COVID-19 протекал бессимптомно или в легкой форме. У детей при наличии клинической симптоматики наиболее частыми симптомами были лихорадка, непродуктивный кашель, признаки интоксикации (миалгия, тошнота, слабость). У некоторых детей отмечались боль в горле, заложенность носа, симптомы поражения желудочно-кишечного тракта (боли в животе, диарея, рвота). Частота выявления диареи у детей была выше, чем у взрослых.
Согласно Клиническому протоколу лечения детей с новой коронавирусной инфекцией (COVID-19) 2021 г. [3] выделены следующие клинические варианты течения заболевания: острая респираторная вирусная инфекция (поражение только верхних отделов дыхательных путей), гастроинтестинальная форма, пневмония с наличием и без наличия дыхательной недостаточности, мультисистемный воспалительный синдром (МСВС) в остром периоде COVID-19. К осложнениям относятся: острый респираторный дистресс-синдром, сепсис, септический шок, синдром полиорганной недостаточности, синдром диссеминированного внутрисосудистого свертывания, тромбозы и тромбоэмболии, развившийся через 2–6 нед. после COVID-19 МСВС.
Выздоровление при легком и среднетяжелом течении COVID-19 наступало обычно в течение 1–2 нед. Около 25% детей из числа заболевших перенесли инфекцию бессимптомно. Госпитализация требовалась менее чем 10% детей. Тяжелое течение COVID-19 отмечалось в 1% случаев. Чаще всего осложненные формы болезни развивались у детей с тяжелыми сопутствующими и хроническими заболеваниями. В небольшом проценте случаев у детей, перенесших COVID-19, развивался МСВС [3].
В настоящее время эта проблема не теряет своей актуальности. После перенесенной коронавирусной инфекции есть риск развития постковидного синдрома. ВОЗ дала клиническое определение этого состояния, которое развивается после заболевания СОVID-19 у человека с подтвержденной молекулярно-биологическими методами инфекцией SARS-CoV-22. Постковидный синдром развивается к третьему месяцу после окончания острой фазы инфекции и представляет трудности в диагностике из-за неспецифичности и вариабельности симптомов, отсутствия объективных диагностических данных и не зависит от тяжести клинической картины перенесенного заболевания. Развитие постковидного синдрома возможно даже при бессимптомном течении COVID-19 [4, 5]. Постковидный синдром характеризуется симптомами, которые длятся в течение 2 мес. и не могут быть объяснены альтернативным диагнозом. Общие проявления включают утомляемость, депрессию, одышку, когнитивную дисфункцию, также возможно возникновение симптомов со стороны других органов и систем. Такую системность и неспецифичность клинических проявлений постковидного синдрома, по всей видимости, можно объяснить микрососудистыми нарушениями. Нарушение микроциркуляция у больных COVID-19 в значительной степени связано с тем, что в патологический процесс вовлекаются эндотелиоциты. Доказано, что эндотелий сосудов является органом-мишенью для коронавирусной инфекции [6, 7]. У взрослых пациентов с тяжелым течением COVID-19 выявлена эндотелиальная дисфункция, которая носит системный характер [7].
В норме эндотелий сосудистого русла служит активным эндокринным и паракринным органом, которому принадлежит ведущая роль в регуляции сосудистого тонуса, поддержании сосудистого гомеостаза, и в первую очередь микроциркуляторного русла [8]. Эндотелий принимает непосредственное участие во многих физиологических процессах благодаря постоянному взаимодействию с форменными и плазменными компонентами крови и другими циркулирующими клетками. Эндотелиальные клетки секретируют в просвет сосуда факторы, обеспечивающие динамическое равновесие гемостаза, поддержание и изменение локального кровотока на уровне микроциркуляции, оказывают трофическое действие на прилежащий к ним субэндотелий и слой гладких мышечных клеток, влияют на ангиогенез [9].
G. Bottari et al. [10] описали сублингвальные изменения микроциркуляции при COVID-19, коррелировавшие с клиникой МСВС у детей. Выявлены нарушения микроциркуляции при тяжелом течении COVID-19. Анализ данных позволил определить микрососудистые нарушения и выявить корреляцию между микрососудистыми параметрами, клинической симптоматикой и лабораторными данными [11–14].
Работы по изучению микроциркуляторного русла у детей с COVID-19 малочисленны и посвящены исследованиям тяжелого течения заболевания. Нам не встретились работы по изучению микроциркуляции у детей в отдаленные сроки после перенесенной коронавирусной инфекции. Такие исследования представляют интерес, так как развитие постковидного синдрома предполагает возможные морфофункциональные нарушения микрососудистого русла, сохраняющиеся в отдаленные сроки после перенесенной инфекции.
Цель исследования: провести анализ состояния микрососудистого русла у детей, перенесших новую коронавирусную инфекцию, для выявления микроциркуляторных расстройств и их взаимосвязи с клинической симптоматикой, а также планирования реабилитационных мероприятий.
Содержание статьи
Материал и методы
В период с апреля по июнь 2021 г. обследовано 78 детей в возрасте от 7 до 15 лет (41 мальчик и 37 девочек), перенесших COVID-19 и находившихся на реабилитации в ГБУЗ «ДС № 15 ДЗМ».
При поступлении в санаторий дети были клинически здоровы, сатурация составляла 96–99%, получены отрицательные результаты РНК-теста на SARS-CoV-2 в мазках из рото- и носоглотки (с применением метода полимеразной цепной реакции, ПЦР) и положительный результат обследования на иммуноглобулины класса G к SARS-CoV-2 в крови (с применением метода иммуноферментного анализа, ИФА), что позволило исключить острое заболевание и носительство на момент поступления и подтвердить перенесенную инфекцию.
Все дети были разделены на группы в зависимости от тяжести перенесенной коронавирусной инфекции: бессимптомное (30 детей), легкое (43 ребенка) и тяжелое (5 детей) течение.
Контрольную группу составили 30 здоровых детей такого же возраста, у которых в анамнезе отсутствовала коронавирусная инфекция, были отрицательные результаты РНК-теста на SARS-CoV-2 в мазках из рото- и носоглотки (ПЦР) и отрицательный результат обследования на иммуноглобулины класса G к SARS-CoV-2 в крови (ИФА) на момент проведения исследования.
Критерии, исключающие участие в исследовании: наличие воспалительных заболеваний глаз, острой или обострения хронической бронхолегочной патологии, артериальной гипертонии, ожирения 2–4-й степени.
После получения информированного согласия родителей всем детям проводилось исследование микроциркуляторного русла бульбарной конъюнктивы.
Для изучения микроциркуляторного русла использовали метод бульбарной биомикроскопии с последующей морфометрической обработкой изображений с помощью пакета компьютерных программ для математической обработки фото- и видеоизображения (CONJUNCTIVA-2, MICROCIRCUL 2006, IZVITO, CALIBRA, STATI_CAPILARIES на базе MATLAB R2006a), разработанного О.Г. Константиновым и соавт. [15].
Исследование микроциркуляторного русла проводилось с использованием видеокамеры Aomway sony ccd 700 TVL. Разрешение камеры — 14,5 мкм на пиксель.
Изучались следующие показатели микроциркуляторного русла: коэффициент плотности микрососудистого русла (КП), коэффициент извитости микрососудов (КИ), коэффициент неравномерности калибра артериол (КНКА), коэффициент неравномерности калибра венул (КНКВ), артериоловенулярный коэффициент (АВК), относительное количество микрососудов различного диаметра от 5 до 85 мкм (диаметром до 20 мкм: капилляры, пре- и посткапилляры и артериолы 1-го порядка; микрососуды диаметром от 21 до 32 мкм: венулы 1-го порядка, артериовенулярные анастомозы; микрососуды диаметром от 33 до 43 мкм: артериолы и венулы 2-го порядка, артерии и вены 1-го порядка; микрососуды от 44 до 85 мкм: более крупные сосуды, артерио-венозные анастомозы).
Для статистической обработки результатов использовали программу Microsoft Excel для Microsoft MSO 365 (версия 2204) и med-statistic.ru. Для определения статистической значимости различийсредних величин использовали t-критерий Стьюдента, так как группы сравнения имели нормальное распределение. Статистически значимыми считали различия при р<0,05.
Результаты и обсуждение
В группе детей с бессимптомным течением (n=30) исследование микроциркуляции проведено у 8 детей через 1–3 мес. после установления диагноза, у 15 — через 3–6 мес., у 6 — через 6–12 мес. и у 1 ребенка — через год. В данной группе 17 детей имели гармоничное физическое развитие, 13 — незначительные отклонения в физическом развитии в виде дефицита (4 ребенка) или избытка (9 детей) массы тела.
В группе детей с легким течением (n=43) исследование микроциркуляции проведено у 4 детей через 1–3 мес. после заболевания, у 25 — через 3–6 мес., у 12 — через 6–12 мес., у 2 — через год. В этой группе 24 ребенка имели гармоничное физическое развитие, 19 — незначительные отклонения в физическом развитии в виде дефицита (4 ребенка) или избытка (15 детей) массы тела. После перенесенной коронавирусной инфекции у 11 детей сохранялась потеря обоняния, в том числе у 2 из них отмечалась потеря вкуса, 2 ребенка жаловались на сохраняющуюся слабость, утомляемость и головную боль. Такая клиническая симптоматика была расценена как проявления постковидного синдрома.
В группе детей с тяжелым течением (n=5) исследование микроциркуляции проведено через 6–12 мес. после перенесенного заболевания. В данной группе 2 ребенка перенесли МСВС и 3 — внебольничную двустороннюю пневмонию. Причем 4 ребенка из этой группы имели в качестве коморбидного состояния ожирение 1-й степени.
Таким образом, 40 (51,3%) детей были обследованы в сроки от 3 до 6 мес. после подтверждения коронавирусной инфекции, и это были дети с бессимптомным и легким течением инфекции.
По данным проведенного исследования установлено, что в группе детей с бессимптомным течением в отдаленные сроки после перенесенного COVID-19 отмечалось статистически значимое снижение количества капилляров, пре- и посткапилляров, артериол 1-го порядка, что свидетельствует о микрососудистых нарушениях (табл. 1). Выявленное уменьшение процентного соотношения артериол 1-го порядка, которые относятся к резистивным сосудам и регулируют поступление крови в капилляры, приводит к уменьшению числа функционирующих капилляров и, как следствие, ухудшению трофических процессов в органах и тканях.
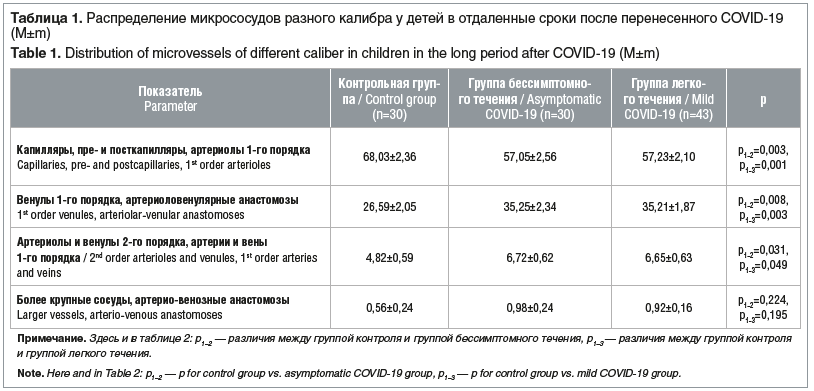
В группе детей с бессимптомным течением в отдаленные сроки после перенесенного COVID-19 отмечается статистически значимое повышение количества венул 1-го порядка, артериоловенулярных анастомозов, что свидетельствует об увеличении венозного емкостного звена микроциркуляторного русла, т. е. венозной гиперемии. Нарастание артериоловенулярных анастомозов, видимо, связано с усилением шунтирующих путей кровотока. Также отмечается статистически значимое повышение количества артериол и венул 2-го порядка и более крупных артерий и вен 1-го порядка. Этому, видимо, способствует спазм артериол 1-го порядка, что затрудняет отток крови из более крупных артериол 2-го порядка и артерий 1-го порядка и приводит к расширению последних.
Увеличение процентного соотношения венул 1-го и 2-го порядка и вен 1-го порядка на фоне уменьшения функционирующих капилляров свидетельствует о нарушении соответствия между притоком крови из капиллярного русла и оттоком из венулярного микрососудистого русла, что приводит к развитию венозной гиперемии. Изменений процентного соотношения самых крупных сосудов и артерио-венозных анастомозов микроциркуляторного русла не выявлено, что свидетельствует о компенсации микрососудистого русла на этом уровне.
В группе детей с легким течением в отдаленные сроки после перенесенного COVID-19 отмечается статистически значимое снижение количества капилляров, пре- и посткапилляров, артериол 1-го порядка, что уменьшает поступление, а следовательно, потребление тканями кислорода и продуктов обмена веществ (см. табл. 1). У пациентов данной группы также отмечается статистически значимое увеличение числа венул 1-го порядка и артериоловенулярных анастомозов, что происходит вследствие открытия артерио-ловенулярных шунтов и сброса крови из артериол в венулы, минуя капиллярную сеть микроциркуляторного русла. Также нами было выявлено статистически значимое увеличение числа артериол и венул 2-го порядка, артерий и вен 1-го порядка, что свидетельствует о венозной гиперемии, т. е. увеличении емкостного звена микрососудистого русла. Увеличение числа артериол 2-го порядка и артерий 1-го порядка, видимо, связано с уменьшением числа прекапилляров и прекапиллярных сфинктеров, что ограничивает приток крови в капилляры, ухудшая доставку кислорода и питательных веществ.
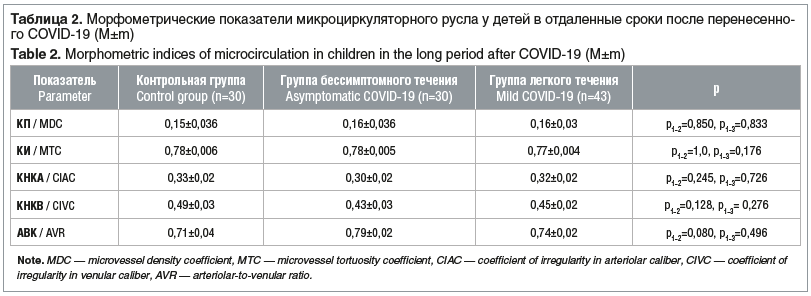
При анализе морфометрических показателей микроциркуляторного русла бульбарной конъюнктивы у детей с бессимптомным и легким течением в отдаленные сроки после перенесенного COVID-19 статистически значимых различий показателей между группами не выявлено (табл. 2), что свидетельствует об одинаковой направленности микрососудистых нарушений. Также данные показатели статистически значимо не отличались от контрольной группы.
Внутрисосудистых изменений в виде сладж-феномена не наблюдалось во всех обследуемых группах.
Группа детей с тяжелым течением COVID-19 была малочисленна (5 человек), поэтому оценить статистически значимые отличия в этой группе по сравнению со здоровыми не представлялось возможным. Интересны данные, полученные при сравнении неравномерности калибра венул в отдаленные сроки после перенесенного COVID-19 в группах детей с бессимптомным и тяжелым течением заболевания. Оказалось, что КНКВ у детей с тяжелым течением в катамнезе составил 0,62±0,05 и статистически значимо (р<0,023) превышал значения этого показателя (0,43±0,03) у детей с бессимптомным течением, что свидетельствует о сохраняющемся снижении тонуса венул у детей данной группы.
Схожие различия выявлены в группе детей с легким и тяжелым течением COVID-19 в катамнезе. Так, КНКВ в группе с тяжелым течением составил 0,62±0,050 и статистически значимо (р<0,008) превышал значения этого показателя (0,45±0,02) у детей с легким течением. Эти изменения свидетельствуют о длительно сохраняющейся дистонии венул после тяжелого течения COVID-19.
Исследования микрососудистого русла у детей, перенесших тяжелую форму COVID-19, представляют интерес, необходимо продолжить их на статистически более значимом материале.
При исследовании микроциркуляторного русла у 11 детей с клиникой постковидного синдрома статистически значимых различий с показателями детей без клинической картины выявлено не было.
У обследованных детей в отдаленные сроки после перенесенной коронавирусной инфекции мы вправе ожидать включение механизмов долгосрочной регуляции местного кровотока микрососудистого русла. Основным механизмом долгосрочной регуляции местного кровотока являются изменения количества кровеносных микрососудов в тканях, увеличение размеров и числа артериол и капилляров, появление новых микрососудов, усиление васкуляризации и ангиогенеза. Известно, что для формирования долгосрочной регуляции кровотока нужно несколько дней у новорожденных детей и более месяца у детей старшего возраста.
У обследованных групп детей с бессимптомным и легким течением в отдаленные сроки после перенесенного COVID-19 произошло не увеличение, а, наоборот, снижение количества капилляров, пре- и посткапилляров, артериол 1-го порядка, что свидетельствует о длительно сохраняющейся дезадаптации микрососудистого русла после перенесенной инфекции.
Заключение
Таким образом, проведенное исследование выявило микрососудистые нарушения у детей в отдаленные сроки после перенесенных бессимптомных и легких форм COVID-19. Эти нарушения связаны с длительно сохраняющимся перераспределением микрососудов, которое приводит к уменьшению числа функционирующих капилляров и венозной гиперемии микроциркуляторного русла, что снижает интенсивность тканевого метаболизма. Необходимо отметить, что эти изменения выявлены только на микроциркуляторном уровне. Они снижают компенсаторные возможности у ребенка, перенесшего бессимптомные и легкие формы COVID-19, что позволяет таких детей отнести к группе риска по развитию микроциркуляторных нарушений в постковидном периоде.
Применение в медицинской практике биомикроскопии бульбарной конъюнктивы позволит неинвазивно и быстро оценить состояние микроциркуляторного русла у детей после перенесенного COVID-19 и персонализировать объем, характер и длительность реабилитационных мероприятий, опираясь на степень дезадаптации микроциркуляторного русла.
1Временные методические рекомендации: Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (07.05.2021).
2ВОЗ: Коронавирусная инфекция (COVID-19): постковидный синдром (28.03.2023).
СВЕДЕНИЯ ОБ АВТОРАХ:
Михеева Инна Григорьевна — д.м.н., профессор кафедры проедевтики детских болезней РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD0000-0002-2515-6592.
Курасова Оксана Борисовна — к.м.н., доцент кафедры пропедевтики детских болезней РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-4881-0083.
Милехина Мария Юрьевна — ассистент кафедры пропедевтики детских болезней РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0000-1727-2473.
Моисеев Анатолий Борисович — д.м.н., доцент, заведующий кафедрой пропедевтики детских болезней РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-1704-2456.
Кузнецова Нелли Ивановна — к.м.н., ассистент кафедры пропедевтики детских болезней РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD0009-0004-3823-4360.
Калиновская Ирина Ивановна — к.м.н., главный врач ГБУЗ «ДБС № 15 ДЗМ»; 117647, Россия, г. Москва, ул. Акад. Капицы, д. 11; ORCID iD 0000-0002-3327-4687.
Зимина Наталия Александровна — заместитель главного врача по медицинской части ГБУЗ «ДБС № 15 ДЗМ»; 117647, Россия, г. Москва, ул. Акад. Капицы, д. 11; ORCID iD 0000-0001-5312-8292.
Верещагина Татьяна Георгиевна — к.м.н., доцент кафедры пропедевтики детских болезней РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Курасова Оксана Борисовна, e-mail: kurasova@inbox.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.10.2023.
Поступила после рецензирования 16.11.2023.
Принята в печать 11.12.2023.
ABOUT THE AUTHORS:
Inna G. Mikheeva — Dr. Sc. (Med.), professor of the Department of Propaedeutics of Children Diseases, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-2515-6592.
Oksana B. Kurasova — C. Sc. (Med.), associate professor of the Department of Propaedeutics of Children Diseases, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-4881-0083.
Mariya Yu. Milekhina — assistant of the Department of Propaedeutics of Children Diseases, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0000-1727-2473.
Anatoliy B. Moiseev — Dr. Sc. (Med.), Associate Professor, Head of the Department of Propaedeutics of Children Diseases, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-1704-2456.
Nelli I. Kuznetsova — C. Sc. (Med.), assistant of the Department of Propaedeutics of Children Diseases, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0004-3823-4360.
Irina I. Kalinovskaya — C. Sc. (Med.), Head Doctor врач of Children Bronchopulmonary Sanitarium; 11, Academician Kapitsa str., Moscow, 117647, Russian Federation; ORCID iD 0000-0002-3327-4687.
Nataliya A. Zimina — Deputy Head Doctor for Medical Work, Children Bronchopulmo-nary Sanitarium; 11, Academician Kapitsa str., Moscow, 117647, Russian Federation; ORCID iD 0000-0001-5312-8292.
Tatyana Vereshchagina — C. Sc. (Med.), associate professor of the Department of Propaedeutics of Children Diseases, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation.
Contact information: Oksana B. Kurasova, e-mail: kurasova@inbox.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 23.10.2023.
Revised 16.11.2023.
Accepted 11.12.2023.
Информация с rmj.ru





