Введение
Несмотря на достижения в диагностике и лечении различных заболеваний, преждевременный разрыв плодных оболочек (ПРПО) осложняет успешное завершение беременности, особенно у пациенток из группы высокого риска перинатальных осложнений, в том числе при беременности, наступившей в результате использования вспомогательных репродуктивных технологий. ПРПО ухудшает исходы родов на любом сроке как для будущей матери, так и для плода [1, 2]. Инфекционные осложнения остаются одной из самых серьезных проблем современного акушерства. ПРПО в 25–30% случаев служит причиной прежде-временных родов (ПР), которые, в свою очередь, в 18–20% случаев являются причиной перинатальной летальности. В Российской Федерации в 2016–2018 гг. 12,4% случаев материнской смертности были связаны с послеродовым сепсисом, и частота этого опаснейшего заболевания растет [3]. Манифестация хориоамнионита (ХА) при ПРПО достигает 60% случаев и обусловлена, как правило, внутри-утробной инфекцией. Тяжесть течения и последствия ХА как для женщины, так и для плода определяются наличием факторов риска развития инфекционных осложнений у беременной, длительностью безводного промежутка и сроком гестации. Показано, что увеличение длительности безводного промежутка при ПРПО может привести к развитию фунизита, клинического и гистологического (субклинического) ХА в 7 и 24% случаев соответственно и может быть непосредственной причиной послеродового эндометрита и даже сепсиса1 [4]. Последнее подтверждается результатами многоцентровых исследований врачей акушеров-гинекологов и септологов зарубежных стран [5]. Это вызывает объяснимое беспокойство в Министерстве здравоохранения Российской Федерации: гнойно-септические осложнения (ГСО) могут свести на нет все достигнутые за последние десятилетия успехи медицины1. Все это лишний раз напоминает о важности комплексной профилактики и ранней диагностики ГСО во время беременности, родов и в послеродовом периоде.
За 2021 г. в Перинатальном центре Республики Крым зафиксировано 174 случая критических акушерских состояний, из которых на долю сепсиса / инфекционных послеродовых осложнений приходится 0,57%, за 2022 г. — 139 и 2,15% соответственно (прирост 1,58%).
Для диагностики ГСО на сегодняшний день активно используют биомаркеры, такие как общее количество лейкоцитов, С-реактивный белок (СРБ), прокальцитонин [6, 7]. Однако эти показатели являются более информативными для исключения инфекционного процесса, но для подтверждения и предикции, к сожалению, не всегда решающими [8, 9].
Пресепсин (ПСП) — относительно новый высокочувствительный и высокоспецифичный маркер сепсиса. Это белок, образуемый макрофагами при фагоцитозе инфицирующих бактерий и грибов (sCD14-ST). При появлении во внутренней среде бактериальной микрофлоры и активации ответного фагоцитоза происходит расщепление m- и sCD14 с высвобождением их N-концевого участка, обозначаемого как sCD14-ST. Имеются результаты исследования данного маркера у пациенток с ПР [10, 11]. Его высокая информативность для ранней и дифференциальной диагностики сепсиса у взрослых пациентов, детей и новорожденных, при оценке степени тяжести и прогнозе септической инфекции уже доказана в научных исследованиях [12]. Поэтому представляется целесообразным изучение данной проблемы, а именно возможности использования ПСП для ранней диагностики ГСО у беременных с ПРПО.
Цель исследования: качественно улучшить подход к своевременному выявлению гнойно-септических осложнений (ГСО) у беременных с длительным безводным промежутком на фоне ПРПО.
Материал и методы
Проспективное одноцентровое исследование выполнено на базе Перинатального центра ГБУЗ РК «РКБ им. Н.А. Семашко». Исследование проведено с соблюдением международных стандартов и биоэтических норм, одобрено локальным этическим комитетом ФГАОУ ВО «КФУ им. В.И. Вернадского» (протокол № 3 от 12.03.2020).
Критерии включения: возраст >16 лет, срок гестации 32–34 нед., одноплодная беременность, наличие добровольного информированного согласия на участие в исследовании.
Критерии исключения: многоплодная беременность, ВИЧ-инфекция, гепатиты В и С, тяжелая преэклампсия, отслойка плаценты, отказ пациентки от участия в исследовании.
Содержание маркеров воспаления изучено у 80 пациенток, поступивших в стационар с ПРПО и угрозой ПР. В 1-ю группу вошли 40 беременных с ПРПО, во 2-ю — 40 беременных без нарушения целостности плодного пузыря с угрозой ПР.
Уровень ПСП, количество лейкоцитов и уровень СРБ оценивали в день поступления, через 24 и 48 ч. Анализ на ПСП проводили на иммунохемилюминесцентном экспресс-анализаторе PATHFAST (LSI Medience Corporation, Япония). Антибиотикопрофилактику назначали с момента госпитализации и установления диагноза. На каждую пациентку были оформлены индивидуальная регистрационная карта и информированное добровольное согласие. В регистрационную карту вносили показатели акушерского, гинекологического и соматического анамнеза, данные лабораторных и инструментальных исследований.
Статистический анализ результатов исследования проводили с использованием пакета прикладных программ MedStat, Microsoft Excel Statistica [13]. Были рассчитаны средние величины, среднее арифметическое каждого показателя и его стандартное отклонение (М±SD).
Результаты и обсуждение
Возраст пациенток обеих групп варьировал от 16 до 43 лет, составив 26,08±0,47 и 26,58±0,38 года в 1-й и 2-й группе соответственно. В обеих группах преобладали пациентки в возрасте 21–30 лет.
Несколько соматических заболеваний зарегистрировано у 25 пациенток: у 15 (37,5%) из 1-й группы и у 10 (25%) — из 2-й. В 1-й группе в 3 раза чаще встречались заболевания вен, немного чаще наблюдалась патология сердечно-сосудистой системы (гипертоническая болезнь и приобретенные пороки сердца) — 3 (7,5%) против 1 (2,5%) во 2-й группе. Изменения гемодинамики и микроциркуляции могут способствовать возникновению ГСО в родах и пуэрперии.
Также необходимо отметить, что у 5 (12,5%) пациенток 1-й группы индекс массы тела превышал 30 кг/м2, тогда как во 2-й группе таких пациенток не было.
Заболевания мочеполовой системы регистрировали только в 1-й группе — у 7 (17,5%) беременных. Перенесенные операции встречались практически с одинаковой частотой в 1-й и 2-й группах: тонзиллэктомия (4 (10%) и 3 (7,5%) соответственно), аппендэктомия (7 (17,5%) и 6 (15%) соответственно), холецистэктомия (3 (7,5%) и 10 (25%) соответственно).
При анализе гинекологического анамнеза выявлено, что средний возраст наступления менархе в 1-й группе был 13,2±1,3 года, во 2-й группе — 13,6±1,7 года (р>0,05). У 32 (80%) женщин 1-й группы и 25 (62,5%) женщин 2-й группы были выявлены нарушения менструального цикла. Высокий риск развития ГСО при дисгормональной патологии можно ожидать именно у данных пациенток, поскольку такие нарушения являются основой для иммунологического сдвига в организме1.
Воспалительные заболевания органов малого таза в 1-й группе выявлены у 8 (20%) пациенток, во 2-й — у 1 (2,5%), фоновые заболевания шейки матки (полипы, цервицит, эктропион, эрозия шейки матки) — у 9 (22,5%) и 4 (10%) соответственно.
Отягощенный репродуктивный анамнез имел место у 13 (32,5%) пациенток 1-й группы и 3 (7,5%) — 2-й группы. Наличие в анамнезе абортов, привычного невынашивания, самопроизвольных выкидышей на разных сроках, замершей беременности можно рассматривать как фон для развития ГСО в послеродовом периоде, поскольку такой отягощенный репродуктивный анамнез может свидетельствовать о скрытых, вялотекущих воспалительных заболеваниях (бактериальный вагиноз, кольпит, цервицит, эндометрит) [2].
Течение настоящей беременности может повлиять на развитие ГСО, поскольку, даже при неотягощенном соматическом, акушерско-гинекологическом анамнезе, на фоне осложнений беременности риски воспалительных заболеваний возрастают. У 10 (25%) беременных 1-й группы отмечалось сразу несколько осложнений течения беременности, тогда как во 2-й группе сочетанные осложнения выявлены только в 3 (7,5%) наблюдениях. Наиболее частыми осложнениями были острая респираторная вирусная инфекция и новая коронавирусная инфекция (COVID-19). В 1-й группе было 28 (70%) переболевших этими инфекциями, что в 3,5 раза больше, чем во 2-й, — 10 (20%).
В 1-й группе по сравнению со 2-й отмечено в 4 раза больше женщин с инфекциями, передающимися половым путем (9 (22,5%) против 2 (5%)), с гестационным пиелонефритом (4 (10%) против 1 (2,5%)) и в 3 раза больше с бессимптомной бактериурией (6 (15%) против 2 (5%)).
Во 2-й группе по сравнению с 1-й группой в 3 раза реже встречалась угроза прерывания беременности и истмико-цервикальная недостаточность (12 (30%) против 4 (10%) и 25 (62,5%) против 8 (20%) соответственно).
Таким образом, в группе с ПРПО преобладали пациентки с отягощенным соматическим, гинекологическим и акушерским анамнезом, что могло стать предпосылкой к развитию ГСО. Своевременное выявление факторов риска таких осложнений и лабораторное инструментальное подтверждение требуют от акушера-гинеколога дифференцированного подхода к лечению.
Согласно цели исследования нами изучена динамика концентрации ПСП у пациенток обеих групп в день поступления, через 24 и 48 ч. Для сравнения в обеих группах определяли показатели общего количества лейкоцитов и уровень СРБ. При поступлении повышенное содержание ПСП (≥300 пг/мл) отмечено у 23 (57,5%) женщин 1-й группы и лишь у 2 (5%) — 2-й группы (табл. 1).
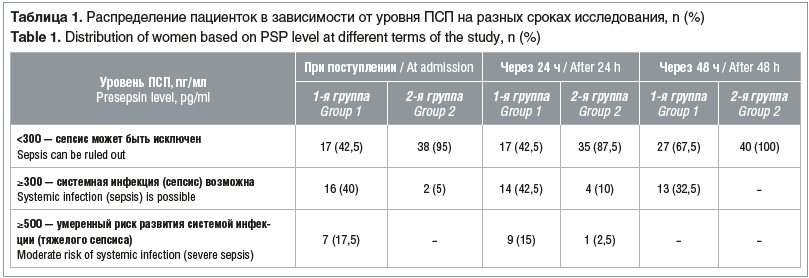
Все 23 женщины 1-й группы с повышенным содержанием ПСП имели факторы риска по развитию ГСО, исходя из анамнеза (гинекологического, акушерского и соматического). Присутствовали один или более клинико-лабораторных признаков развития ХА:
-
повышенная температура тела (более 38 °С);
-
ЧСС женщины более 100 в 1 мин;
-
ЧСС плода более 160 в 1 мин;
-
изменение характера выделений из половых путей с неприятным (гнилостным) запахом;
-
лейкоцитоз (более 15×109/л), палочкоядерный сдвиг;
-
повышенный уровень СРБ (более 10 мг/мл).
Также повышение концентрации ПСП у большинства женщин 1-й группы можно трактовать как неспецифическую адаптационную реакцию организма (стресс-реакция) [3, 7]. В течение первых суток родоразрешены 7 женщин.
Во 2-й группе повышенный уровень ПСП зафиксирован у 2 пациенток (при поступлении) при отсутствии клинических и других лабораторных данных о возможном течении инфекционно-воспалительного процесса в организме. В этих случаях имела место настороженность, проведено дополнительное обследование с целью поиска причины роста значений показателя. Однако достоверных признаков развития инфекционного процесса не обнаружено.
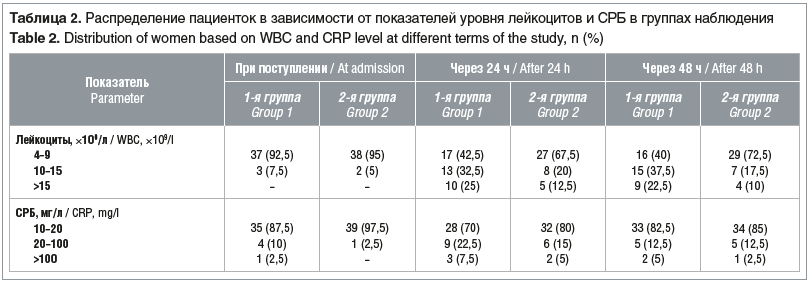
Через 24 ч у всех женщин обеих групп повторно определяли уровень ПСП. Ко вторым суткам у части пациенток как 1-й, так и 2-й группы, у которых ранее уровень ПСП был в пределах 300–500 пг/мл, показатель превысил 500 пг/мл, что свидетельствует о высоком риске ГСО. Высокие цифры ПСП у пациенток обеих групп коррелировали с изменениями в анализе крови (табл. 2), продолжительностью безводного промежутка более 18 ч.
Хориоамнионит был установлен у 7 (17,5%) родильниц из 1-й группы. У всех этих пациенток уровень ПСП при поступлении был ≥500 пг/мл, присутствовало два или более клинических признаков ХА, выжидательная тактика изменена на активную. У остальных 16 женщин наблюдался только повышенный уровень ПСП (более 500 пг/мл).
Из числа пациенток 1-й группы с высоким уровнем ПСП (≥500 пг/мл) и диагностированным ХА 5 родоразрешены путем операции кесарева сечения, 2 — через естественные родовые пути. В качестве профилактики ГСО, за исключением пациенток со своевременными родами, пролонгировалась одно-, двухкомпонентная антибактериальная терапия, инфузионная терапия.
Через 48 ч показатели ПСП в обеих группах приблизились к нормальным у большинства женщин, однако у 13 пациенток 1-й группы уровень ПСП был в пределах 300–500 пг/мл.
Показатель ПСП коррелировал с воспалительными изменениями в общем анализе крови и повышенным уровнем СРБ.
Несмотря на наличие гистологически подтвержденного плацентита (интервиллезит), что не исключает вовлечения в инфекционно-воспалительный процесс стенок матки и родовых путей, своевременное родоразрешение и стартовая противовоспалительная и антибактериальная терапия обусловливали не мгновенное, а постепенное снижение маркеров воспаления (СРБ, ПСП). Динамика снижения маркеров воспаления зависела от интенсивности клинических проявлений ХА.
Гематологические показатели — общее количество лейкоцитов и уровень СРБ — не показали такой чувствительности в диагностике ГСО при поступлении (см. табл. 2).
Как оказалось, среди 7 пациенток 1-й группы с ХА только у 3 (7,5%) отмечался лейкоцитоз и у 5 (21,7%) — повышенный уровень СРБ, в то время как концентрация ПСП была сразу ≥300 пг/мл. Только через 24 ч у всех пациенток 1-й группы с ХА отмечался лейкоцитоз >15×109/л. Что же касается СРБ, то через 24 ч этот показатель был >20 мг/л у 12 (52,2%) пациенток из 1-й группы.
При анализе послеродовых ГСО в обеих группах не было зафиксировано ни одного случая послеродового эндометрита. Однако имели место в 1-й группе: частичное расхождение швов после кесарева сечения у 4 (36,4%) из 11 прооперированных женщин, частичное расхождение швов промежности у 2 (5%) из 40. Все осложнения наблюдались у женщин с высоким уровнем ПСП при поступлении. Во 2-й группе осложнений не было.
Использование ПСП позволяет в кратчайшие сроки определить наличие ГСО, а также возможные риски по ним. Получение точных результатов за 15 мин облегчает принятие быстрых клинических решений и обеспечивает своевременное оказание адекватной экстренной помощи, что крайне важно у беременных с ПРПО.
Следует отметить, что выборка пациенток, у которых был изучен ПСП, мала, поэтому значимые связи требуют изучения на большей выборке. Существует необходимость в дальнейшем изучении данной проблемы.
Заключение
Пресепсин может рассматриваться как информативный маркер для ранней диагностики ГСО у пациенток с ПРПО, а также с целью изменения терапии, определения срока и метода родоразрешения. ПСП, в сравнении с СРБ и общим количеством лейкоцитов, быстрее отображает начало ГСО, а динамический контроль ПСП не трудно организовать в кратчайшие сроки непосредственно в отделениях Перинатального центра.
В проведенном нами исследовании беременные с ПРПО на сроке 32–34 нед. гестации имели отягощенный соматический, гинекологический и акушерский анамнез, что могло стать предпосылкой к развитию ГСО. При высоком уровне ПСП и наличии одного или более клинических/лабораторных данных в пользу ХА выжидательная тактика должна быть изменена на активную. ПСП и СРБ как биомаркеры активного воспаления и предикторы сепсиса не исключают, а дополняют друг друга в качестве ранней диагностики ГСО, а также динамической оценки эффективности терапевтических мероприятий.
1Септические осложнения в акушерстве. Клинические рекомендации (протокол лечения). (Электронный ресурс.) URL:http://www.consultant.ru/document/cons_doc (дата обращения: 12.04.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Кондратюк Денис Владимирович — ассистент кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, Республика Крым, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0001-5383-9326.
Сулима Анна Николаевна — д.м.н., профессор, профессор кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-2671-6985.
Бабич Татьяна Юрьевна — д.м.н., профессор кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCIDiD 0000-0003-3274-0698.
Контактная информация: Сулима Анна Николаевна, е-mail: gsulima@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 04.03.2024.
Поступила после рецензирования 29.03.2024.
Принята в печать 23.04.2024.
ABOUT THE AUTHORS:
Denis V. Kondratyuk — assistant of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievskiy Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0001-5383-9326.
Anna N. Sulima — Dr. Sc. (Med.), Professor, professor of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievskiy Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-2671-6985.
Tatyana Yu. Babich — Dr. Sc. (Med.), professor of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievskiy Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0003-3274-0698.
Contact information: Anna N. Sulima, e-mail: gsulima@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 04.03.2024.
Revised 29.03.2024.
Accepted 23.04.2024.
Информация с rmj.ru






