Офтальмология
Материал и методы: разработана собственная методика создания биологического барьера при хирургии птеригиума. Проведен анализ клинической эффективности разработанной методики с использованием амниопластики вне лимбальной зоны после резекции птеригиума для профилактики его рецидивирования.
Клинический материал — 46 глаз с первичным птеригиумом II и III степеней. Основную группу составили 22 пациента (22 глаза), у которых амниопластика выполнялась по разработанному нами методу. Группу сравнения составили
24 пациента (24 глаза), у которых покрытие склерального дефекта в зоне лимба проводилось полоской амниотической мембраны. Методика хирургической резекции головки птеригиума была единой в обеих группах исследования. Критерии сравнения групп — наличие и частота рецидивов птеригиума к 10—12 мес. наблюдения после операции.
Результаты: в группе сравнения трансплантат отличался вялой витализацией, в то время как в основной группе имела место его адекватная витализация. Спустя 1 мес. у 5 пациентов группы сравнения сформировались избыточная васкуляризация лимба и натяжение слезного мясца. Несмотря на усиление противовоспалительного лечения, у 3 пациентов произошел рецидив птеригиума, потребовавший повторного оперативного вмешательства по технологии, примененной в основной группе.
Заключение: существенными преимуществами разработанной нами методики хирургического лечения птеригиума являются устранение его базиса — васкуляризированной теноновой капсулы внутреннего угла глаза; локализация биологического барьера в области полулунной складки; покрытие дефекта склеры сохраненной собственной конъюнктивальной тканью. Такой подход позволил добиться статистически значимого повышения показателей витализации трансплантатов в основной группе против группы сравнения. Оценка клинической эффективности разработанной технологии показала, что при сроках наблюдения до 12 мес. ни в одном случае не произошло рецидива, хотя в группе сравнения он имел место у 3 пациентов (12,5%).
Ключевые слова: птеригиум, рецидивирующий птеригиум, амниопластика вне зоны лимба, конъюнктивальный лоскут, амниотическая мембрана, эпителизация роговицы, витализация трансплантата, осмолярность слезной жидкости.
Для цитирования: Бочкарева А.Н., Егоров В.В., Смолякова Г.П., Сорокин Е.Л., Банщиков П.А. Возможности профилактики рецидивирующего течения птеригиума после его хирургического лечения // РМЖ «Клиническая Офтальмология». 2018. №1. С. 20-25
Bochkareva A.N.1, Egorov V.V.1,2, Smolyakova G.P.1,2, Sorokin E.L.1,3, Banshchikov P.A.1
1 The Khabarovsk branch of “Eye Microsurgery” Federal State Institution named after S.N. Fyodorov
2 Postgraduate Institute for Health Care Professionals, Khabarovsk, Russia
3 Far-Eastern State Medical University, Khabarovsk, Russia
Aim: to evaluate the clinical effectiveness of the method developed by us to prevent the recurrence of pterygium II and III after its resection.
Patients and Methods: we have developed our own technique for creating a biological barrier in pterygium surgery. The method includes the use of amnioplasty outside the limbus zone after resection of the pterygium to prevent its recurrence. The analysis of the clinical efficacy of the developed technique was carried out.
Clinical material — 46 eyes with primary pterygium II and III. The main group consisted of 22 eyes, in which the amnioplasty was performed according to the method developed by us. The comparison group consisted of 24 eyes, in which the scleral defect in the limbus zone was covered by a flap of the amniotic membrane. The method of surgical resection of the pterygium head was the same in both study groups. The criterion for comparison of the groups was the existence and frequency of pterygium recurrences in 10-12 months after the surgery.
Results: in the comparison group, the graft was characterized by a sluggish vitalization, while in the main group an adequate vitilization was observed. After 1 month of observation there was an excessive limbus vascularization and tension of the lacrimal caruncle in 5 eyes of the comparison group. Despite the intensification of anti-inflammatory treatment, there was a relapse of the pterygium in 3 eyes, which required a repeated surgery using the technology applied in the main group.
Conclusion: essential advantages of the developed method of surgical treatment of the pterygium are elimination of its basis — the vascularized Tenon’s capsule of the medial angle of eye; localization of the biological barrier in the area of the semilunar fold; grafting of the sclera defect by preserved conjunctival tissue. This approach allowed to achieve a statistically significant increase in transplant vitalization in the main group, against the comparison group. Assessment of the clinical efficacy of the developed technology has shown that there were no relapses during the observation period of up to 12 months, although in the comparison group relapses occurred in 3 eyes (12.5%).
Key words: pterygium, recurrent pterygium, amnioplasty outside the limbus zone, conjunctival flap, amniotic membrane, corneal epithelization, graft vitalization, tear osmolarity.
For citation: Bochkareva A.N., Egorov V.V., Smolyakova G.P. et al. Possibilities of prevention of recurrent pterigium after surgical treatment // RMJ “Clinical ophthalmology”. 2018;1:20–25.
Возможности профилактики рецидивирующего течения птеригиума после его хирургического лечения. Представлены результаты использование разработанной методики создания биологического барьера при хирургии птеригиума. Оценка клинической эффективности разработанной технологии показала, что при сроках наблюдения до 12 мес. ни в одном случае не произошло рецидива.
Содержание статьи
Введение
Птеригиум является дегенеративным заболеванием конъюнктивы глазного яблока. Его выраженные изменения (III и IV степени по З. Д. Татаренко, 1993) расценивают как вазопролиферативную патологию, которая в 60—70% случаев способна сформировать грубые косметические дефекты, индуцированный роговичный астигматизм, помутнение центральной зоны роговицы со снижением остроты зрения [1, 2].
Единственным методом его лечения остается хирургическая резекция. Несмотря на множество различных хирургических методик, частота его рецидивирования высока и составляет от 40 до 70% [3–5]. Наиболее высок риск рецидивирования при птеригиуме II–III степеней (мясистая консистенция, выраженная сосудистая сеть). Основой рецидивирующего роста птеригиума является обильная васкуляризация полулунной складки внутреннего угла глаза и теноновой капсулы. Наиболее часто рецидив птеригиума возникает в течение 1-го года после хирургического вмешательства [3, 5].
Для профилактики рецидивирования птеригиума после его резекции в настоящее время используют искусственный тканевой барьер у лимба. В качестве трансплантатов применяют различные ауто- и гетероткани: слизистую с губы, твердую мозговую оболочку, капсулу почек [5–9].
Среди барьерных биологических трансплантационных материалов в последние годы все чаще применяется амниотическая мембрана. Это обусловлено тем, что ткань амниона способна снижать активность фиброобразования и неоваскуляризации, стимулировать рост и дифференцировку поверхностного эпителия роговицы [6, 10, 11]. Но поскольку зона лимба является иммунокомпетентной, ее амниопластика после хирургии птеригиума способна, напротив, сопровождаться неадекватной воспалительной реакцией на хирургическое вмешательство, замедляя тем самым репаративные процессы в конъюнктиве и роговице. Все это может привести к грубому рубцеванию конъюнктивы внутреннего угла глаза и даже к стойкому помутнению роговицы [6]. Учитывая это, при хирургии птеригиума нами была разработана и внедрена в клиническую практику методика создания барьера, не затрагивающего лимбальную зону [12].
Цель исследования: оценить клиническую эффективность разработанного нами способа профилактики рецидивирования птеригиума II и III степеней после его резекции.
Материал и методы
Был проведен отбор 46 пациентов (46 глаз) с первичным птеригиумом II и III степеней. Возраст пациентов составил от 52 до 73 лет (в среднем 65±2 года). Среди них было 25 женщин и 21 мужчина.
Во всех случаях птеригиум локализовался с внутренней стороны глаза, имел мясистую консистенцию, выступающую на 0,8–1,5 мм над поверхностью роговицы, характеризовался наличием выраженной сосудистой сети. В 29 глазах он широко распространялся по поверхности роговицы, достигая 1/2 проекции радужки, а в 17 глазах доходил до проекции зрачкового края (рис. 1).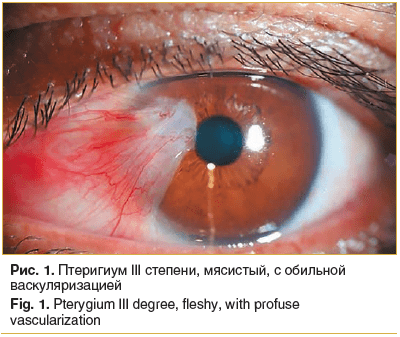
Для оценки эффективности разработанного способа хирургического лечения птеригиума все пациенты были разделены на 2 группы, сопоставимые по полу, возрасту, степени выраженности птеригиума и его сосудистой сети. Основную группу составили 22 пациента (22 глаза), которым выполнялась амниопластика по разработанному нами способу [12–15].
Суть методики заключается в следующем. После проведения резекции головки птеригиума и очищения роговичного ложа тенонова капсула внутренней части глазного яблока тщательно отсепаровывается от конъюнктивы и резецируется до полулунной складки; конъюнктивальный лоскут перемещается и покрывает обнаженную зону склеры вплоть до лимба; в зоне полулунной складки поперечно росту птеригиума к склере подшивается полоска амниона шириной 2–3 мм (4 узловых шва, шелк 8/0).
Важным в данной методике является то, что лоскут амниона располагается не в зоне лимба, а в отдалении от него. Кроме того, важно то, что покрытие склеры в зоне лимба осуществляется собственной конъюнктивой с неповрежденной собственной сосудистой сетью (не обладающей антигенными свойствами), что улучшает процессы эпителизации роговицы.
Группу сравнения составили 24 пациента (24 глаза), которым после иссечения птеригиума, поверхностной кератэктомии удалялась конъюнктива с подлежащей субконъюнктивальной тканью. Замещение склерального дефекта выполняли полоской амниотической мембраны шириной 3–5 мм, подшиваемой в зоне лимба к склеральной капсуле глаза 5–6 узловыми швами (шелк 8/0) [11].
В обеих группах использовалась единая методика хирургической резекции головки птеригиума.
Все операции прошли без осложнений. В постоперационном периоде пациентам обеих групп исследования назначались местные 4-кратные инстилляции растворов антибиотиков и антисептиков (0,3% ципрофлоксацин, 0,01% окомистин), за веки 3 р./сут закладывался 5% декспантенол.
После завершения процессов эпителизации роговичного ложа (7–10-е сут) антисептические растворы отменялись, назначались 3-кратные инстилляции 0,1% р-ра дексаметазона в течение 10 дней. Снятие швов с конъюнктивы выполняли на 10-е сут после операции.
В процессе динамического наблюдения проводили биомикроскопический мониторинг течения регенеративно-репаративного процесса в зоне резекции птеригиума. Оценивали следующие показатели: длительность эпителизации ложа птеригиума на роговице (при инстилляции 1% р-ра флюоресцеина); изучали показатели витализации трансплантатов (цвет, наличие отека, гиперемии); выясняли наличие и степень сосудистой реакции конъюнктивального покрытия (отсутствует, умеренно выраженная, выраженная).
Среди дополнительных методов исследования проводилось изучение осмолярности слезной жидкости (ОСЖ), являющейся интегральным объективным показателем оценки наличия и степени воспалительной реакции роговицы и конъюнктивы. Чем выше ее значение, тем, соответственно, выше степень реакции [16, 17]. Данный показатель мы оценивали как исходно, так и спустя 1–2 мес. после операции методом биоимпедансометрии (ТearLab Oamolarity system, США) [16].
Срок наблюдения составил 10–12 мес. Критериями сравнения в обеих группах являлись наличие и частота рецидивов птеригиума к окончанию срока наблюдения.
Результаты и обсуждение
Результаты постоперационного мониторинга обеих групп пациентов представлены в таблице 1.
Исходно показатели ОСЖ основной группы и группы сравнения имели умеренно повышенные значения (норма не более 316 мОсм/л) [16]. Это указывало на наличие умеренной воспалительной реакции на передней поверхности глаза, обусловленной агрессивным ростом массивного птеригиума.
На 4–6-сут постоперационного периода во всех глазах пациентов группы сравнения амниотический трансплантат был отечным, бледного цвета, с умеренным количеством слизистого отделяемого, зона лимба обильно васкуляризирована, роговичное ложе эпителизируется (рис. 2). Конъюнктивальное покрытие в 8 глазах характеризовалось выраженной сосудистой активностью, отеком и гиперемией, более выраженной в зоне слезного мясца, а также на границе с трансплантатом.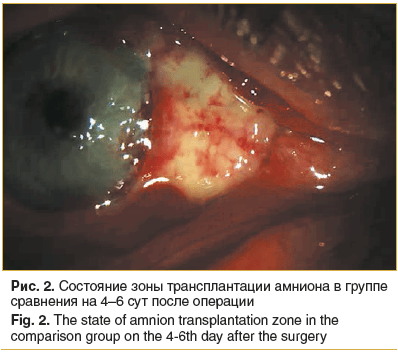
Во всех глазах пациентов основной группы амниотический трансплантат имел бледно-розовый цвет без признаков экссудативной реакции, что свидетельствовало о его адекватной витализации. Зона лимба прикрыта собственной конъюнктивой, васкуляризации лимба нет, роговичное ложе полностью эпителизировано (рис. 3). Конъюнктивальное покрытие характеризовалось умеренной сосудистой реакцией и отеком.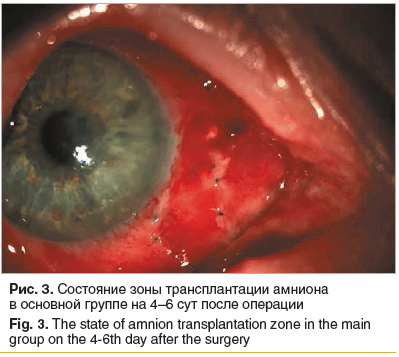
В группе сравнения завершение полной эпителизации роговичного ложа произошло к 6–7 сут, в то время как у пациентов основной группы — к 4–5 сут (p
Отмечены существенные различия в витализации амниотических трансплантатов у пациентов обеих групп исследования. Так, к 10–14 сут во всех 24 глазах пациентов группы сравнения трансплантат у лимба оставался бледным, по его границам выявлялись единичные петехиальные кровоизлияния (рис. 4). Это свидетельствовало о его неудовлетворительной витализации. Зона лимба обильно васкуляризирована, роговичное ложе полностью эпителизировано. На 8 глазах имелась тенденция к сокращению амниотического трансплантата с соответствующим натяжением слезного мясца.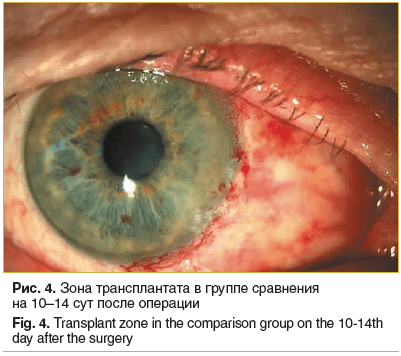
Через 1 мес. в 19 глазах пациентов группы сравнения амниотический трансплантат постепенно приобрел розовый оттенок, однако в 5 глазах сформировалась избыточная васкуляризация лимба, и сохранялось натяжение слезного мясца. Это было расценено нами как дебют рецидивирующего роста птеригиума. Данным пациентам были назначены ежедневные 5-кратные инстилляции 0,1% раствора дексаметазона. Но несмотря на усиление противовоспалительного лечения, в 3 глазах все же произошло прогрессирующее нарастание на 1,5–2 мм рубцово-измененной васкуляризированной ткани на роговичное ложе по зоне лимба, с сопутствующим натяжением и деформацией полулунной складки, что было расценено нами как рецидивирующий рост птеригиума (рис. 5).
В основной группе пациентов к 10–14 сут во всех 22 глазах отмечено адекватное приживление амниотического трансплантата. Он имел розовый оттенок, в зоне полулунной складки полностью витализирован, роговичное ложе полностью эпителизировано, прозрачное, ни в одном глазу не было отмечено деформаций и натяжения слезного мясца (рис. 6). 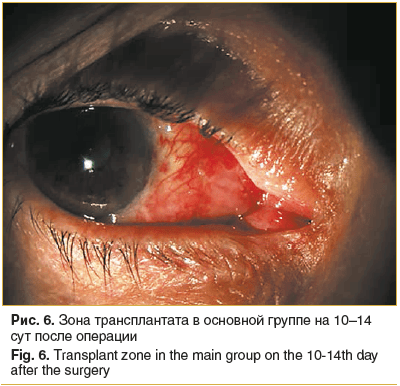
Спустя 1 мес. после операции в 18 глазах пациентов основной группы трансплантаты были витализированы и имели розовый оттенок. В 4 глазах определялась умеренная васкуляризация лимба внутреннего угла глаза. Проведение ежедневных 4-кратных инстилляций 0,1% р-ра дексаметазона позволило купировать формирование васкуляризации во всех глазах в течение 10–15 дней. Ни в одном случае не возник рецидив птеригиума (рис. 7).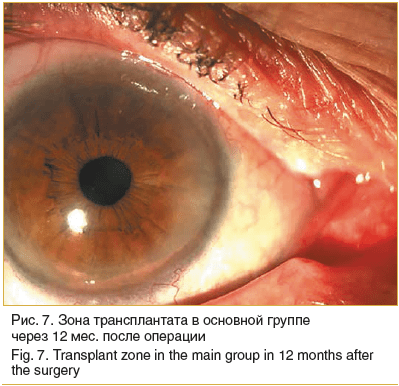
Показатели ОСЖ в группе сравнения спустя 1–1,5 мес. значимо снизились по сравнению с исходными значениями (р
В основной группе пациентов спустя 1–1,5 мес. после операции произошло значимое снижение показателей ОСЖ до значений, сопоставимых с нормальными (p
В связи с рецидивирующим ростом птеригиума 3 пациентам группы сравнения были выполнены повторные операции по технологии, примененной в основной группе пациентов. При сроках наблюдения до 12 мес. ни у одного из них не произошло повторного рецидива птеригиума.
Таким образом, преимуществами разработанной нами методики хирургического лечения птеригиума является то, что трансплантат напрямую не соприкасается с иммунокомпетентной зоной лимба. Располагаясь непосредственно в ростковой зоне птеригиума, он более эффективно выполняет свою барьерную функцию, препятствуя росту сосудов в зоне лимба. Его адекватная витализация достигается за счет хорошей васкуляризации области внутреннего угла глаза. Это, соответственно, минимизирует риск его отторжения, некроза и сморщивания.
Заключение
Существенными преимуществами разработанной нами методики хирургической профилактики рецидивирования птеригиума являются: устранение его базиса — васкуляризированной теноновой капсулы внутреннего угла глаза; локализация биологического барьера в области полулунной складки (амниопластика); покрытие дефекта склеры сохраненной собственной конъюнктивальной тканью. Такой подход позволил добиться статистически значимого повышения показателей витализации трансплантатов в основной группе против группы сравнения. Оценка клинической эффективности разработанной технологии показала, что при сроках наблюдения до 12 мес. ни в одном случае не произошел рецидив птеригиума, хотя в группе сравнения он имел место в 3 глазах (12,5%).
Литература
1. Канюков В. Н., Стадников А. А., Ломухина Е. А. Особенности микроскопического строения птеригиума. Вестник Оренбургского государственного университета. 2007;12–2 (78):119–121 [Kanyukov V.N., Stadnikov A. A., Lomukhina E. A. Peculiarities of microscopical structure of pterygium. Vestnik of Orenburg State University. 2007;12–2 (78):119–121 (in Russ.)].
2. Татаренко З. Д., Гончар П. Ф., Татаренко И. В. Птеригиум. М., 1993:25–62 [Tatarenko Z.D., Gonchar P. F., Tatarenko I. V. Pterigium. Moscow, 1993:25–62 (in Russ.)].
3. Каллахан А. Н. Хирургия глазных болезней. М., 1963:37–65 [Kallakhan A. N. Surgery of eye diseases. M., 1963:37–65 (in Russ.)].
4. Петраевский А. В., Тришкин К. С. Способ хирургического лечения птеригиума. Офтальмохирургия. 2012;4:28 [Petrayevsky A.V., Trishkin K. S. Method of surgical treatment for pterygium. Ophthalmosurgery. 2012;4:28 (in Russ.)].
5. Латыпова Э. А. К вопросу о лечении рецидивирующего птеригиума. Вестник офтальмологии. 2009;6:34–36 [Latypova E. A. To the treatment of recurrent pterygium. Vestn Ophthalmol. 2009;6:34–36 (in Russ.)].
6. Абрамова И. А., Бойко Э. В., Черныш В. Ф. Об использовании амниотической мембраны с целью конъюнктивальной пластики в эксперименте. Офтальмохирургия. 2004;3:10–12 [Abramova I.A., Boiko E. V., Chernysh V. F. On the use of amnionic membrane for conjunctival plasty in the experiment. Ophthalmosurgery. 2004;3:10–12 (in Russ.)].
7. Бородин Ю. И., Вальский В. В., Вериго Е. Н. Отдаленные результаты комбинированного лечения рецидивирующего птеригиума. Офтальмология. 2007;3:29–33 [Borodin Yu.I., Valsky V. V., Verigo E. N. Late results of combined treatment of recurrent pterigium. Ophthalmology. 2007;3:29–33 (in Russ.)].
8. Фокин В. П., Борискина Л. Н., Бугаенко И. А. Хирургическое лечение птеригиума по методу аутопластики свободным конъюнктивальным лоскутом. Вестник Оренбургского государственного университета. 2004;38:131–132 [Fokin V.P., Boriskina L. N., Bugaenko I. A. Surgical treatment of pterygium by method of autoplasty of free conjunctival strip. Vestnik of the Orenburg State University. 2004;38:131–132 (in Russ.)].
9. Середа Е. В., Дрожкина Г. И., Гайдамака Т. Б. и др. Эффективность различных хирургических методик трансплантации амниотической мембраны при воспалительной и дистрофической патологии роговицы. Офтальмологический журнал. 2016;4:3–10 [Sereda E.V., Drozhzhina G. I., Gaidamaka T. B. Efficacy of different amniotic membrane transplantation techniques in patients with inflammatory and degenerative pathology of the cornea. Journal of ophthalmology (Ukraine). 2016;4:3–10 (in Russ.)].
10. Гундорова Р. А., Киселева О. А., Сороколетова Н. В. Применение амниотической мембраны в офтальмологии. Рефракционная хирургия в офтальмологии. 2007;7 (2):27–31 [Gundorova R.A., Kiseleva O. A., Sorokoletova N. V. Application of amnionic membrane in ophthalmology. Refractive surgery and ophthalmology. 2007;7 (2):27–31 (in Russ.)].
11. Золаторев А. В., Милюдин Е. С. Хирургическое лечение рецидивирующего птеригиума с пластикой силикон-высушенной амниотической мембраной. Вестник офтальмологии. 2007;1:39 [Zolatorev A.V., Milyudin E. S. Surgical treatment for recurrent pterygium with plastic repair by means of silicone-dried amniotic membrane. Vestn Ophthalmol. 2007;1:39 (in Russ.)].
12. Патент РФ № 2611939, 01.03.2017. Бочкарева А. Н., Егоров В. В., Смолякова Г. П., Банщиков П. А. Способ хирургического лечения птеригиума. Патент России № 2611939. 2017. Бюл. № 7 [Patent of RF № 2611939, 01.03.2017. Bochkareva A. N., Egorov V. V., Smoliakova G. P., Banshchikov P. A. Technique of surgical treatment of a pterygium. Patent of Russian Federation № 2611939, 2017. Bulletin № 7 (in Russ.)].
13. Банщиков П. А., Егоров В. В., Смолякова Г. П., Бочкарева А. Н. Повышение эффективности хирургического лечения рецидивирующего птеригиума. Современные технологии в офтальмологии. 2015;2 (6):141–144 [Banshchikov P.A., Egorov V. V., Smoliakova G. P., Bochkareva A. N. Increase of effectiveness of surgical treatment of recurrent pterygium. Modern technologies in ophthalmology. 2015;№ 2 (6):141–144 (in Russ.)].
14. Бочкарева А. Н., Егоров В. В., Смолякова Г. П., Банщиков П. А. Поиски возможностей улучшения результатов хирургического лечения первичного птеригиума. Современные технологии в офтальмологии. 2016;2 (10):213–216 [Bochkareva A.N., Egorov V. V., Smoliakova G. P., Banshchikov P. A. Searches of opportunities of improvement of results of surgical treatment of primary pterygium. Modern technologies in ophthalmology. 2016;2 (10):213–216 (in Russ.)].
15. Бочкарева А. Н., Егоров В. В., Смолякова Г. П., Банщиков П. А. Результаты хирургического лечения первичного прогрессирующего птеригиума при использовании различных способов барьерной амниопластики. Современные технологии в офтальмологии. 2016;4 (12):29–32 [Bochkareva A.N., Egorov V. V., Smoliakova G. P., Banshchikov P. A. Results of surgical treatment of primary progressive pterygium with using various techniques of barrier amnioplasty. Modern technologies in an ophthalmology. 2016;4 (12):29–32 (in Russ.)].
16. Билалов Э. Н. Изменения биохимических параметров слезной жидкости как один из факторов патогенеза птеригиума. РМЖ. Клиническая офтальмология. 2005;6 (3):123–124 [Bilalov E. N. Pathologic importance of the change in lacrimal secretion content via pterygium. RMJ. Clinical Ophthalmology. 2005;6 (3):123–124 (in Russ.)].
17. Бочкарева А. Н., Егоров В. В., Смолякова Г. П., Банщиков П. А. Влияние осмолярности слезной жидкости на течение регенеративно-репаративных реакций в хирургии первичного птеригиума. Современные технологии в офтальмологии. 2015;2 (6):144–146 [Bochkareva A.N., Egorov V. V., Smoliakova G. P., Banshchikov P. A. Influence of osmolarity of lacrimal fluid on regenerative and reparative reactions in surgery of primary pterygium. Modern technologies in an ophthalmology. 2015;2 (6):144–146 (in Russ.)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
