Введение
Гипертоническая болезнь (ГБ) и ишемическая болезнь сердца (ИБС) являются ведущими причинами смерти во всем мире [1, 2]. Основным осложнением артериальной гипертензии является повреждение микрососудов, связанное с нарушением вазомоторного тонуса и с повышением сосудистого сопротивления в связи с повышением артериального давления (АД) [3]. Основными провоцирующими факторами ИБС являются атеросклероз, спазм сосудов, прогрессирующий хронический воспалительный процесс с утолщением или стенозом артериальной стенки. ГБ является причиной 47% всех случаев ИБС во всем мире [4, 5]. Ранее было проведено много исследований, посвященных взаимосвязи ГБ и сосудистой системы сетчатки. Изменения глазного дна, наблюдаемые при ГБ, включают классические признаки гипертонической ретинопатии, такие как артериовенозные перекресты, генерализованное или очаговое сужение артериол, микроаневризмы, интраретинальные кровоизлияния, «ватные пятна» и отек ДЗН. Было доказано, что эти изменения повышают риск развития системных заболеваний, таких как инсульт и сердечно-сосудистые заболевания [6, 7]. В исследованиях также рассматривали более крупные сосуды сетчатки (200–300 мкм) с использованием цветных фотографий глазного дна и продемонстрировали корреляцию между диаметром артериол со стадией ГБ [3]. Факторы риска ИБС подробно описаны в литературе и хорошо известны практикующим врачам, но тем не менее сохраняется интерес к поиску методов и других маркеров, которые позволяют стратифицировать пациентов по риску развития ИБС.
Сетчатка имеет 2 источника кровоснабжения: сосуды сетчатки и хориокапилляры. Сосуды сетчатки снабжают внутренние 5 слоев сетчатки. Наружные 5 слоев сетчатки почти аваскулярны, получая кислород и питательные вещества из хориоидального кровотока — из хориокапилляров. Как ретинальные, так и хориоидальные сосуды снабжаются глазной артерией (ГА), одной из терминальных ветвей внутренней сонной артерии. Поскольку сосуды глазного дна имеют примерно такую же величину, как и коронарная микрососудистая сеть (~100–250 мкм в диаметре), они могут служить репрезентативными для процессов, протекающих при субклиническом коронарном стенозе [8].
Сосудистые изменения глазного дна могут быть обнаружены с помощью методов обследования: биомикро-офтальмоскопии, фоторегистрации глазного дна и флюоресцентной ангиографии (ФАГ) глазного дна. Несмотря на инвазивность ФАГ (внутривенное введение контрастного вещества) и побочные эффекты флюоресцеина, ФАГ уже более 50 лет рассматривается как «золотой стандарт» в диагностике анализа состояния сосудистого русла [9]. В последние годы в клинической практике используется оптическая когерентная томография-ангиография (ОКТ-А) — новый неинвазивный способ визуализации сосудов глазного дна. ОКТ-А применяется в качестве доступного инструмента ранней диагностики множественных глазных патологий, таких как возрастная макулярная дегенерация (ВМД) [10], диабетическая ретинопатия (ДР) [9] и гипертоническая ретинопатия [11].
Предыдущие исследования подтвердили связь между изменениями микроциркуляторного русла сетчатки и ИБС. Tabatabaee et al. (2013) обнаружили, что атеросклероз артерий сетчатки сильно коррелировал с тяжестью ИБС [12]. Wong et al. выявили корреляции между сужением артериол сетчатки и возникновением ИБС путем измерения диаметров отдельных артериол и венул по фото глазного дна [13]. Однако не проводилось исследований, изучающих связь между наличием ГБ, ИБС и изменениями сосудов сетчатки и хориоидеи с использованием ОКТ-А.
На сегодняшний день ученые всего мира с большим интересом изучают кровоток и плотность сосудов сетчатки с помощью ОКТ-А, которая может оценивать и количественно определять плотность сосудов в различных анатомических слоях глазного дна [14, 15]. ОКТ-А позволяет изучить площадь фовеолярной аваскулярной зоны (ФАЗ), плотность сосудов поверхностного сосудистого сплетения сетчатки (ПСПС) и плотность сосудов глубокого сплетения сетчатки (ПСГС), а также плотность сосудов в слое хориокапилляров (ПСХ). Авторы, изучающие плотность сосудов сетчатки при ГБ, получили противоречивые результаты: увеличение и уменьшение ФАЗ, повышение или снижение ПСПС сетчатки, повышение или снижение ПСГС сетчатки и слоя хориокапилляров [3, 11, 16–21]. С учетом того, что данные по изучению плотности сосудов сетчатки у пациентов с ГБ, особенно с ГБ и ИБС, противоречивы, и предпринято данное исследование.
Цель исследования: изучение офтальмологических клинико-функциональных показателей у пациентов с ГБ и ИБС со стенозом коронарных артерий.
Материал и методы
Были обследованы 60 человек (118 глаз). Из них 30 человек (58 глаз) — группа А с диагнозом ГБ (I, II, III стадии) с ИБС (стабильная ИБС — стенокардия напряжения) и 30 человек (60 глаз) — группа В — здоровые люди без ГБ или ИБС. Средний возраст составил 64,7±0,95 года. Пациенты группы А наблюдались у кардиолога и получали консервативное лечение (согласно рекомендациям Российского кардио-
логического общества). ИБС и стеноз коронарных артерий подтверждали с помощью коронарной ангиографии. Длительность ГБ с ИБС до 5 лет была отмечена у 15 (50,0%) пациентов, 6–10 лет — у 10 (33,3%) пациентов, 11–15 лет — у 3 (10,0%) пациентов, более 15 лет — у 2 (6,6%) пациентов. Во время наблюдения у всех пациентов группы А (30 человек) АД было стабилизировано до цифр 135/85 мм рт. ст. Для определения степени изменения глазного дна использовали классификацию гипертонической ретинопатии, предложенную в 1948 г. М.Л. Красновым, где выделяется 4 стадии: гипертоническая ангиопатия, гипертонический ангиосклероз, гипертоническая ретинопатия, гипертоническая нейроретинопатия.
Для выявления изменений микроциркуляторного русла сетчатки у пациентов с ГБ и ИБС оценивали и сравнивали показатели максимально корригированной остроты зрения (МКОЗ), светочувствительности макулы (СМ), внутриглазного давления (ВГД), центральной толщины сетчатки (ЦТС), площадь ФАЗ, ПСПС, ПСГС, ПСХ с помощью ОКТ-А у пациентов с ГБ и ИБС со стенозом коронарных артерий и у здоровых людей (без ГБ и ИБС).
Всем участникам исследования было проведено комплексное офтальмологическое обследование, включавшее оценку МКОЗ, ВГД, биомикроскопию в сочетании с биомикроофтальмоскопией, фундус-микропериметрию MAIA (CenterVue Spa, Италия), ОКТ-А (Optovue, США). Коронарную ангиографию проводили на аппарате Allura Xper FD20 (Philips Medical Systems Nederland B.V., Нидерланды).
Для группы А критерии включения: наличие компенсированной ГБ со стабильной ИБС (стенокардия напряжения), стеноз коронарных артерий. Критерии исключения: выраженная соматическая патология (патология печени, почек, сердечно-сосудистой, нервной систем), сахарный диабет, вторичная гипертензия, острый инфаркт миокарда, острое нарушение мозгового кровообращения в анамнезе, наличие других сердечно-сосудистых заболеваний, заболевания крови любого генеза. Для группы В критерии включения: отсутствие любой сердечно-сосудистой патологии, системных заболеваний, которые могут повлиять на сосуды глазного дна.
Офтальмологические критерии исключения для групп А и В: воспалительные заболевания глаз, глаукома любого генеза, нарушения рефракции средней или высокой степени, незрелая и зрелая катаракта, выраженное помутнение оптических сред, которое могло повлиять на ОКТ-А-визуализацию.
ОКТ-А
Перед проведением ОКТ-А всем пациентам был инстиллирован мидриатический препарат (тропикамид 0,8% + фенилэфрин 5,0%) 3 раза в течение 15 мин, а также анестезирующие глазные капли (проксиметакаин гидрохлорид 0,5%) для минимизации моргания. После полного расширения зрачка исследование выполнялось дважды (в 5-минутном интервале) в том же положении для получения изображений микроциркуляторного русла макулярной области (3×3 мм). Область измерения сканирования размером 3×3 мм была разделена на 5 подполей, состоящих из центра размером 1 мм и 4 квадрантов (верхний, нижний, внутренний и наружный). При каждом сканировании (3×3 мм) прибор автоматически измерял площадь ФАЗ, а также производил сегментацию по следующим границам: поверхностное сосудистое сплетение (рис. 1 А) с внутренней границей на 3 мкм ниже внутренней пограничной мембраны и внешняя граница на уровне 15 мкм ниже внутреннего плексиформного слоя; глубокое сосудистое сплетение (рис. 1 В) с внутренней границей на 15 мкм ниже внутреннего плексиформного слоя и с внешней границей на 70 мкм ниже внутреннего плексиформного слоя; слои хориокапилляров (рис. 1 С) — от 30 мкм до 60 мкм ниже плоскости пигментного эпителия сетчатки.

Результаты исследования
В ходе исследования пациентов группы А (58 глаз) с ГБ и ИБС при биомикроофтальмоскопии в соответствии с классификацией М.Л. Краснова диагностирована гипертоническая ангиопатия в 25 глазах (43,1%), гипертонический ангиосклероз — в 26 глазах (44,8%), гипертоническая ретинопатия — в 6 глазах (10,3%), гипертоническая нейроретинопатия — в 1 глазу (1,7%). В таблице 1 представлены основные офтальмологические показатели у пациентов групп А и B.
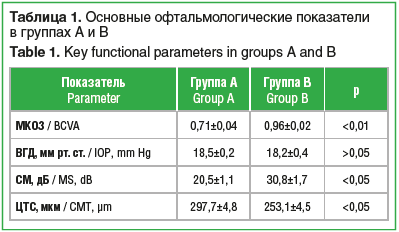
На рисунке 2 приведены данные пациента Ф., 65 лет. Диагноз — гипертоническая болезнь III cт., риск сердечно-сосудистых заболеваний — 4 (очень высокий), ИБС: стенокардия напряжения II функционального класса, гипертоническая ангиопатия. МКОЗ OD — 0,8. При проведении фундус-микропериметрии MAIA обнаружено снижение СМ до 12,6 дБ при отсутствии выраженных изменений на фото глазного дна и на горизонтальном ОКТ-скане в макулярной зоне.
Особое внимание в нашем исследовании уделялось измерению площади ФАЗ. У пациентов в группе В площадь ФАЗ составила 0,28±0,03 мм2. Соответствующий показатель в группе А был достоверно больше и составил 0,42±0,03 мм2 (p<0,05).
Плотность сосудов, измеренная с помощью ОКТ-А, является наиболее четким отражением состояния микроциркуляторного русла глазного дна (рис. 3).
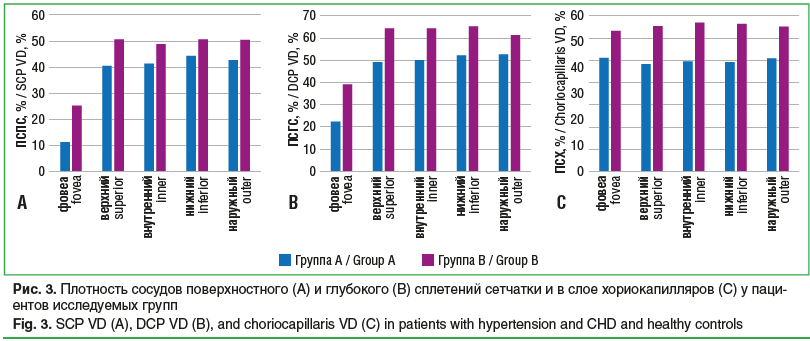
При проведении ОКТ-А ПСПС в группе А была снижена по сравнению с группой В во всех исследуемых зонах и составляла: в фовеа — 11,4±3,1%, в группе В — 25,4±2,5% (p<0,05), верхний сектор — 40,4±4,1%, в груп-пе В — 50,5±2,5% (p<0,05), внутренний сектор — 41,3±2,5%, в группе В — 48,8±3,1% (p<0,05), нижний сектор — 44,3±2,4%, в группе В — 50,6±3,1% (p<0,05), наружный сектор — 42,6±2,4%, в группе В — 50,3±3,7% (p<0,05).
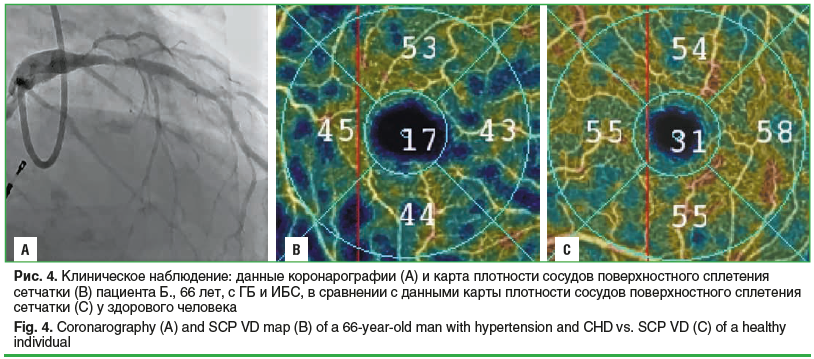
На рисунке 4 А представлены данные пациента Б. с ГБ и ИБС, при проведении коронарной ангиографии обнаружен стеноз передней нисходящей артерии более 70%. При проведении ОКТ-А (рис. 4 В) у пациента обнаружено снижение ПСПС сетчатки в большинстве исследуемых зон, которая составила в фовеа 17%, во внутреннем секторе — 43%, в нижнем секторе — 44%, наружном секторе — 45%. На рисунке 4 С приведены данные ПСПС сетчатки у пациента Д. без ГБ или ИБС, где плотность сосудов в зоне фовеа составляет 31%, в парафовеолярной зоне — 54–58%.
У пациентов с ГБ и ИБС наблюдалось статистически значимое более интенсивное снижение ПСГС и ПСХ (p<0,01). Так, ПСГС в группе А в зоне фовеа составила 22,3±1,1%, в группе В — 39,2±3,5% (p<0,05), верхний сектор — 49,1±3,7%, в группе В — 64,3±4,3% (p<0,05), внутренний сектор — 50,2±3,1%, в группе В — 64,2±4,1% (p<0,05), нижний сектор — 52,2±3,6%, в группе В — 65,1±3,7% (p<0,05), наружный сектор — 52,7±3,1, в группе В — 61,1±3,9% (p<0,05).
ПСХ у пациентов с ГБ и ИБС со стенозом коронарных артерий в зоне фовеа составила 51,2±1,1%, в группе В — 63,1±1,2% (p<0,05), верхний сектор — 48,1±2,2%, в груп-
пе В — 65,2±1,2% (p<0,05), внутренний сектор — 49,3±1,2%, в группе В — 66,8±1,2% (p<0,05), нижний сектор — 49,1±1,2%, в группе В — 66,2±1,1% (p<0,05), наружный сектор — 50,7±1,1%, в группе В — 65,2±1,6% (p<0,05).
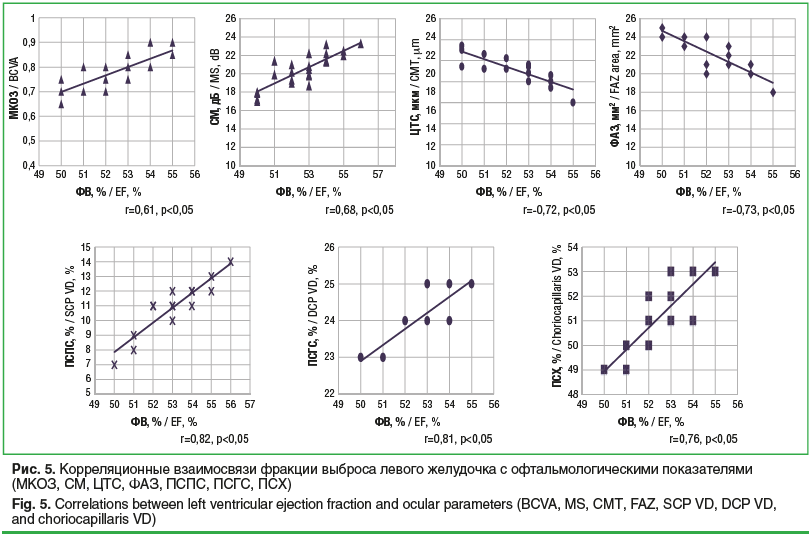
При обследовании пациентов с ГБ и ИБС со стенозом коронарных артерий выявлена статистически значимая корреляционная зависимость между показателем фракции выброса левого желудочка по Эхо-КГ и офтальмологическими показателями (рис. 5): МКОЗ — r=0,61 (p<0,05), СМ — r=0,68 (p<0,05), ЦТС — r=-0,72 (p<0,05), ФАЗ — r=-0,73 (p<0,05), ПСПС — r=0,82 (p<0,05), ПСГС — r=0,81 (p<0,05), ПСХ — r=0,76 (p<0,05).
Обсуждение
На сегодняшний день в мире активно изучается взаимосвязь между изменениями плотности сосудов сетчатки и ИБС. Так, у пациентов с ИБС отмечено, что степень атеросклероза артерий сетчатки коррелирует с тяжестью ИБС. Также выявлена взаимосвязь между сужением артериол сетчатки и развитием ГБ и ИБС, а учет диаметра сосудов сетчатки, особенно артериол, может позволить дать прогноз риска развития ГБ и ИБС. Все эти исследования проводились после того, как у пациентов с ГБ и ИБС появлялись клинически видимые признаки сосудистых изменений на глазном дне [8].
В данном исследовании нами не только изучались изменения глазного дна по данным биомикроофтальмоскопии, но и определялись такие параметры, как СМ, ПСПС, ПСГС, ПСХ у пациентов с ГБ и ИБС со стенозом коронарных артерий, даже при отсутствии видимых изменений на глазном дне. Изменения, диагностированные с помощью ОКТ-А с оценкой плотности сосудов, могут отражать тяжесть сердечно-сосудистых заболеваний. Так, неинвазивный метод исследования OКТ-А по сравнению с традиционной ФАГ и индоцианиновой зеленой ангиографией (ИЦЗА) имеет более высокое разрешение, чем имеющиеся в настоящее время ангиографические изображения [22]. ОКТ-А позволяет точно определить локализацию патологического процесса как в сетчатке, так и в хориоидальном микроциркуляторном русле, в то время как ФАГ используется для наблюдения сосудов сетчатки, а ИЦЗА более подходит для визуализации хориоидеи [23]. Для исследования сердечно-сосудистых заболеваний «золотым стандартом» является коронарная ангиография [24].
Данные исследования показали, что в группе А выявлено статистически значимое снижение плотности сосудов большинства зон сетчатки (p<0,05) по сравнению с показателями у пациентов в группе В. Также выявлено достоверное снижение МКОЗ у пациентов группы А. Особое внимание уделялось фундус-микропериметрии MAIA, которая выявляла снижение светочувствительности сетчатки еще до появления морфологических изменений по ОКТ. При проведении ОКТ оценивали ЦТС у пациентов с ГБ и ИБС со стенозом коронарных артерий и выявили статистически значимое утолщение сетчатки по сравнению с таковым в группе контроля.
Современная диагностика изменений сетчатки при ГБ и ИБС с использованием ОКТ-А и фундус-микропериметрии MAIA показывает, что имеет место статистически значимое снижение ПСПС, ПСГС, ПСХ и СМ еще до появления клинических проявлений на глазном дне. Таким образом, ОКТ-А является эффективным и неинвазивным методом исследования для выявления сосудистых изменений на глазном дне при ГБ и ИБС. Офтальмологический мониторинг пациентов с ГБ и ИБС может эффективно снизить риск развития глазных осложнений.
Выводы
У пациентов с ГБ и ИБС со стенозом коронарных артерий выявлены статистически значимое уменьшение МКОЗ (p<0,05) и СМ (p<0,05), увеличение ЦТС (p<0,05) и ФАЗ (p<0,05), уменьшение ПСПС (p<0,05), ПСГС (p<0,05) и ПСХ (p<0,05) в сравнении с показателями у здоровых лиц.
У пациентов с ГБ и ИБС со стенозом коронарных артерий выявлены корреляционные взаимосвязи офтальмологических показателей с кардиологическим показателем ФВ (ФАЗ — r=-0,73 (p<0,05), ПСПС — r=0,82 (p<0,05), ПСГС — r=0,81 (p<0,05), ПСХ — r=0,76 (p<0,05)).
Сведения об авторах:
1Мошетова Лариса Константиновна — д.м.н., профессор, академик РАН, заслуженный врач РФ, президент РМАНПО, заведующая кафедрой офтальмологии, ORCID iD 0000-0002-5899-2714;
1Воробьева Ирина Витальевна — д.м.н., доцент кафедры офтальмологии, ORCID iD 0000-0003-2707-8417;
1Дгебуадзе Ана — аспирант кафедры офтальмологии, ORCID iD 0000-0002-9518-0459;
1,2Остроумова Ольга Дмитриевна— д.м.н., профессор, заведующая кафедрой терапии и полиморбидной патологии, ORCID iD 0000-0002-0795-8225;
1,2Араблинский Александр Владимирович — д.м.н., профессор кафедры терапии и полиморбидной патологии, ORCID iD 0000-0002-2117-5016;
3Дельвер Евгений Петрович— к.б.н., старший научный сотрудник, ORCID iD 0000-0003-2319-7937;
3Белогуров Анатолий Александрович — к.б.н., ведущий научный сотрудник, ORCID iD 0000-0003-1594-9035.
1ФГБОУ ДПО РМАНПО Минздрава России. 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1.
2ГБУЗ ГКБ им. С.П. Боткина ДЗМ. 125284, Россия,
г. Москва, 2-й Боткинский пр-д, д. 5.
3НИИЭК ФГБУ «НМИЦ кардиологии» Минздрава России. 121552, Россия, г. Москва, ул. 3-я Черепковская, д. 15а.
Контактная информация: Дгебуадзе Ана, e-mail: dgebuadzeana@yahoo.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.03.2021.
About the authors:
1Larisa K. Moshetova — Doct. of Sci. (Med.), Professor, Full- Member of the Russian Academy of Sciences, Honored Doctor of Russian Federation, President of the Russian Medical Academy of Continuous Professional Education, Head of the Department of Ophthalmology, ORCID iD 0000-0002-5899-2714;
1Irina V. Vorobyeva — Doct. of Sci. (Med.), Associate Professor of the Department of Ophthalmology, ORCID iD 0000-0003-2707-8417;
1Ana Dgebuadze — postgraduate student of the Department of Ophthalmology, ORCID iD 0000-0002-9518-0459;
1,2Olga D. Ostroumova — Doct. of Sci. (Med.), Professor, Head of the Department of Therapy & Polymorbid Diseases, ORCID iD 0000-0002-0795-8225;
1,2Aleksandr V. Arablinskiy — Doct. of Sci. (Med.), Professor of the Department of Therapy & Polymorbid Diseases, ORCID iD 0000-0002-2117-5016;
3Evgeniy P. Delver — Doct. of Sci. (Biol.), Senior Researcher, ORCID iD 0000-0003-2319-7937;
3Anatoliy A. Belogurov — Doct. of Sci. (Biol.), Leading Researcher, ORCID iD 0000-0003-1594-9035.
1Russian Medical Academy of Continuous Professional Education. 2/1, Barrikadnaya str., Moscow, 123995, Russian Federation.
2S.P. Botkin City Clinical Hospital. 5, 2nd Botkinskiy passage, Moscow, 125284, Russian Federation.
3National Medical Research Center of Cardiology. 15A, 3rd Cherepkovskaya str., Moscow, 121552, Russian Federation.
Contact information: Ana Dgebuadze, e-mail: dgebuadzeana@yahoo.com. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.03.2021.
.
материал rmj.ru
