Статья посвящена особенностям комплексного лечения макулярного отека у пациентов с окклюзией вен сетчатки и нарушениями в системе гемостаза
В настоящее время наблюдается рост заболеваемости окклюзией вен сетчатки (ОВС), особенно у пациентов молодого и среднего возраста, что связано с увеличением количества сердечно-сосудистых заболеваний (ССЗ) и эндокринной патологии, являющихся предикторами развития ОВС. ССЗ — главная причина инвалидизации во всем мире. Атеротромбоз как наиболее грозное осложнение атеросклероза является причиной смертности почти в 30% случаев. Окклюзии ретинальных вен чаще всего происходят на фоне имеющейся у пациента кардиоваскулярной патологии. ОВС является маркером более серьезных нарушений со стороны сердечно-сосудистой системы в будущем [1]. Спустя 5 лет после перенесенного тромбоза центральной вены сетчатки (ЦВС) и ее ветвей 5,3% пациентов умирают от инсульта, 26% больных — от острого инфаркта миокарда, а у пациентов моложе 69 лет более чем в 2 раза увеличивается риск развития тромбоэмболий с последующим неблагоприятным исходом.
Данная тенденция наблюдается и в офтальмологии: в настоящее время растет заболеваемость сосудистой патологией сетчатки, приводящей к выраженному снижению зрительных функций [2]. По литературным данным, распространенность сосудистых заболеваний глаз составляет 34,7–54,9% от общего количества заболеваний сетчатки. ОВС — одна из причин внезапной, безболезненной, односторонней потери зрения, которая в 15% случаев приводит к инвалидности. ОВС составляет 60% всей острой сосудистой патологии глаза и стоит на втором месте по тяжести поражения сетчатки и прогноза после диабетической ретинопатии [3]. Коагулопатия, в основе которой лежит дисбаланс между тромбогенными и антитромбогенными факторами, играет ведущую роль в патогенезе ОВС. Важным звеном патогенеза ОВС является эндотелиальная дисфункция венозных сосудов, приводящая к локальному или общему нарушению физиологической функции эндотелия, лежащей в основе повышенной проницаемости сосудистой стенки и гиперкоагуляции, что имеет место у пациентов с ОВС [4, 5].
ОВС — тяжелое широко распространенное сосудистое заболевание сетчатки с внутрисосудистой обструкцией и образованием тромба, который, постепенно увеличиваясь в объеме, затрудняет отток крови из капилляров, вследствие чего повышается посткапиллярное сосудистое сопротивление, и венулы дистальнее места окклюзии начинают растягиваться. Венозный застой приводит к резкому повышению гидростатического давления в венулах и капиллярах, в результате чего повышается проницаемость сосудистой стенки. Повышение давления внутри ретинальных вен способствует выходу плазмы и форменных элементов крови за пределы сосуда, что клинически проявляется плазморрагиями, интраретинальными кровоизлияниями, отеком сетчатки и ведет к дальнейшему ухудшению гемодинамики. Развитие отека и повышение тканевого давления приводят к компрессии капилляров, что еще больше усугубляет застой крови и гипоксию сетчатки. В ответ на гипоксию сетчатка начинает вырабатывать цитокины, в т. ч. и васкулярный эндотелиальный фактор роста (Vascular endothelial growth factor — VEGF), который и способствует развитию кистозного макулярного отека (МО) и внутриглазной неоваскуляризации. МО является основным и практически постоянным клиническим признаком ОВС.
По данным литературы, у 18–41% пациентов с окклюзией ветви ЦВС в течение первых 3 мес. происходит полная резорбция МО, но примерно в 15% случаев он сохраняется более 1 года. Длительное существование отека сетчатки способствует повреждению капилляров, поддержанию высокого уровня ретинальной ишемии, что приводит к дальнейшей выработке VEGF и воспалительных цитокинов. VEGF активно участвует в поддержании сосудистого гомеостаза и выживаемости эндотелия, индуцируя продукцию оксида азота (NO) и простациклина. VEGF обладает аффинностью к эндогенному гепарину, подавляет апоптоз эндотелия и оказывает антикоагулянтное действие [6].
Термин «тромбофилия» означает предрасположенность к тромбозу вследствие генетических или приобретенных дефектов как прокоагулянтов, так и антикоагулянтов. Получены доказательства участия антифосфолипидных антител (АФА) и патологического эндогенного ингибитора тромбиногенеза волчаночного антикоагулянта (ВА) в патогенезе вазоокклюзивных поражений сетчатки. АФА могут встречаться в плазме пациентов с ОВС в 13,5% случаев [7, 8].
Консервативная терапия, предусматривающая назначение фибринолитиков, активаторов фибринолиза и антикоагулянтов, не всегда обеспечивает полную резорбцию тромба, что в конечном итоге ухудшает клинико-функциональные результаты лечения. Для лечения ОВС и МО активно используется лазеркоагуляция сетчатки, которая способствует рассасыванию кровоизлияний и плазморрагий на глазном дне, резорбции МО. Однако данная процедура не всегда выполнима при наличии обширных интра- и преретинальных геморрагий, гемофтальма [9, 10]. Хирургические способы лечения окклюзии ретинальных вен: интравитреальное введение гемазы, кортикостероидов, ранибизумаба, афлиберцепта — в настоящее время являются одними из перспективных, т. к. позволяют достичь быстрого лечебного эффекта за счет прямого или опосредованного действия как на тромб, так и на МО. Оперативные вмешательства могут вызывать развитие таких осложнений, как гемофтальм, отслойка сетчатки, эндофтальмит [9, 10].
Несмотря на многочисленные исследования, направленные на изучение этиологии и патогенеза тромбоза вен сетчатки, недостаточно изучены особенности клинико-лабораторных проявлений нарушений в системе гемостаза при сосудистой патологии сетчатки, соответственно, отсутствуют четкие указания для проведения профилактики и лечения таких больных. Патогенез развития ОВС, ассоциированных с АФА, уточняется, а данных об уровне VEGF в сыворотке крови в сочетании с ВА в доступной литературе найти не удалось. Разработка новых эффективных способов лечения ОВС является одной из основных задач современной офтальмологии.
изучить клинико-лабораторные нарушения в системе гемостаза, уровень VEGF и клинико-морфометрические параметры МО у пациентов с ОВС и ВА до и после комплексного лечения.
В исследовании участвовали 135 пациентов (140 глаз) с ОВС (мужчин — 61, женщин — 76), среди них 5 пациентов с поражением 2 глаз. Возраст пациентов — 52±10 лет. ОВС по типу тромбоза ветвей ЦВС — у 74 пациентов (60%), тромбоза ЦВС — у 53 (40%). Сопутствующие заболевания: гипертоническая болезнь (ГБ) — у 80 пациентов (59,2%), ишемическая болезнь сердца (ИБС) — у 20 (14,8%), варикозная болезнь вен нижних конечностей — у 35 (26%). Срок обращения от начала заболевания пациентов с ОВС — от 2 нед. до 1,5 мес. По результатам исследования нарушений системы гемостаза выделены 2 группы больных: группа 1 — 30 человек с ОВС и ВА; группа 2 — 105 человек с ОВС без ВА. Срок наблюдения — от 2 нед. до 2 лет. Контрольная группа состояла из 50 человек (мужчин — 20, женщин — 30, возраст 52±10 лет), у которых отсутствовали ОВС, ГБ и ИБС, онкологические заболевания, признаки тяжелых хронических инфекций; исключили беременных женщин и женщин, принимающих гормональные контрацептивы, пациентов с антифосфолипидным синдромом (АФС) и системными заболеваниями.
Лабораторные методы исследования. Исследования системы гемостаза проводились методами автоматизированной коагулометрии. Определяли активность фактора Виллебранда (фВ), антитромбина III, активированного протеина C (АПС), фактора VIII (VIIIф) в плазме; количественное содержание фактора V (Vф) в плазме, растворимых фибрин-мономерных комплексов (РФМК), фибриногена
(по Клаусу). Спонтанную и индуцированную агрегацию тромбоцитов (АДФ, коллаген, ристомицин, адреналин) изучали на агрегометре. Выявление ВА проводилось с использованием ядовых тестов, а также подтверждающих тестов с плазмой донора и корригирующими фосфолипидами, с повторным исследованием через 12 нед. Исследование сыворотки крови пациентов на VEGF выполнялось методом иммуноферментного анализа.
Офтальмологические методы исследования: визометрия, рефрактометрия, тонометрия, периметрия, прямая офтальмоскопия. Специальные методы исследования: осмотр глазного дна с линзой Гольдмана, флуоресцентная ангиография (ФАГ) глазного дна, оптическая когерентная томография (ОКТ), компьютерная периметрия.
Результаты исследования
У всех пациентов с ОВС имело место повышение активности компонентов системы гемостаза: активность фВ у пациентов без ВА по сравнению с контрольной группой была выше на 29,4%, у пациентов с ВА — на 17,6%; VIIIф — на 83% и 43,5% соответственно; АПС — на 45% и 20%; VEGF — на 38,5% и 78,1%; толщина сетчатки в фовеа — в 3,5 и 4,1 раза (табл. 1). Повышение уровней фВ и VIIIф, VEGF как с ВА, так и без ВА указывает на наличие повреждения эндотелия в венозном русле.
У всех пациентов с ОВС как без ВА, так и с ВА выявили тромбинемию: РФМК возрастает на 73,9% и 95,6% соответственно, фибриноген — на 18,8% и 31,2% (табл. 1).
Рост показателей степени агрегации тромбоцитов на все индукторы (АДФ, адреналин, ристомицин, коллаген) отмечается у больных с ОВС групп 1 и 2 до лечения соответственно: агрегация на АДФ возрастает в группе 1 на 30,8%, в группе 2 — на 19,2%, на адреналин — на 24% и 10%, на ристомицин — 41% и 23,2%, на коллаген — на 42,8% и 27,6%. Наибольший рост показателей степени агрегации тромбоцитов на все индукторы (АДФ, адреналин, ристомицин, коллаген) отмечается у больных с ОВС и ВА (группа 1) (табл. 2).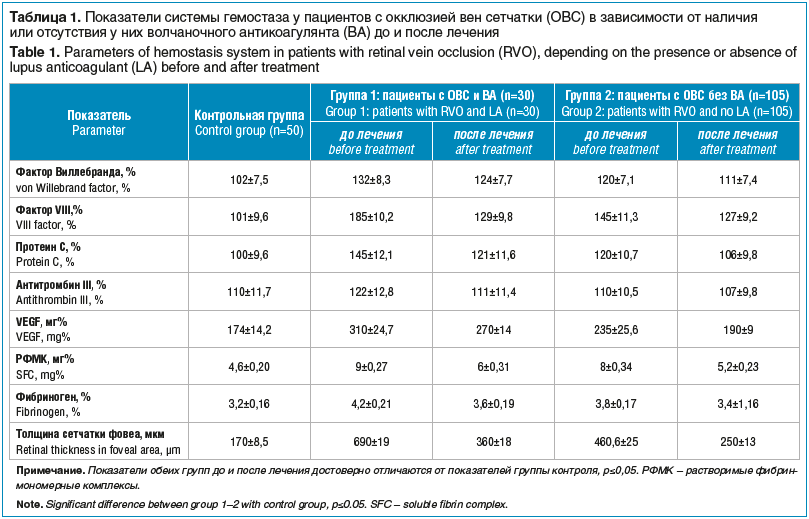
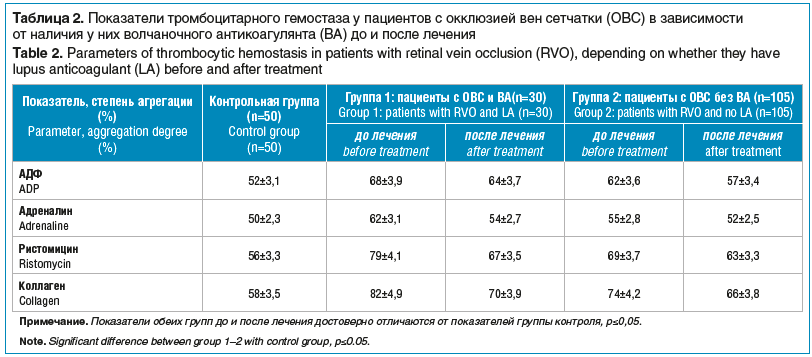
Высокий уровень коллагенозависимой гиперагрегации кровяных пластинок указывает на нарушение микроциркуляции и наличие микровазоокклюзивных процессов. Гиперагрегация тромбоцитов усугубляет состояние поврежденного сосудистого эндотелия, способствует повышению проницаемости сосудистой стенки и, следовательно, появлению отека, геморрагии и очагов дизории в сетчатке. Наличие у пациентов в крови ВА указывает на аутоиммунное воспаление в сосудистой стенке, что подтверждается повышением уровня фибриногена в 1,3 раза; меньшим уровнем ПС (по сравнению ОВС без ВА) вследствие его потребления, т. к. он обладает противовоспалительной активностью. У 30 пациентов (23,6%) с ОВС и ВА наблюдался диффузный персистирующий высокий кистозный МО (средняя толщина сетчатки в фовеа — 690±19 мкм). У больных с ОВС и ВА субфовеальная отслойка нейроэпителия сетчатки (НЭС) встречалась в 50% случаев (с частичной адгезией эпиретинальной мембраны (ЭРМ) без тракций). Сопоставление нарушений некоторых параметров системы гемостаза с ОВС и ВА с клиническими проявлениями ОВС показало, что выраженная эндотелиальная дисфункция, гиперкоагуляция у таких пациентов могут приводить к тяжелейшему ретинальному тромбогеморрагическому синдрому с ватообразными очагами в центральных отделах глазного дна; площадь ишемии, по данным ОКТ, составляет более чем 5 диаметров диска (ДД).
На рисунке 1 представлены данные пациентки Е., 52 года. Диагноз: ОВС и ВА левого глаза (давность — 4 нед.). Vis OS=0,08 н. к. На глазном дне отмечаются выраженный ретинальный тромбогеморрагический синдром, ватообразные очаги по сосудистым аркадам, кистозный МО. По данным ОКТ в макулярной зоне: высокий диффузный кистозный МО высотой в области фовеа — 763 мкм, парафовеа — 590–461 мкм, отслойка НЭС, d=1,06 мм; по сосудистым аркадам во внутренних слоях НЭС мягкий экссудат и зоны ишемии с частичной деструкцией фоторецепторов; частичная адгезия ЭРМ в перифовеа. ФАГ глазного дна: зоны капиллярной неперфузии, ишемии сетчатки, ликедж-синдром из сосудов сетчатки.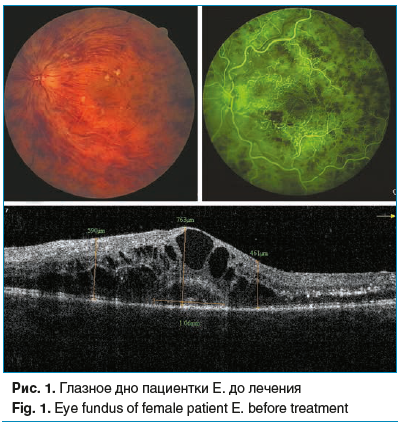
У больных с ОВС без ВА в 65% случаев выявили диффузный высокий МО с толщиной сетчатки в фовеа 560,6±25 мкм и наличием субфовеальной отслойки НЭС в 35%. Фокальный кистозный МО был выявлен в 35% случаев. Площадь зоны ишемии в сетчатке по данным ОКТ составляла 1–4 ДД.
Пациентам с ОВС и МО проводилось комплексное лечение по методу, описанному в патенте RU № 2614105-C1-2015 [9]. Способ лечения МО у пациентов с сосудистой патологией сетчатки включает лазерную коагуляцию сетчатки в виде субпороговой «фокальной решетки» в сочетании с медикаментозным лечением. Всем пациентам с ОВС были назначены глазные капли непафенак 0,01% по 1–2 капли 3 р./сут до лазеркоагуляции на 3–5 дней и после нее до 1,5–2 мес.
Пациентам с ОВС и ВА (группа 1) проводились подкожные инъекции надропарина кальция 0,6 мл № 6, затем пациентам с умеренными и высокими значениями ВА — дискретный плазмаферез. Продолжали лечение по методу, описанному в патенте. Кроме того, назначали нестероидные противовоспалительные средства (НПВС): диклофенак, индометацин в таблетках.
Все пациенты с ОВС в конце курса комплексного лечения получали антиоксиданты, антигипоксанты: депротеинизированный гемодериват крови телят 5% 5,0 внутримышечно № 10, инозин + никотинамид + рибофлавин + янтарная кислота внутривенно капельно № 10, затем по 1–2 таблетки 2 р./сут 30 дней; этилметилгидроксипиридина сукцинат парабульбарно 0,3–0,5 мл с лидокаином (1:1) 1 р./сут № 5; этилметилгидроксипиридина сукцинат внутримышечно 2 мл 0,5% № 10; пиридоксин + фолиевая кислота + цианокобаламин по 1 таблетке 1 р./сут до 1 мес. 2–3 р./год; винограда красных листьев экстракт сухой 2 капсулы 2 р./сут до 2 мес.; очищенная микронизированная флавоноидная фракция (диосмин + флавоноиды в пересчете на гесперидин) 500 мг 2 р./сут до 2 мес.
У больных группы 1 после дискретного плазмафереза, а также лечения по схеме, описанной в патенте, значительно снизилось потребление прокоагулянтов и естественных антикоагулянтов по сравнению с показателями до лечения (табл. 1) соответственно: фВ — на 7,5%, VIIIф — на 12,4%, VEGF — на 14,8%, ПС — на 11,7%; уменьшилась толщина сетчатки в макуле на 31,2%. После комплексного лечения у пациентов группы 2 (табл. 1) снизился уровень показателей прокоагулянтов и естественных антикоагулянтов по сравнению с показателями параметров гемостаза и толщины сетчатки в макуле до лечения соответственно: фВ — на 6,%, VIIIф — на 30,7%, VEGF — на 19,1%, ПС — на 16,5%, толщина сетчатки — на 39,1%.
У всех пациентов после комплексного лечения ОВС как без ВА, так и с ВА уменьшились показатели тромбинемии: РФМК — на 35 % и 33,3% соответственно, фибриноген — на 10,5% и 14,3% (табл. 1).
У всех пациентов с ОВС после лечения отмечалось снижение показателей степени агрегации тромбоцитов на все индукторы (АДФ, адреналин, ристомицин, коллаген) по сравнению с показателями до лечения: агрегация на АДФ снизилась на 7,7% (группа 1) и 9,6% (группа 2), адреналин — на 16% и 5,4%, ристомицин — на 2,3% и 10,7%, коллаген — на 20,6% и 13,8%. Наибольшее снижение показателей степени агрегации тромбоцитов на все индукторы отмечено у больных группы 1.
Анализ результатов исследования параметров системы гемостаза (фВ, VIIIф, АПС, РФМК, фибриноген, тромбиновое время) у пациентов с ОВС, а также содержания цитокина в плазме — VEGF и толщины сетчатки в макуле у всех пациентов после курсов лечения по патенту и, в дополнение к нему, после применения дискретного плазмафереза и низкомолекулярных гепаринов у пациентов группы 1 показал, что у всех пациентов в обеих группах снизились тромбогенная активность в микроциркуляторном русле сетчатки, проницаемость капилляров сетчатки, улучшился лимфоотток, что привело либо к разрешению МО, либо к уменьшению толщины сетчатки в макуле.
На рисунке 2 представлены данные пациентки Е. после лечения. Vis=0,4 н. к. Диагноз: посттромботическая ретинопатия левого глаза (спустя 3,5 мес. после лечения). Глазное дно OS: резорбция ретинальных геморрагий, ватообразных очагов, диспигментация в макуле, паравазально и парамакулярно лазеркоагуляты. ОКТ макулярной зоны: частичный регресс высокого кистозного МО с восстановлением контура фовеальной ямки, сохранением мелких кистозных полостей во внутреннем ядерном слое, толщина сетчатки в фовеа — 333 мкм, в парафовеа — 462–376 мкм; полное прилегание имевшейся отслойки НЭС, частичная деструкция фоторецепторов d=800 мкм; частичное истончение ПЭС, субфовеальная гиперрефлективность. ФАГ глазного дна: уменьшение зон капиллярной неперфузии и ишемии в сетчатке, частичный регресс МО.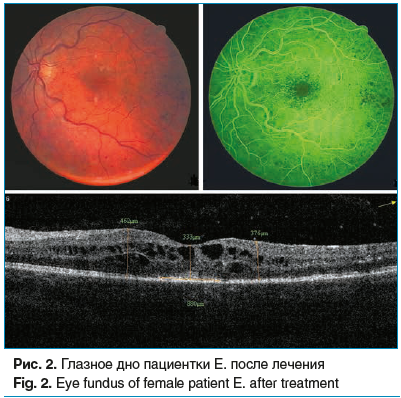
Выводы
У пациентов с ОВС и МО с ВА до комплексного лечения и после него обнаружены отклонения от нормы параметров гемостаза и эндотелиальная дисфункция фВ, VIIIф, АПС, VEGF.
ВА встречается в 23,6% случаев у пациентов с ОВС. ВА значительно снижает тромборезистентность эндотелия микроцикуляторного русла сетчатки и усиливает гиперкоагуляцию и тромбинемию, ломает естественную регуляцию системы гемостаза и усугубляет ишемию сетчатки. ВА участвует в патогенезе ОВС и персистирующего кистозного МО.
ВА усугубляет эндотелиальную дисфункцию в микроциркуляторном русле, поддерживает аутоиммунное воспаление и участвует в патогенезе МО, ЭРМ.
Предложенный комплекс лечения МО снижает тромбогенную активность в микроциркуляторном русле сетчатки, проницаемость капилляров сетчатки, способствует улучшению лимфооттока, что приводит либо к разрешению МО, либо к уменьшению толщины сетчатки в макуле.
Пациентам с МО необходимо проводить не только офтальмологический мониторинг, но и исследования уровня прокоагулянтов и физиологических антикоагулянтов системы гемостаза, присутствия ВА в плазме, VEGF — в сыворотке крови. Это позволит назначить своевременную адекватную антикоагулянтную, дезагрегантную, антиоксидантную терапию и дискретный плазмаферез.
Сведения об авторах: 1Шелковникова Татьяна Васильевна — к.м.н., врач-офтальмолог высшей категории лазерного отделения; 2Тахчиди Христо Периклович — д.м.н., профессор, член-корр. РАН, проректор по лечебной работе; 3Вавин Григорий Валерьевич — к.м.н., доцент кафедры; 1Баркова Наталья Юрьевна — врач-офтальмолог высшей категории; 3Шишлянникова Нина Юрьевна — к.х.н., доцент кафедры. 1ГБУЗ КО КОКОБ. 650066, Россия, г. Кемерово, пр. Октябрьский, д. 22а. 2ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117097, Россия, г. Москва, ул. Островитянова, д. 1. 3ФГБОУ ВО КемГМУ Минздрава России. 650028, Россия, г. Кемерово, пр. Ворошилова, д. 22а. Контактная информация: Шелковникова Татьяна Васильевна, e-mail: t.shelkovnikova@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов: отсутствует. Статья поступила 22.09.2018.
About the authors: 1Tatiana V. Shelkovnikova — MD, PhD, ophthalmologist of Laser Department; 2Khristo P. Takhchidi — MD, PhD, Professor, Corresponding Member of the Russian Academy of Sciences, Vice-Rector for Medical Work; 3Grigorii V. Vavin — MD, PhD, Associate Professor; 1Natalia Yu. Barkova — ophthalmologist; 3Nina Yu. Shishlyannikova — PhD in Chemistry, Associate Professor. 1Kemerovo Regional Clinical Ophthalmologic Hospital. 22a, Oktyabrskii prosp., Kemerovo, 650066, Russian Federation. 2Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117097, Russian Federation. 3Kemerovo State Medical University. 22a, Voroshilova prosp., Kemerovo, 650028, Russian Federation. Contact information: Tatiana V. Shelkovnikova, e-mail: t.shelkovnikova@gmail.com. Financial Disclosure: no author have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 22.09.2018.
материал rmj.ru
