Альбинизм — это клинически и генетически гетерогенная группа наследственных заболеваний, в основе патогенеза которых лежит нарушение биосинтеза меланина, приводящее к полному или частичному его отсутствию. Клинически снижение количества меланина проявляется в гипопигментации кожи, волос и глаз. Поражение глаз включает гипопигментацию или отсутствие пигмента глазного дна и радужной оболочки, гипоплазию фовеа, снижение остроты зрения, нистагм, косоглазие, фотофобию и трансиллюминацию радужки. Кроме того, у пациентов с альбинизмом при исследовании зрительных вызванных потенциалов, МРТ или трактографии выявляется неправильная маршрутизация волокон зрительных нервов в хиазме (перекрестная асимметрия) — чрезмерный переход височной доли волокон на противоположную сторону [1, 2].
Средняя частота альбинизма в мире составляет 1:17000, частота носительства — 1:70 (варьирует в зависимости от региона) [3].
Содержание статьи
Глазной альбинизм
Глазной альбинизм 1 типа (альбинизм глазной Нетлшипа — Фолза, OA1, XLOA, OMIM (Online Mendelian Inheritance in Man) #300500) — Х-сцепленный рецессивный тип альбинизма, фенотипически проявляющийся в основном у мужчин. Причиной глазного альбинизма являются мутации в гене GPR143, расположенном на Х-хромосоме в регионе Xp22 и кодирующем одноименный белок. Белок GPR143 представляет собой рецептор, связанный с G-белком (GPCR), который продуцируется исключительно меланоцитами и пигментным эпителием сетчатки. Для этого типа альбинизма характерны инфантильный нистагм, снижение остроты зрения до 0,3 [4], обеднение пигмента радужной оболочки и глазного дна, гипоплазия фовеа, фотофобия. Пигмент волос и кожи сохранен. Широко распространены мозаичная гипопигментация радужной оболочки и трансиллюминация радужки 1-й степени у женщин-носительниц, не сопровождающиеся снижением остроты зрения [4, 5]. Описаны случаи поражения женщин при гомозиготной мутации в гене GPR143 или при неслучайной инактивации X-хромосомы. Частота заболевания, по данным базы Orphanet, составляет 1–9:100000 [3]. Мутации в этом гене также связаны с X-сцепленным врожденным нистагмом 6 типа (OMIM#300808).
Глазо-кожный альбинизм
Глазо-кожный альбинизм объединяет группу заболеваний с аутосомно-рецессивным типом наследования, для которых, в отличие от изолированного глазного альбинизма, дополнительным характерным признаком является гипопигментация кожи и волос. Воздействие солнечных лучей на гипопигментированную кожу приводит к пахидермии, актиническому дерматиту и раку кожи, базальноклеточной и плоскоклеточной карциноме и, реже, меланоме, что может встречаться даже у гетерозиготных носителей [6].
Молекулярно-генетический дефект выявляется примерно у 60% пациентов с клиническими проявлениями альбинизма. Значительное число из оставшихся 40% являются гетерозиготными носителями патогенных мутаций в генах TYR или OCA2: описаны случаи развития заболевания при наличии патогенной мутации на одной аллели и двух полиморфных вариантов — на другой [7, 8].
Глазо-кожный альбинизм 1 типа (OCA1) ассоциирован с геном TYR, расположенным на хромосоме 11 в положении 11q14.3, и разделяется на два клинических подтипа: глазо-кожный альбинизм 1A и 1B типов. Ген TYR кодирует ключевой фермент меланогенеза — тирозиназу, участвующую в следующих этапах меланогенеза: гидроксилирование тирозина до диоксифенилаланина (ДОФА) и окисление ДОФА до L-ДОФА. На сегодняшний день в базе Human Gene Mutation Database описано более 350 патогенных вариантов в гене TYR [9], подавляющее большинство которых продуцируют неактивный фермент и приводят к фенотипу глазо-кожного альбинизма 1A типа, а около 10 вариантов продуцируют фермент с остаточной активностью (гипоморфные варианты) и, соответственно, приводят к фенотипу глазо-кожного альбинизма 1B типа. Глазо-кожный альбинизм 1 типа составляет около 40% от всех случаев альбинизма [10], его частота в мире — 1–9:100000 [3].
Глазо-кожный альбинизм 1А типа (OCA1A, OMIM#203100) является «классическим» типом альбинизма. Пациенты с глазо-кожным альбинизмом 1A типа с рождения имеют белые волосы и ресницы, белую кожу, неспособную к загару. При морфологическом исследовании биоптата кожи выявляются амелановые меланоциты. Глазные аномалии включают отсутствие пигмента в радужной оболочке и на глазном дне, гипоплазию фовеа 3–4-й степени. Острота зрения может варьировать в пределах от 0,05 до 0,15 [4].
Глазо-кожный альбинизм 1В типа (OCA1B, OMIM#606952) также обусловлен мутациями в гене TYR, однако при этом типе сохраняется остаточная активность тирозиназы. Фенотипически этот тип проявляется неполной гипопигментацией глаз, волос и кожи, компенсирующейся с возрастом: при рождении пациенты имеют белые или светло-желтые волосы, которые с возрастом незначительно темнеют; белая кожа со временем накапливает пигмент и может слегка загореть при пребывании на солнце. Синие радужки с возрастом темнеют до зеленого/орехового или светло-коричневого/коричневого цвета за счет накопления меланина и наличия меланосом. Транс-
иллюминация радужки сохраняется в пределах 1–3-й степени [11], острота зрения составляет 0,3–0,5 [4, 12].
Глазо-кожный альбинизм 2 типа (OCA2, OMIM#203200) ассоциирован с геном OCA2 (OMIM#611409), расположенным на участке 15q12-q13. Ген OCA2 кодирует меланосомальный трансмембранный хлоридный канал, обеспечивающий поддержание pH в меланосомах и меланоцитах. Количество кожной пигментации при этом типе колеблется от минимального до почти нормального. Новорожденные с глазо-кожным альбинизмом 2 типа имеют слегка пигментированные волосы, брови и ресницы, цвет которых варьирует от светло-желтого до светло-коричневого и коричневого и может незначительно потемнеть с возрастом. Острота зрения в среднем составляет 0,3 [4, 10]. Глазо-кожный альбинизм 2 типа — второй по частоте среди всех видов альбинизма, на его долю приходится около 30% всех случаев. Частота в мире составляет 1–9:100000 [3].
Глазо-кожный альбинизм 3 типа (OCA3, OMIM#203290), именуемый также рыжим типом альбинизма, связан с мутациями в гене TYRP1 (OMIM#115501), расположенном на 9-й хромосоме в положении 9p23. TYRP1 — тирозиназа-зависимый ген 1, кодирующий B-каталазу, которая является стабилизирующим белком тирозиназы наравне с допахромтаутомеразой (DCT, TYRP2, см. глазо-кожный альбинизм 8 типа) и преимущественно участвует в образовании эумеланина. Фенотипически глазо-кожный альбинизм 3 типа имеет более мягкий фенотип за счет накопления феомеланина: кожа незначительно гипопигментирована и способна к загару, в некоторых случаях могут появляться веснушки, волосы имеют рыжеватый/медный оттенок. Снижение остроты зрения и другие глазные патологии обнаруживаются не во всех случаях, что также связано с накоплением феомеланина. Ключевыми симптомами к диагнозу являются нистагм, красный зрачковый рефлекс и трансиллюминация радужки [13]. Частота заболевания составляет менее 1:1000000 в мире и 1:8500 в южноафриканских популяциях [3].
Глазо-кожный альбинизм 4 типа (OCA4, OMIM#606574) ассоциирован с геном SLC45A2 (OMIM#606202), кодирующим мембранный белок — переносчик сахарозы/H+ и расположенным на участке 5p13. Количество кожной пигментации колеблется от минимального до почти нормального. У новорожденных волосы обычно имеют цвет от серебристо-белого до светло-желтого и могут незначительно потемнеть с возрастом. Острота зрения может варьировать от 0,6 до 0,05 в зависимости от количества присутствующего пигмента, но обычно находится в диапазоне 0,2–0,1 и стабилизируется по достижении пациентом возраста 3 лет. Глазо-кожный альбинизм 4 типа наиболее распространен в Японии, но был обнаружен также в популяциях Северной Европы, Индии и Кореи, средняя распространенность в мире составляет 1:100000 [10, 14].
Глазо-кожный альбинизм 5 типа (OCA5, OMIM#615312) впервые был обнаружен в пакистанской близкородственной семье в 2012 г. Молекулярно-цитогенетическая диагностика выявила делецию локуса 4q24. В настоящий момент не найдена точная корреляция с каким-либо из генов-кандидатов. Фенотипически пациенты, страдающие этим типом альбинизма, имеют светлую кожу, золотистые/светло-желтые волосы и типичные глазные проявления альбинизма. В описанной пакистанской семье острота зрения составляет 0,1 [15].
Глазо-кожный альбинизм 6 типа (OCA6, OMIM#113750) ассоциирован с геном SLC24A5 (OMIM#609802), локализованным на участке 15q21.1 и кодирующим К+-зависимый Na+/Ca2+-обменник, экспрессирующийся преимущественно в структурах кожи и глаз. Гипопигментация обусловлена снижением эумеланина, но за счет остаточного количества феомеланина пациенты имеют светлую кожу со склонностью к легкому загару и появлению пигментных невусов, волосы — от белых до светло-коричневых, цвет глаз — от голубого до коричневого с типичными для альбинизма поражениями. Острота зрения колеблется от 0,3 до 0,05 [16]. Распространенность в мире составляет менее 1:1000000 [3].
Глазо-кожный альбинизм 7 типа (OCA7, OMIM#615179) ассоциирован с геном LRMDA (OMIM#614537), расположенным на длинном плече 10-й хромосомы в положении 10q22.2-q22.3 и кодирующим богатый лейцином белок, связанный с дифференцировкой меланоцитов. Такие люди имеют светло-русые или коричневые волосы, светлую кожу, способную к загару, у них могут появляться веснушки. Глаза светлые — голубые или зеленые, с явлениями нистагма, трансиллюминацией радужной оболочки и гипопигментированным глазным дном с гипоплазией фовеа. Острота зрения колеблется от 0,3 до 0,05 [17]. Распространенность в мире составляет менее 1:1000000 [3].
Глазо-кожный альбинизм 8 типа (OCA8) ассоциирован с геном DCT (TYRP2) и описан Pennamen et al. в 2020 г. в двух неродственных семьях. Ген DCT кодирует фермент допахромтаутомеразу, который катализирует превращение допахрома в дигидроксииндол-2-карбоновую кислоту. Фенотипические проявления 8 типа глазо-кожного альбинизма: легкая гипопигментация кожи и волос и умеренные поражения глаз, типичные для альбинизма (нистагм, светобоязнь, трансиллюминация радужки, гипопигментация сетчатки и глазного дна, гипоплазия фовеа 0–1-й степени, снижение остроты зрения до 0,4–0,5) [18, 19].
Редкие наследственные синдромы в сочетании с альбинизмом
Кроме изолированного глазного и глазо-кожного типов существуют редкие наследственные синдромы альбинизма, связанные с системными поражениями. К ним относятся синдром Германски — Пудлака и синдром Чедиака — Хигаси.
Синдром Германски — Пудлака
Синдром Германски — Пудлака (Hermansky — Pudlak syndrome, HPS) впервые описан в 1959 г. в двух неродственных семьях у пациентов с альбинизмом, геморрагическим диатезом и пигментированными ретикулярными клетками в костном мозге, а также в биоптатах лимфатических узлов и печени.
Синдром Германски — Пудлака относится к орфанным заболеваниям: его частота в мире составляет от 1:50000 до 1:1000000, однако некоторые типы распространены в Пуэрто-Рико (так, частота 1 типа в этой популяции составляет 1:1800, 3 типа — 1:16000) [10].
В настоящее время синдром Германски — Пудлака включает 11 типов, ассоциированных с 11 генами. Главным патогенетическим звеном выступает нарушение адапторного белкового комплекса-3 (AP3) или системы биогенеза комплекса связанных с лизосомами органелл (BLOC 1–3), являющихся важными компонентами мембран цитоплазматических органелл и участниками транспортировки везикул. Дефекты белков, составляющих эти комплексы, приводят к патологическим изменениям в структуре и функции лизосом, меланосом, плотных гранул тромбоцитов.
Основные клинические проявления синдрома Германски — Пудлака: альбинизм, отложение пигмента в клетках ретикуло-эндотелиальной системы и нарушение агрегации тромбоцитов (за счет отсутствия плотных гранул, содержащих серотонин, адениновые нуклеотиды, Са2+, фибриноген, адреналин, фактор Виллебранда, антигепариновый фактор). Геморрагический диатез может проявляться частыми носовыми, десневыми, интра- и послеоперационными кровотечениями, меноррагией у женщин. В лабораторных показателях отмечается отсутствие плотных гранул тромбоцитов, выявляемое при электронной микроскопии, при нормальном количестве тромбоцитов и нормальном протромбиновом времени. Кроме того, с синдромом Германски — Пудлака связаны гранулематозный колит, легочный фиброз и кардиомиопатия (характерные не для всех типов), возникающие из-за цероидоподобных отложений в тканях [20, 21]. Краткая клиническая характеристика всех известных типов синдрома Германски — Пудлака приведена в таблице 1 [19–37].
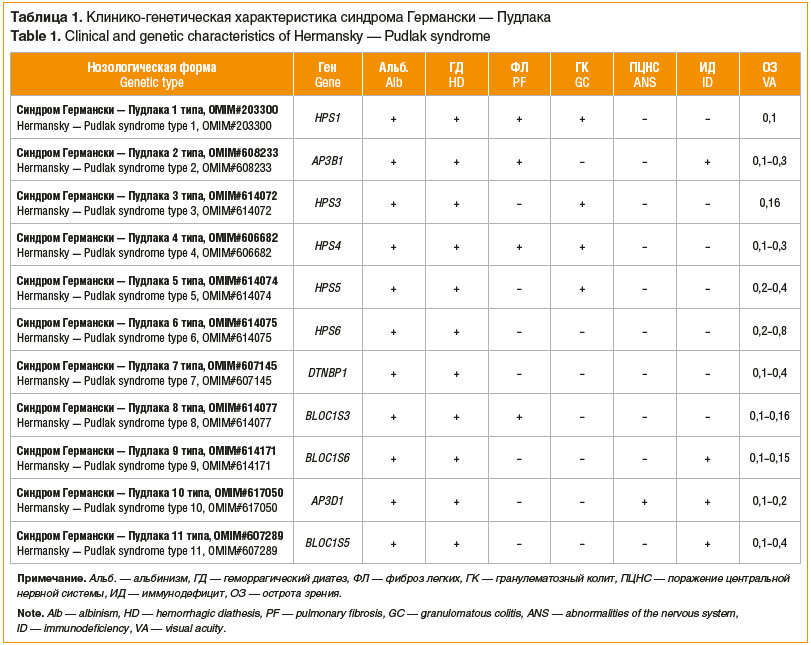
Альбинизм и геморрагический диатез проявляются при всех типах синдрома Германски — Пудлака. Основными различиями являются системные проявления: так, фиброз легких развивается при 1, 2, 4 и 8 типах, высокий риск развития гранулематозного колита имеется при 1, 3, 4 и 5 типах. Клеточный иммунодефицит с повышенным риском развития гемофагоцитарного лимфогистиоцитоза чаще встречается у пациентов с 2, 9, 10 и 11 типами синдрома. При 10 типе также описано поражение ЦНС, включающее задержку моторного развития, мышечную гипотонию и эпилепсию.
Синдром Чедиака — Хигаси
Синдром Чедиака — Хигаси (CHS, OMIM#214500) — редкий аутосомно-рецессивно наследуемый синдром, развитие которого связано с мутациями в гене LYST (OMIM#606897), кодирующем адапторный белок, участвующий в регуляции лизосомального транспорта.
Впервые синдром Чедиака — Хигаси описан Beguez — Cesar в 1943 г., впоследствии Чедиак (в 1952 г.) и Хигаси (в 1954 г.) дополнили фенотипическое описание синдрома. В настоящее время в мире описано около 500 случаев этого заболевания, однако точное количество пациентов невозможно установить в связи с существованием аномальных мягких форм, при которых диагноз подтверждается в 30 лет и позже [38], либо из-за повторных описаний пациентов в течение жизни [39].
Фенотипическими проявлениями синдрома Чедиака — Хигаси являются глазо-кожный альбинизм, геморрагический диатез, неврологические нарушения, а также первичный иммунодефицит и повторные инфекционные заболевания. Зрительные нарушения включают горизонтальный нистагм, астигматизм, гипопигментацию радужки, гипоплазию макулы и фовеа. Острота зрения варьирует от 0,3 до нормальных показателей [40]. Поражение нервной системы проявляется задержкой моторного и психоречевого развития, периферической нейропатией, атаксией, паркинсонизмом и судорогами; при обследовании выявляется снижение глубоких сухожильных рефлексов, снижение скорости нервной проводимости, на МРТ обнаруживается диффузная атрофия головного и спинного мозга, выявляются также гигантские гранулы в шванновских клетках при биопсии [41, 42]. При лабораторном исследовании крови отмечаются: гигантские включения в полиморфноядерных нейтрофилах и, в меньшей степени, в лимфоцитах; нормальное или пониженное количество естественных клеток-киллеров с аномально сниженной функцией; нейтропения и нарушение функции нейтрофилов, таких как хемотаксис и внутриклеточная бактерицидная активность; отсутствие или пониженное количество и неправильная морфология плотных гранул тромбоцитов [39].
У 65–85% пациентов с синдромом Чедиака — Хигаси в течение первого десятилетия жизни на фоне инфекционного процесса развивается фаза «акселерации» с быстропрогрессирующей массивной лимфопролиферативной реакцией, «цитокиновым штормом» и риском развития гемофагоцитарного лимфогистиоцитоза [43].
Редкие наследственные синдромы с частичным альбинизмом
Гено-фенотипические корреляции при разных типах альбинизма до сих пор не установлены: даже пациенты, заболевание у которых обусловлено одинаковыми мутациями, могут обладать различными по степени выраженности клиническими проявлениями, в том числе в пределах одной семьи. Кроме того, существуют наследственные заболевания, связанные с гипопигментацией структур глаз, кожи и волос, но не имеющие ключевых признаков альбинизма, таких как гипоплазия фовеа, гипопигментация глазного дна, неправильный перекрест зрительных нервов и нистагм, — такие синдромы входят в группу частичного, или парциального, альбинизма. К этим состояниям относятся синдром Грисцелли, синдром Ваарденбурга, синдром Титца, болезнь Аландских островов и синдром FHONDA. Кроме того, необходимо дифференцировать глазной альбинизм и группу заболеваний с Х-сцепленным врожденным нистагмом.
Синдром Грисцелли — аутосомно-рецессивно наследуемый синдром с частичным альбинизмом: присутствует умеренная гипопигментация кожи и седые/серебристо-серые волосы без поражения глаз. Различают 3 типа заболевания в зависимости от вовлеченного гена и фенотипических особенностей: при 3 типе (ген MLPH, OMIM#609227) отмечается только гипопигментация кожи и волос, при 1 типе (ген MYO5A, OMIM#214450) присутствует неврологический дефицит со спастичностью, гемипарезом, эпилепсией и умственной отсталостью. При 2 типе (ген RAB27A, OMIM#607624) у пациентов также выявляются клеточный иммунодефицит и высокий риск развития гемофагоцитарного синдрома.
Синдром Ваарденбурга обладает генетической и фенотипической гетерогенностью, включая тип наследования — большинство типов наследуются аутосомно-доминантно с неполной пенетрантностью и вариабельной экспрессивностью, отдельные типы наследуются и аутосомно-рецессивно. Известны все гены, ассоциированные с синдромом Ваарденбурга: 1 и 3 типа — PAX3, 2А типа — MITF, 2D типа — SNAI2, 2Е и 4С типа — SOX10, 4A типа (вариабельное наследование в зависимости от патогенного варианта — аутосомно-доминантный (AD) либо аутосомно-рецессивный (AR)) — EDNRB, 4B типа (также AD- либо AR-наследование) — EDN3. Основными признаками этой группы заболеваний являются нейросенсорная тугоухость, лицевые дизморфии (характерны для отдельных типов), нарушение пигментации пряди волос в лобной области (пьебалдизм), полная или частичная гетерохромия радужек, дистопия медиальной спайки век, гипопигментация радужки и глазного дна с нистагмом (описаны не при всех типах).
Синдром альбинизма-глухоты Титца (синдром Титца, TADS, OMIM#103500) является аллельным вариантом синдрома Ваарденбурга 2А типа, а также вызывается гетерозиготной мутацией в гене MITF. Основные клинические проявления — голубой цвет радужки, гипопигментация сетчатки, волос и кожи, но без признаков нистагма и трансиллюминации радужки и с сохранной остротой зрения. Отличительная особенность — двусторонняя нейросенсорная тугоухость 3–4-й степени [44].
Болезнь Аландских островов, она же — глазной альбинизм Форсиуса — Эрикссона (AIED, OMIM#300600), связана с мутациями гена CACNA1F, локализованного на X-хромосоме, и является эндемичным заболеванием для этой группы островов. Впервые описана в 1964 г. Forsius и Eriksson в пределах одной семьи у мужчин в 6 поколениях. К клиническим признакам относятся протановый дальтонизм, гипопигментация глазного дна, фовеальная гипоплазия, снижение остроты зрения, нистагм, миопия, астигматизм. Острота зрения варьирует от 0,1 до 1,2. У женщин-носительниц наблюдались незначительные нарушения цветовосприятия и нистагм без мозаичной гипопигментации глазного дна. Отличительной особенностью этого типа альбинизма является отсутствие макромеланосом в биоптатах кожи и аномального перекреста зрительных нервов в хиазме [45]. Патогенные варианты в гене CACNA1F в других популяциях описаны у пациентов с врожденной стационарной ночной слепотой (CSNB2A, OMIM#300071).
Заключение
Альбинизм — редкое, клинически и генетически гетерогенное состояние с множеством форм, но, несмотря на длительность и большое количество проводимых исследований, не до конца изученное. В настоящее время продолжается поиск генов, мутации в которых ответственны за глазо-кожный альбинизм или редкие синдромальные формы альбинизма: в 2020 г. описаны два новых заболевания — глазо-кожный альбинизм 8 типа и альбинизм 11 типа (синдром Германски — Пудлака).
Пациенты с альбинизмом должны наблюдаться офтальмологами и дерматологами, однако при выявлении синдромальной формы необходимо подключать к наблюдению и врачей других специальностей — пульмонологов, гематологов, неврологов и гастроэнтерологов — для решения вопроса о начале терапии и профилактике осложнений. Кроме того, необходимо выявление корреляции между генотипом, клиническими проявлениями и тяжестью течения заболевания для прогнозирования жизни пациентов, а также определение популяционной частоты заболеваний и носительства гетерозиготных мутаций в генах и выявление других типов наследования — для планирования деторождения.
Сведения об авторах:
Кадышев Виталий Викторович — к.м.н., ст. научный сотрудник лаборатории генетической эпидемиологии, заведующий кафедрой офтальмогенетики Института ВиДПО, врач-генетик, офтальмолог; ORCID iD 0000-0001-7765-3307.
Ряжская Светлана Андреевна — клинический ординатор; ORCID iD 0000-0002-5224-5726.
Халанская Ольга Владимировна — ассистент кафедры офтальмогенетики Института ВиДПО; ORCID iD 0000-0003-2708-9220.
Журкова Наталия Вячеславовна — к.м.н., ст. научный сотрудник лаборатории генетической эпидемиологии; ORCID iD 0000-0001-6614-6115.
Зинченко Рена Абульфазовна — д.м.н., профессор, заместитель директора по научно-клинической работе, заведующая лабораторией генетической эпидемиологии; ORCID iD 0000-0003-3586-3458.
ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова». 115522, Россия, г. Москва, ул. Москворечье, д. 1.
Контактная информация: Кадышев Виталий Викторович, e-mail: vvh.kad@gmail.com.
Источник финансирования: работа выполнена при финансовой поддержке РНФ, проект № 17-15-01051, и государственного задания Министерства науки и высшего образования РФ.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 16.02.2021.
About the authors:
Vitaly V. Kadyshev — C. Sc. (Med.), senior researcher of the Laboratory of Genetic Epidemiology, Head of the Department of Ophthalmogenetics of the Institute of Higher and Additional Vocational Education, geneticist, ophthalmologist; ORCID iD 0000-0001-7765-3307.
Svetlana A. Ryazhskaya — clinical resident; ORCID iD 0000-0002-5224-5726.
Olga V. Khalanskaya — Assistant of the Department of Ophthalmogenetics of the Institute of Higher and Additional Vocational Education; ORCID iD 0000-0003-2708-9220.
Nataliya V. Zhurkova — C. Sc. (Med.), senior researcher of the Laboratory of Genetic Epidemiology; ORCID iD 0000-0001-6614-6115.
Rena A. Zinchenko — Dr. Sc. (Med.), Professor, Deputy Director for Scientific Clinical Work, Head of the Laboratory of Genetic Epidemiology; ORCID 0000-0003-3586-3458.
Research Center for Medical Genetics. 1, Moskvorechye str., Moscow, 115522, Russian Federation.
Con tact information: Vitaly V. Kadyshev, e-mail: vvh.kad@gmail.com.
Financial Disclosure: the study is supported by the RSF (research project No. 17-15-01051) and State Target of the Ministry of Science and Higher Education of Russian Federation. No authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 16.02.2021.
.
материал rmj.ru
