Введение
На сегодняшний день глаукома рассматривается как приобретенная и прогрессирующая оптическая нейропатия, характеризующаяся развитием типичной картины повреждения зрительного нерва и последующими изменениями полей зрения, требующая регулярного наблюдения и постоянного длительного лечения [1]. Глаукома выявляется в мире у каждого 200-го человека старше 40 лет, а среди людей старше 80 лет она диагностируется у каждого 8-го пациента [2]. Раннее выявление и оценка прогрессирования важны для своевременного назначения лечения и, в случае необходимости, его коррекции.
Диагностика и мониторинг заболевания осуществляются путем анализа объема функциональных и структурных изменений. В то время как функциональные повреждения оцениваются при помощи периметрических тестов, структурные изменения выявляются при помощи оптической когерентной томографии (ОКТ). ОКТ-признаки глаукомы включают в себя изменения как в слое ганглиозных клеток сетчатки (ГКС), внутреннем плексиформном слое [3–5], так и в слое нервных волокон сетчатки (СНВС) [6]. Однако диагностически значимые изменения обнаруживаются к тому времени, когда уже наступает выраженное глаукомное повреждение структур сетчатки. Поскольку в патогенезе глаукомы играют роль как механический, так и сосудистый факторы, важным дополнением к диагностике структурных и функциональных изменений служит исследование сосудистой сети сетчатки [7]. Таким образом, изменения капиллярной перфузии являются ранними показателями дисфункции еще не утраченных ГКС [7]. Множество исследований, посвященных изучению взаимосвязи периметрических и сосудистых изменений, описывают более выраженную корреляцию периметрических данных (MD — mean deviation, среднее отклонение) с параметрами ОКТ с ангиографией (ОКТ-А), чем с параметрами ОКТ [8–10].
Исследователи, изучавшие макулярную микрососудистую сеть при глаукоме, выявили выраженное снижение сосудистой плотности в поверхностном сплетении, откуда кровоснабжаются СНВС и ГКС, при относительно сохранном глубоком сплетении [4, 10–12]. Отмечается, что области снижения макулярной перфузии в поверхностном сосудистом сплетении соответствуют участкам истончения ГКС и дефектам в поле зрения [11, 13]. Таким образом, подтверждается наличие тесной взаимосвязи между структурными и сосудистыми дефектами, однако остается неясным, что является причиной, а что — следствием.
Помимо снижения макулярной сосудистой плотности при глаукоме также изменяется состояние фовеолярной аваскулярной зоны (ФАЗ), увеличиваются ее площадь и периметр [14]. Сравнение параметров ФАЗ и периметрических данных при глаукоме выявляет достоверную зависимость между площадью ФАЗ и выраженностью дефектов в поле зрения [15]. Помимо значений площади и периметра диагностическую ценность представляет индекс циркулярности (circularity index, CI), используемый для оценки конфигурации границ ФАЗ. В норме она близка к форме круга, однако при появлении микрососудистых изменений отмечается ее расширение и неравномерность краев за счет выпадения капилляров в парафовеальной области, что приводит к снижению значения CI [14, 16].
Изучение состояния микроциркуляторного русла сетчатки, а также его взаимосвязи с изменениями чувствительности сетчатки по данным поля зрения на сегодняшний день считается незаменимым инструментом в ранней диагностике и мониторинге глаукомы.
Давно известно, что даже достижение стойкой компенсации внутриглазного давления (ВГД) при глаукоме не останавливает прогрессирования процесса. В связи с этим разработаны нейроретинопротекторные методы лечения, представляющие собой комплекс мероприятий, направленных на уменьшение продолжающейся дистрофии аксонов и сохранение неповрежденных нейрональных клеток [17].
Одним из методов нейроретинопротекторной терапии является трофическая модифицированная лазеркоагуляция (тМЛК). В основе метода лежит создание участков локального дозированного воспаления при помощи диодного лазера (810 нм). Коагуляты наносятся транссклерально в области проекции плоской части цилиарного тела. Лазерное излучение поглощается пигментным эпителием, формируется ожог, являющийся источником медиаторов, которые поступают в стекловидное тело через его прикрепленный базис, накапливаются в витреальном депо и постепенно с витреальным током достигают задних отделов — сетчатки и зрительного нерва. Метод характеризуется достижением стойкого улучшения функциональных показателей у пациентов с глаукомной оптической нейропатией (ГОН) [17]. Нейроретинопротекторными свойствами также обладают препараты полипептидов сетчатки глаз, например комплекс водорастворимых полипептидных фракций (КВПФ) Ретиналамин, действие которого определяется его метаболической активностью — путем нормализации функций клеточных мембран, улучшения внутриклеточного синтеза белка регуляции процессов перекисного окисления липидов и оптимизации энергетических процессов [18, 19].
Целью настоящего исследования явилось изучение динамики параметров микроциркуляторного русла у пациентов с развитой стадией первичной открытоугольной глаукомы (ПОУГ) при проведении различных видов нейроретинопротекторной терапии.
Материал и методы
Всего в исследовании приняли участие 50 пациентов (78 глаз) с развитой стадией ПОУГ, из них в основную группу вошли 25 человек (46 глаз). Группу контроля составили 25 человек (32 глаза). Средний возраст пациентов, включенных в исследование, составил 79,5 (77; 83) года: в основной группе — 81 (78; 83) год, в контрольной группе — 78,5 (77; 81) года (p>0,05).
Критерии включения: развитая стадия ПОУГ; компенсированное ВГД; сохранные зрительные функции (острота зрения исследуемого глаза с коррекцией ≥0,1); длительность заболевания более 1 года; достаточная прозрачность оптических сред для проведения исследований глазного дна.
Критерии исключения: нарушения прозрачности роговицы любой этиологии; наличие любой ретинальной патологии в анамнезе, в т. ч. перенесенные ретинальные окклюзии; наличие иной патологии зрительного нерва; наличие воспалительной офтальмопатологии острого или хронического характера; отягощенный аллергологический анамнез, данные о гиперчувствительности к применяемым препаратам; любые другие состояния, затрудняющие участие в клиническом исследовании.
В исследовании участвовали пациенты с нормализованным уровнем ВГД, при этом гипотензивная терапия, которую они уже получали на момент включения, оставалась неизменной, с соблюдением привычного режима. Группы были сопоставимы по данным периметрии и ОКТ-А.
Всем пациентам до начала лечения и в процессе исследования проводились: визометрия, авторефрактометрия, биомикроскопия, офтальмоскопия, измерение офтальмотонуса, анкетирование для субъективной оценки зрительных функций, компьютерная статическая периметрия (HFA II 750i, Carl Zeiss, Германия), ОКТ-А (RTVue XR OCT Avanti, Optovue, Inc., CШA) с оценкой параметров ФАЗ, а также измерение артериального давления. Обследования в группах проводили во время 1-го визита до начала лечения (V1), через 3 дня после начала лечения (V2), через 8 дней после начала лечения (V3), через 1 мес. после лечения (V4), через 6 мес. после лечения (V5).
Субъективная оценка зрительных функций проводилась при помощи опросника, разработанного коллективом сотрудников кафедры офтальмологии им. А.П. Нестерова лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Егоров А.Е., Глазко Н.Г., Мовсисян А.Б.). Оценка результатов происходит после процедуры шкалирования: чем выше итоговая сумма, тем лучше ощущение зрительных функций самим пациентом.
Для анализа состояния ФАЗ вычислялись следующие параметры: площадь, периметр и CI.
В основной группе в 1-й день выполнялась тМЛК при помощи диодного лазера 810 нм «АЛОД-01» («Алком-Медика», Россия). Затем в течение 8 дней ежедневно проводились парабульбарные инъекции КВПФ Ретиналамина. В контрольной группе в течение 8 дней проводился традиционный комплекс терапевтических мероприятий для лечения ГОН, включающий в себя антиоксидантные, сосудорасширяющие, ноотропные и ретинопротекторные препараты. Курс состоял из внутривенного введения раствора пентоксифиллина 5 мл + 0,9% NaCl 100 мл; раствора этилметилгидроксипиридина сукцината 5 мл + 0,9% NaCl 100 мл; внутримышечного введения: раствора метилэтилпиридинола 1 мл; Ретиналамина 5 мг, растворенного в 2 мл 0,9% NaCl. Внутривенно проводилось 8 вливаний, препараты вводились через день; внутримышечное введение обоих лекарственных препаратов осуществлялось ежедневно, всего 8 инъекций каждого препарата
Статистическая обработка полученных результатов выполнялась при помощи программ Microsoft Excel 2013, SPSS версии 21, MedCalc. Применялись следующие методы: вычисление средней арифметической (М), медианы (Ме), среднеквадратического отклонения (SD), интер-квартильного размаха (Q25–Q75), уровня значимости (p). Межгрупповые сравнения проводились с использованием U-критерия Манна — Уитни, для внутригрупповых сравнений использовался T-критерий Вилкоксона. При изучении взаимосвязи признаков применялся метод корреляционного анализа, коэффициент корреляции Пирсона (r). Оценка силы связи коэффициентов корреляции осуществлялась по шкале Чеддока. Критический уровень значимости для соответствующих критериев составлял p<0,05.
Результаты исследования
Показатели остроты зрения в обеих группах оценивались в каждой точке обследования пациента. Результаты, полученные в основной группе, где проводилась тМЛК с ежедневным введением КВПФ, отражают достоверное (р<0,05) улучшение остроты зрения в сравнении с исходными значениями (0,591±0,033), достигающее максимального значения на 8-й день от начала лечения (0,706±0,081, р<0,05) и сохраняющееся вплоть до 1 мес. после окончания курса (0,685±0,086, р<0,05), с тенденцией к сохранению результатов выше исходных вплоть до 6-го месяца наблюдения (0,603±0,087, р<0,05). В то же время в контрольной группе, где проводилось консервативное лечение ГОН, достоверной динамики средних показателей зрительных функций относительно исходных данных (0,588±0,097) не выявлялось: на 8-й день — 0,609±0,096 (р>0,05); через 1 мес.— 0,6±0,092 (р>0,05); через 6 мес.— 0,594±0,88 (р>0,05).
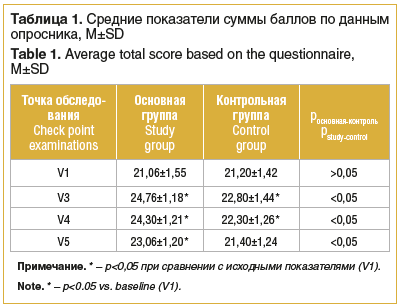
Сравнение полученных показателей субъективной оценки зрительных функций самими пациентами говорит о достоверной (р<0,05) положительной динамике субъективных зрительных ощущений в основной группе относительно исходных данных в течение всего периода наблюдения пациентов (табл. 1). В контрольной группе улучшение (р<0,05) прослеживается сразу после окончания лечения и в течение 1-го месяца наблюдения, однако к 6-му месяцу наблюдается возвращение показателей к исходным значениям (см. табл. 1).
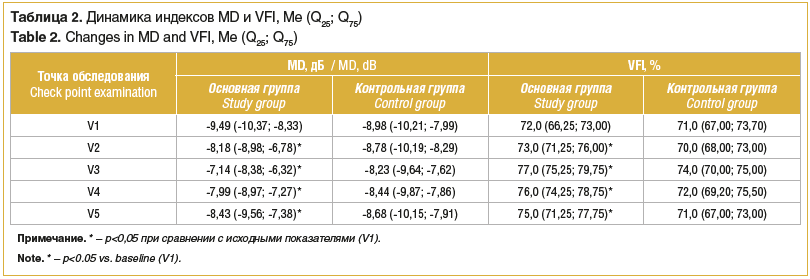
В основной группе уменьшение значения показателя MD отмечается уже на 3-й день после начала лечения, продолжается вплоть до 8-го дня после начала лечения, до 6-го месяца наблюдения значения показателей остаются меньше исходных (p<0,05) (табл. 2).
VFI (visual field index, индекс поля зрения) также увеличивается в течение всего периода лечения и сохраняется на достигнутом уровне в течение 1-го месяца наблюдения. Несмотря на снижение значений к 6-му месяцу наблюдения, показатели сохраняются выше исходных (p<0,05). В контрольной группе статистически достоверной динамики MD и VFI выявлено не было в течение всего периода наблюдения пациентов.
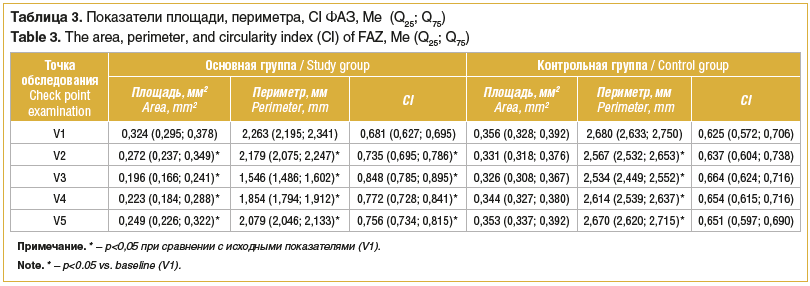
В таблице 3 приведена динамика площади и периметра, CI ФАЗ. После окончания лечения в основной группе площадь ФАЗ уменьшилась на 33%, через 1 мес. показатели площади сохранялись меньше исходных на 28,7%, а через 6 мес. — на 16,8%. Значения периметра ФАЗ у пациентов основной группы после окончания лечения были ниже исходных данных на 26,7%, через 1 мес. — на 17,6%, через 6 мес. — на 8,1%. После курса лечения в основной группе отмечалось увеличение показателя CI, приближение его значения к 1,0, что говорит о том, что форма ФАЗ становилась более сглаженной, уменьшалась фестончатость краев и неравномерность контура. Это свидетельствовало об активации кровотока в макулярной зоне, т. е. в спавшихся ветвях микрососудистого русла центральной области сетчатки обнаруживалось движение клеток крови, что регистрировалось при помощи ОКТ-А. В контрольной группе достоверной динамики параметров ФАЗ выявлено не было.
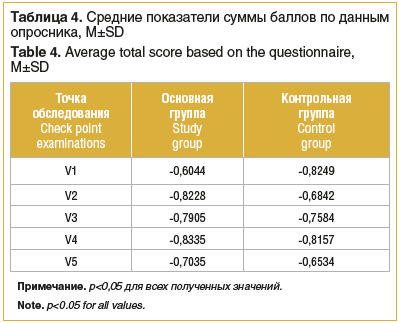
Сравнение периметрических данных и результатов ОКТ-А в основной группе выявило достоверную обратную корреляционную зависимость между периметрическим индексом MD и всеми показателями ФАЗ (р<0,05), наибольшей силы — с показателем площади. В связи с этим дальнейшее сравнение проводилось между MD и площадью ФАЗ. Во всех точках исследования была выявлена высокая, статистически достоверная (р<0,05) корреляция (табл. 4) в обеих группах, независимо от метода лечения.
Заключение
Использование метода ОКТ-А позволило выявить улучшение состояния микроциркуляторного русла и ФАЗ за счет активации кровотока в спавшихся капиллярах парафовеальной капиллярной сети. Это подтверждается уменьшением площади, периметра и увеличением CI ФАЗ при проведении нейроретинопротекторной терапии методом, использующим управляемое асептическое воспаление, в сочетании с курсом ретинопротекторной поддержки КВПФ у пациентов с развитой стадией ПОУГ. Выявленная взаимосвязь параметров ФАЗ и периметрических индексов вне зависимости от метода лечения свидетельствует о том, что оценка параметров ФАЗ по данным ОКТ-А может использоваться в качестве объективного критерия для мониторинга течения ГОН, наравне с применением компьютерной статической периметрии.
Благодарность
Авторы и редакция благодарят ООО «ГЕРОФАРМ» (Россия) за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Acknowledgement
The authors and Editorial Board appreciate LLC “Geropharm” (Russian Federation) for providing full-text foreign articles required for literature review.
Сведения об авторах:
1Глазко Надежда Геннадьевна — врач-офтальмолог, ORCID iD 0000-0002-1175-3695;
1,2Егоров Алексей Евгеньевич — д.м.н., профессор кафедры офтальмологии им. А.П. Нестерова лечебного факультета, заведующий офтальмологическим отделением, ORCID iD 0000-0003-2637-1830.
1ГБУЗ «ГВВ № 2 ДЗМ». 109472, Россия, г. Москва, Волгоградский пр-т, д. 168.
2ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Глазко Надежда Геннадьевна, e-mail: nadezda.baeva@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 11.12.2020.
About the authors:
1Nadezhda G. Glazko — ophthalmologist, ORCID iD 0000-0002-1175-3695;
1,2Aleksei E. Egorov — Doct. of Sci. (Med.), professor of A.P. Nesterov Department of Ophthalmology, Head of the Department of Ophthalmology, ORCID iD 0000-0003-2637-1830.
1Hospital for War Veterans No. 2. 168, Volgogradskiy av., Moscow, 109472, Russian Federation.
2Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117437, Russian Federation.
Contact information: Nadezhda G. Glazko, e-mail: nadezda.baeva@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 11.12.2020.
.
материал rmj.ru
