Введение
В последние десятилетия наблюдается рост встречаемости грибковых синуситов [1–4]. Это обусловлено существенным увеличением количества пациентов с факторами риска их развития, среди которых ведущие позиции занимают иммунодефицитные состояния, вызванные длительным использованием глюкокортикоидных и иммуносупрессивных препаратов, онкологические и гематологические заболевания, СПИД, массивная антибактериальная терапия, соматическая патология, в частности сахарный диабет, бронхиальная
астма и пр. [5–7].
Различают инвазивные и неинвазивные формы грибковых синуситов. К инвазивным формам относят острый инвазивный грибковый синусит, хронический инвазивный грибковый синусит, хронический гранулематозный инвазивный грибковый синусит. Неинвазивные формы включают в себя аллергический грибковый синусит и грибковое тело (шар) [8]. Отличительной чертой инвазивных грибковых синуситов является наличие деструкции костной стенки околоносовых пазух (ОНП), а также сосудистой инвазии [9]. Развитие той или иной формы во многом зависит от иммунологического состояния макроорганизма. Острые инвазивные грибковые синуситы обычно встречаются у иммунокомпрометированных пациентов, в то время как хронические инвазивные и неинвазивные синуситы характерны для пациентов с нормальным иммунным статусом (иммунокомпетентных) [10, 11].
Особую опасность грибковые синуситы представляют для иммунокомпрометированных пациентов, находящихся в процессе трансплантации гемопоэтических стволовых клеток (ТГСК) [5, 12]. При этом инфекционные осложнения могут возникать как в периоде после трансплантации, так и на этапе проведения противоопухолевой химиотерапии (ПХТ), которая выполняется с целью достижения ремиссии основного заболевания и обеспечения возможности проведения ТГСК [13].
Среди гематологических заболеваний к группе повышенного риска развития инвазивных микозов относятся пациенты с острым миелобластным лейкозом (ОМЛ) в период проведения ПХТ индукции ремиссии [14]. У большинства пациентов с ОМЛ для обеспечения долгосрочной выживаемости программной химиотерапии недостаточно и единственным излечивающим методом терапии является аллогенная ТГСК [15, 16]. Развитие инвазивного микоза на этапе ПХТ может быть препятствием для своевременного проведения ТГСК, но при ранней диагностике и адекватной терапии наличие инвазивного микоза до трансплантации не влияет на долгосрочные результаты [13].
Представляем клиническое наблюдение успешного лечения инвазивного мукормикоза ОНП, возникшего на этапе ПХТ, перед аллогенной ТГСК.
Клиническое наблюдение
Пациентка Г., 44 года, находилась на лечении в отделении химиотерапии и трансплантации костного мозга НИИ ДОГиТ им. Р.М. Горбачевой с диагнозом «Острый миелоидный лейкоз без созревания» (М1 вариант по франко-американо-британской классификации). Ремиссия ОМЛ не была достигнута в результате стандартного курса ПХТ индукции ремиссии по схеме «7+3» (непрерывное введение цитарабина в течение 7 дней и болюсное введение митоксантрона в течение 3 дней). Для индукции ремиссии была назначена ПХТ «FLAG-Ida» (режим, включающий использование флударабина, цитарабина, гранулоцитарного колониестимулирующего фактора, а также идарубицина), достигнута ремиссия основного заболевания. В соответствии с российскими и международными рекомендациями, с учетом возраста, диагноза, течения заболевания пациентке было показано проведение аллогенной ТГСК от донора в первой ремиссии [17]. В российском и международном регистре был инициирован поиск совместимого донора для трансплантации. С целью закрепления и поддержания полученного эффекта пациентке начата стандартная ПХТ консолидации ремиссии с использованием высоких доз цитарабина со 2 июля 2019 г. С начала курса ПХТ у пациентки диагностирован бартолинит, по поводу которого была назначена комбинированная антибактериальная терапия (цефоперазон + сульбактам, ванкомицин). На 15-й день от начала химиотерапии, 9-й день агранулоцитоза и тромбоцитопении 4-й степени, на фоне проводимой антибактериальной терапии развилась нейтропеническая лихорадка, отмечался рост показателя С-реактивного белка до 245 мг/л с единственным клиническим признаком локализованной инфекции — заложенностью носа. На обзорной рентгенограмме обнаружено затемнение верхнечелюстной пазухи. Выполнена пункция левой верхнечелюстной пазухи, по результатам исследования при микроскопии и бактериологического исследования промывных вод возбудителя не обнаружено. Модифицирована антибактериальная терапия (имипенем + циластатин, линезолид, тигециклин) — с временным эффектом. На 17-й день от начала химиотерапии (11-й день агранулоцитоза) возобновились подъемы температуры тела выше 38 °C, появился отек над- и подглазничной области слева.
На компьютерной томографии (КТ) ОНП отмечалось субтотальное затемнение левой верхнечелюстной пазухи без признаков деструкции костных стенок (рис. 1 А).
С учетом группы риска и клинических проявлений, которые могут быть характерны для инвазивного микоза ОНП, пациентке назначена противогрибковая профилактика препаратом позаконазол.
Повторно выполнена пункция левой верхнечелюстной пазухи, по результатам исследования на 2-е сутки посева получен рост мукорового гриба Lichtheimia corymbifera. С учетом группы риска, клинических проявлений и лабораторного подтверждения, в соответствии с критериями Европейской организации по изучению и лечению рака (European Organization for Research and Treatment of Cancer) и Группы изучения микозов (Mycoses Study Group) Национального института аллергологии и инфекционных заболеваний (The National Institute of Allergy and Infectious Diseases, NIAID), США [9] установлен диагноз мукормикоза с поражением верхнечелюстной пазухи и начата стартовая антимикотическая терапия в соответствии с рекомендациями 2019 г. [18]: амфотерицин В (липидный комплекс) внутривенно в дозе 5 мг/кг/сут. Проводились пункции левой верхнечелюстной пазухи на фоне антимикотической терапии.
С целью оценки динамики проводимого лечения через 5 дней терапии амфотерицином В в сочетании с позаконазолом (10 дней) 29.07.2019 была выполнена контрольная КТ ОНП, на которой обнаружена деструкция носовых раковин, стенок решетчатого лабиринта слева, нарастание отека (рис. 1 В).
С учетом появления деструкции костей на фоне терапии принято решение об оперативном лечении в объеме эндоскопического вскрытия левой верхнечелюстной пазухи, несмотря на затянувшуюся цитостатическую панцитопению. По данным миелограммы подтверждено наличие ремиссии основного заболевания. В качестве терапии спасения, с учетом появления деструкции к комбинированной терапии добавлен каспофунгин.
В клинике НИИ ДОГиТ им. Р.М. Горбачевой 01.08.2019 в условиях общей анестезии пациентке было выполнено оперативное вмешательство по поводу острого левостороннего грибкового синусита. Показатели крови в день операции: тромбоциты — 22 (норма — 150–400×109/л), гемоглобин — 74 (норма — 115–145 г/л), лейкоциты — 1,4 (норма — 4–8,8×109/л), нейтрофилы (абс.) — 0,72 (норма — 2,2–4,8×109/л), лимфоциты (абс.) — 0,5 (норма — 1,2–2,5×109/л). С целью профилактики интра- и пост-
операционного кровотечения пациентке было введено 0,503 мл тромбоцитарной взвеси.
Интраоперационные находки: при осмотре средняя и нижняя носовые раковины синюшны, некротизированы, также отмечается некроз латеральной стенки левой половины носа (рис. 2А). Выполнена резекция средней и нижней носовых раковин. Затем сформировано широкое соустье с левой верхнечелюстной пазухой. Отмечается мягкость костных стенок в области среднего и нижнего носовых ходов. В пазухе обнаружены полипозные изменения фиброзной плотности, патологические участки удалены. В конце операции вскрыты клетки решетчатого лабиринта. Интраоперационный материал был отправлен в отделение клинической микробиологии для микроскопического и микологического (культурального) исследования. Проведен гемостаз классической передней и задней тампонадой. В результатах микроскопии обнаружен мицелий мукорового гриба (рис. 2В).
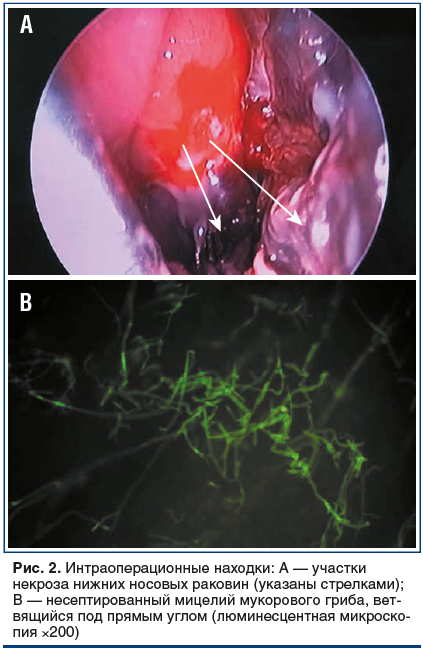
Послеоперационный период протекал без осложнений. В условиях операционной 05.08.2019 выполнено растампонирование полости носа, а также ревизия левой верхнечелюстной пазухи, резекция патологических участков.
В послеоперационном периоде пациентка наблюдалась врачом-оториноларингологом, проводился туалет полости носа, продолжалась комбинированная противогрибковая терапия. Ее продолжительность составила 2 нед. после операции, с последующей деэскалацией. Контроль эффективности терапии проводился путем эндоскопического осмотра и микологического исследования отделяемого из послеоперационной раны.
Несмотря на высокий риск возврата инфекции и развития жизнеугрожающих осложнений, с целью сохранения ремиссии ОМЛ была продолжена ПХТ без редукции доз цитостатиков на фоне продолжающейся противогрибковой терапии — применение позаконазола.
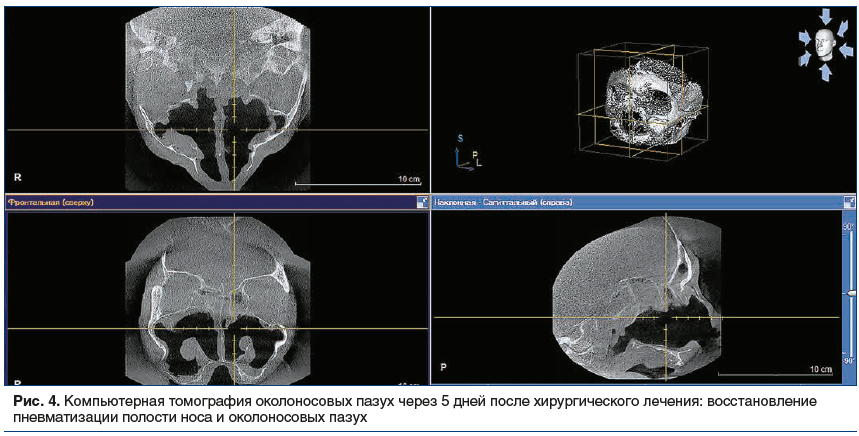
При контрольном осмотре через 1,5 мес. после операции в полости носа признаков воспалительных явлений не отмечается, слизистая умеренно бледная, неотечная. Отсутствуют средняя и нижняя носовые раковины (результат резекции), верхнечелюстная пазуха слева хорошо обозрима, в пазухе определяются рубцово-отечные изменения (рис. 3). Признаков грибкового поражения не обнаружено. В контрольных результатах микологического исследования грибка не обнаружено.
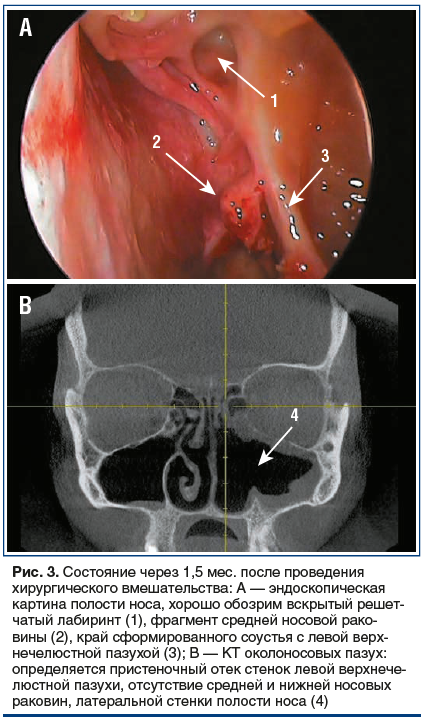
Пациентка завершила курс ПХТ, рецидива мукормикоза на фоне вторичной профилактики позаконазолом не наблюдалось. В международном регистре найден совместимый донор гемопоэтических стволовых клеток, и в последующем успешно проведена аллогенная ТГСК.
Обсуждение
Представленное клиническое наблюдение демонстрирует успешные диагностические и лечебные мероприятия в сложной клинической ситуации редкого жизнеугрожающего осложнения терапии гематологических опухолей и подчеркивает важность оперативного взаимодействия специалистов разных специальностей — мультидисциплинарного подхода.
Мукормикоз — быстропрогрессирующее жизнеугрожающее осложнение, без своевременного лечения летальность при котором в случае его риноцеребральной формы может составлять до 100%, при этом диагностика мукормикоза является сложной задачей [19]. Грибы Mucorales относятся к возбудителям, резистентным к большинству противогрибковых средств, а в обеспечении успешности лечения помимо ранней лекарственной терапии важную роль играют хирургическое лечение и ремиссия основного заболевания [5, 18, 20]. Ранняя диагностика и лечение мукормикоза у гематологических больных осложняются тяжелым общим состоянием пациента, что обусловлено выраженным интоксикационным синдромом, кроме того, мукормикоз обычно развивается в период цитостатической панцитопении, что связано с высоким риском кровотечения. Самая частая локализация мукормикоза у онкогематологических пациентов — легкие (более 70%), на втором месте — риноцеребральная область (10–20%). При подозрении на мукормикоз необходимо выполнение КТ легких и ОНП. Для диагностики мукормикоза легких используют фибробронхоскопию с исследованием жидкости бронхоальвеолярного лаважа, биопсию образования легких. В случае поражения ОНП необходима пункция верхнечелюстных пазух с последующим бактериологическим и микологическим исследованием отделяемого пазух, а при технической возможности — гистологического исследования биоптата [18]. Однако отсутствие роста гриба и необнаружение его при микроскопии в полученном материале (что наблюдалось у пациентки при первой пункции верхнечелюстной пазухи) не следует расценивать как отсутствие грибковой инфекции. Наш опыт показывает, что необходимо проведение агрессивной ранней диагностики и противогрибковой терапии, этого же требуют и современные рекомендации. Ранняя диагностика мукормикоза с поражением ОНП позволяет предотвратить стремительное распространение инфекции в головной мозг, органы зрения и смежные ткани, что в подавляющем большинстве случаев оканчивается летальным исходом даже на фоне комплексного лечения [10, 14, 19, 21]. Обязательное условие успешной терапии мукормикоза, в особенности риноцеребральной формы, — хирургическое лечение, а вопросы безопасности его проведения для онкогематологических пациентов являются наиболее актуальными [18]. Примененный эндоскопический подход обеспечивает малую травматичность, хорошую визуализацию внутренних структур полости носа, а также высокую безопасность и эффективность в условиях цитопении.
Заключение
В настоящее время происходит постоянное совершенствование оказания медицинской помощи пациентам с заболеваниями крови. Несмотря на современные достижения в онкогематологии, часть вопросов, касающихся профилактики и лечения инфекционных осложнений у этого контингента пациентов, лежит в сфере компетентности врачей смежных специальностей. В представленном клиническом случае своевременная диагностика и комплексное лечение мукормикоза полости носа и ОНП позволили провести не только раннюю противогрибковую терапию, но и хирургическое лечение. Это сделало возможным последующее выполнение пациентке аллогенной ТГСК, являющейся современным методом лечения ее основного заболевания. Рецидивов мукормикоза в посттрансплантационном периоде не наблюдалось. Накопление подобного опыта позволит в будущем его обобщить и выработать оптимальные алгоритмы профилактики и лечения подобных осложнений.
Cписок литературы Вы можете найти на сайте http://www.rmj.ru
.
материал rmj.ru
