Содержание статьи
Введение
Согласно данным ВОЗ с начала пандемии было зарегистрировано более 260 млн подтвержденных случаев COVID-19, в том числе более 5 млн случаев летального исхода [1]. SARS-CoV-2 со временем стал активно проявлять мутагенность, что породило множество его вариантов. Для определения приоритетности мониторинга и исследований новых вариантов SARS-CoV-2, а также объективной оценки возможных угроз, исходящих от каждого варианта вируса, ВОЗ предложила классифицировать их на 3 категории: варианты, вызывающие озабоченность (variant of concern, VOC), варианты, представляющие интерес (variant of interest, VOI), и варианты, находящиеся под наблюдением (variant under monitoring, VUM). Другая классификация включает штаммы: «альфа» (Alpha, B.1.1.7), «бета» (Beta, B.1.351), «гамма» (Gamma, P.1) и «дельта» (Delta, B.1.617.2) [2]. К сожалению, каждый последующий штамм SARS-CoV-2 оказывался более вирулентным, чем предыдущий, что привело к значительному росту случаев тяжелого течения болезни, требующих госпитализации, и большому количеству смертей во всех странах мира. В ноябре 2021 г. новый вариант под названием «омикрон» (Omicron, B.1.1.529) был официально определен ВОЗ как 5-й вариант, который вызвал глобальную обеспокоенность мирового сообщества из-за своей повышенной способности к заражению и быстроты распространения по сравнению с ранее циркулировавшими вариантами.
Особенности COVID-19, вызванного штаммом «омикрон»
Инкубационный период при заражении штаммом «омикрон» значительно короче, чем у предыдущих, и составляет в среднем от 2 до 5 дней. Несмотря на то, что механизм передачи этого штамма, как и предшествующих штаммов, в основном воздушно-капельный, его контагиозность более чем 7 раз выше по сравнению с циркулировавшим ранее штаммом «дельта». Таким образом, человек, заразившийся штаммом «омикрон», может быть заразным для окружающих уже в первые сутки после инфицирования.
Еще одной характерной особенностью нового штамма является увеличение частоты заболеваемости среди детей и подростков, причем в среднетяжелой и тяжелой форме. При наличии у детей сопутствующей патологии, такой как обменные нарушения, сердечно-сосудистые заболевания, аллергия, хронические болезни легких или бронхиальная астма, различные виды иммунодефицитов, заболевание протекает особенно тяжело, с развитием мультисистемного воспалительного синдрома [3].
У взрослых, в особенности привитых или переболевших ранее другими вариантами SARS-CoV-2, заболевание чаще всего протекает подобно сезонной респираторной инфекции (ОРВИ) — с незначительным повышением температуры, насморком, головной болью, общим недомоганием. Однако, несмотря на относительно легкую выраженность симптомов, штамм «омикрон» обладает такими же свойствами, как и его предшественники: влияет на сосуды, вызывает развитие ангиита, сосудистого спазма и тромбообразования. Проблема осложняется еще и тем, что не всегда удается диагностировать новый штамм при помощи стандартных ПЦР-тестов, так как мутации, произошедшие в вирусе, затронули ген спайк-белка (белка S), на который эти тесты и нацелены [4—6].
Также, по данным S.R. Kannan et al. [7], эти мутации развивались у штамма «омикрон» совместно с мутациями во всем вирусном геноме. Структурный анализ показал, что уникально расположенные мутации в штамме «омикрон» могут снижать связывание антител, присутствующих у человека после ранее перенесенной инфекции либо после вакцинации против вируса SARS-CoV-2. Таким образом, диагностика варианта «омикрон» ПЦР-тестами затруднена, и работа нейтрализующих антител может быть недостаточной для предотвращения заражения этим штаммом у переболевших ранее COVID-19 и вакцинированных.
Особенности ЛОР-симптоматики при COVID-19
Если ранее в исследованиях сообщалось о гипосмии, аносмии, гипогевзии и агевзии, которые достаточно часто встречались у пациентов с COVID-19 без каких-либо назальных симптомов, что обусловлено прямым вирусным повреждением хемосенсорной системы [7, 8], то при заражении штаммом «омикрон» гипосмия и гипогевзия носят обструктивный характер и связаны в большинстве случаев с выраженным отеком слизистой оболочки носа и околоносовых пазух (ОНП) и выработкой большого количества вязкого отделяемого. Так, M. Özçelik Korkmaz et al. [9] отметили, что наиболее частыми оториноларингологическими проявлениями у 116 пациентов с положительными результатами ПЦР-теста на COVID-19 были гипосмия/аносмия (37,9%) и гипогевзия/агевзия (41,37%), головная боль (37,1%), боль в горле (32,7%) и дисфагия (20,6%), несистемное головокружение (31,8%), шум в ушах (11,2%), системное головокружение (6,1%) и нарушение слуха (5,2%). Также установлена достоверная корреляция между назальными симптомами и нарушением обоняния у пациентов с аллергическим ринитом. Отмечено, что самыми длительными и медленно купирующимися симптомами были гипосмия/аносмия и гипогевзия/агевзия.
На момент написания статьи не было найдено публикаций, посвященных особенностям поражения ЛОР-органов у пациентов, перенесших COVID-19, вызванный штаммом «омикрон». Поскольку входными воротами вируса SARS-CoV-2 являются верхние дыхательные пути при инфицировании, на первый план выходит симптоматика поражения ЛОР-органов: ринорея, затруднение носового дыхания, першение и боль в горле. Наш клинический опыт показывает, что после COVID-19, вызванного штаммом «омикрон», в постковидном синдроме преобладает выраженное затрудненное отхождение отделяемого из носа и ОНП. Это служит причиной затяжного течения воспалительного процесса. В некоторых случаях обостряются хронические ЛОР-заболевания, такие как тонзиллит, синусит, отит, активизируется герпесвирусная инфекция.
Учитывая, что для COVID-19, вызванного штаммом «омикрон», характерно длительное угнетение мукоцилиарной функции слизистой носа, приоритетной задачей является лечение синдрома назальной обструкции и обеспечение оттока отделяемого из ОНП — для профилактики развития поствирусного и бактериального синусита, отита, обострения имеющихся у пациентов хронических заболеваний ЛОР-органов, а также для повышения качества жизни.
При вирусной инфекции, поражающей верхние дыхательные пути, нарушается одна из самых важных функций слизистой полости носа — транспортная. Мукоцилиарный транспорт входит в первую линию защиты слизистых носа и ОНП от патогенов и поддерживает гомеостаз не только верхних, но и Ц dижних дыхательных путей. Мукоцилиарная дисфункция, вызванная воздействием вирусов, приводит к десквамации реснитчатых клеток, нарушению целостности и полноценного функционирования реснитчатого эпителия, что неблагоприятно влияет на эвакуацию слизи из области соустий ОНП, снижает барьерную функцию и ослабляет иммунную а ктивность слизистых. Еще одним фактором, благоприятствующим развитию воспаления в ОНП и отиатрических осложнений, является гиперпродукция слизистого секрета бокаловидными клетками, количество которых значительно возрастает при вирусном поражении слизистой верхних дыхательных путей в ответ на нарушение цело¶ 1тности респираторного эпителия. Меняется и реология слизи, она становится более вязкой за счет образования в молекулах муцинов, содержащихся в гелевом слое слизи, новых дисульфидных связей. Совокупность патологических изменений дренажной функции приводит к значительному угнетению мукоцилиарного транспорта слизистой верхних дыхательных путей и лежит в основе развития острого риносинусита, тубоотита, катарального среднего отита [10].
Улучшение дренажной функции ОНП за счет изменения реологических свойств назального секрета ускоряет очищение пазух от патологического содержимого и, соответственно, выздоровление пациента, что показано в клиническом наблюдении.
Представляем собственное клиническое наблюдение пациента с синдромом назальной обструкции, перенесшего COVID-19.
Клиническое наблюдение
На лечении находился пациент М., 35 лет, который обратился с жалобами на затрудненное носовое дыхание, постоянные слизисто-гнойные выделения из носа, тяжесть во лбу, снижение обоняния, стекание вязкого отделяемого по задней стенке глотки, периодическую боль в горле. Данные проявления пациент отмечал в течение 3 нед. после перенесенного в январе 2022 г. COVID-19 (штамм «омикрон»), подтвержденного ПЦР-тестом. За 3 мес. до болезни был вакцинирован против COVID-19.
У пациента в анамнезе после перенесенной 10 лет назад травмы носа наблюдалось постоянное двустороннее затруднение носового дыхания. Около 3 лет назад после ОРВИ перенес гнойный верхнечелюстной синусит, после чего отметил периодическое стекание отделяемого в носоглотку. Также страдает сезонным аллергическим ринитом легкой степени тяжести с сенсибилизацией к пыльце березы и ольхи. Перенес в возрасте 10 лет инфекционный мононуклеоз. Родственники второй линии со стороны матери страдают атопическим дерматитом.
Заболевание COVID-19 протекало по типу ОРВИ и сопровождалось назальной обструкцией, обильными выделениями слизи из полости носа, болью в горле, субфебрильной температурой, головными болями и болями в мышцах. Данные симптомы на фоне применения симптоматической терапии были купированы в течение 7 дней, однако затруднение носового дыхания сохранилось, появились густые слизисто-гнойные выделения из носа, стекающие по задней стенке глотки. Возникло чувство тяжести в области лба в проекции верхнечелюстных пазух при наклоне вперед, усилились першение и боль в горе.
Пациент с вышеуказанными жалобами обратился к оториноларингологу. После осмотра и проведения рентгенографии придаточных пазух носа установлен диагноз «острый двусторонний экссудативный полисинусит». От предложенных пункций верхнечелюстных пазух пациент отказался. Проведен курс консервативного лечения, включающий ирригационную терапию (спрей, содержащий ксилометазолин, в нос 2 р/сут), антибиотикотерапию (амоксициллин/клавуланат 1000 мг 2 р/сут в течение 7 дней) — без эффекта. Из-за неэффективности проводимой терапии врачом-оториноларингологом было принято решение повторить курс антибиотикотерапии. Был назначен левофлоксацин в дозе 500 мг 2 р/сут в течение 10 дней, орошение препаратом, содержащим топический антибиотик, — с незначительной положительной динамикой.
Во время осмотра на приеме при пальпации и перкуссии в проекции ОНП отмечена болезненность, в полости носа визуализированы S-образное искривление носовой перегородки, отечность и застойная гиперемия слизистой оболочки носа и нижних носовых раковин, мутное слизистое отделяемое в области средних носовых ходов с двух сторон, стекание отделяемого в носоглотку, гиперемия задней стенки глотки, утолщение боковых валиков глотки (рис. 1–3).
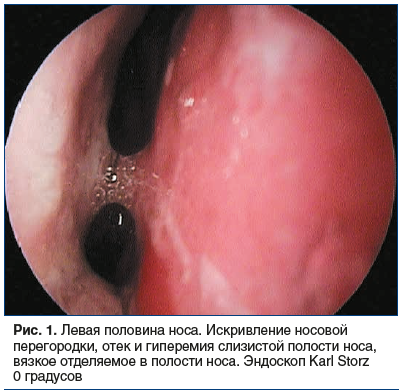
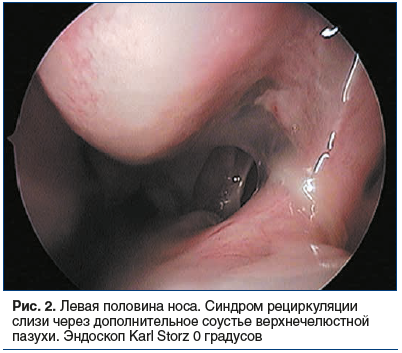
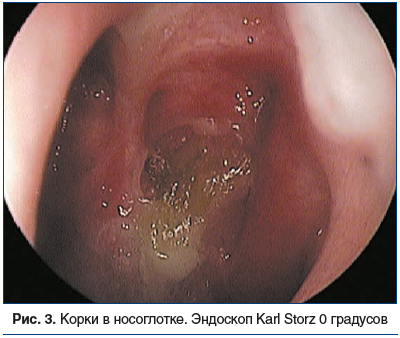
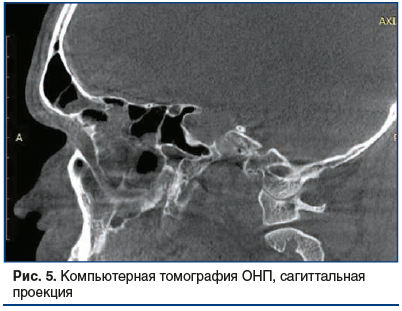
По результатам компьютерной томографии ОНП выявлены: гиперпластически измененная слизистая оболочка всех ОНП с отеком лобных и верхнечелюстных соустий, выраженное искривление носовой перегородки, увеличение нижних носовых раковин, дополнительные соустья верхнечелюстн fbх пазух (рис. 4, 5).
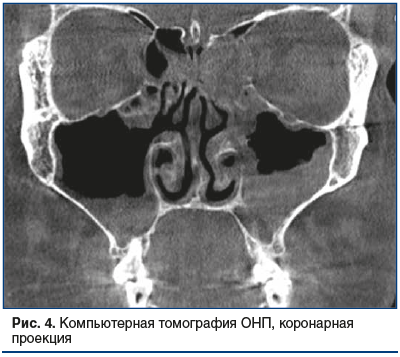
В мазках из полости носа с двух сторон и из ротоглотки получен золотистый стафилококк в 105 и в 104 копий соответственно. В ПЦР-тесте со слизистой ротоглотки обнаружен вирус Эпштейна — Барр 4,8×102 копий.
С учетом клиники заболевания, анамнеза, проведенного ранее лечения и данных компьютерной томографии пациенту установлен диагноз: «Двусторонний хронический гиперпластический полисинусит, искривление носовой перегородки, сезонный аллергический ринит легкой степени тяжести. Хроническая вирусная инфекция Эпштейна — Барр, обострение». Назначена ирригационная терапия, местная и системная муколитическая терапия сроком на 10 дней, топические стероиды на 1 мес., орошение ротоглотки антисептиками и бактерио-фагами, консультация аллерголога-иммунолога.
На фоне проводимой терапии пациент отметил положительную динамику уже на 3-й день после начала лечения: улучшение носового дыхания, уменьшение чувства тяжести в области ОНП и стекания отделяемого в глотку, боли и першения в горле, которые полностью купировались на 10-й день от начала лечения. Также после консультации иммунолога и дообследования пациент получил курс противовирусной терапии.
С учетом изменений архитектоники полости носа после перенесенной травмы пациенту рекомендовано в плановом порядке хирургическое лечение, а также динамическое наблюдение аллерголога-иммунолога.
Как в отечественных, так и в зарубежных рекомендациях по лечению различных форм синуситов особая роль отводится улучшению дренажной фунaции ОНП и восстановлению их физиологии [11–13]. В качестве топического муколитического средства данному пациенту был назначен Ринофлуимуцил®, содержащий действующие вещества ацетилцистеин и туаминогептан. Основным свойством ацетилцистеина является разжижающее воздействие и деполимеризация протеиновых комплексов и нуклеиновых кислот, ухудшающих реологические свойства мокроты. Кроме того, он обладает антиоксидантными свойствами и защищает слизистую оболочку дыхательных путей [14]. Туаминогептана сульфат оказывает местное сосудосуживающее действие и устраняет отек слизистой оболочки носа без явного системного действия и выраженного «синдрома рикошета». Ринофлуимуцил® в форме назального спрея применяется для лечения острого и подострого ринита с густым гнойно-слизистым секретом, хронического ринита, вазомоторного ринита, атрофического ринита и синусита. Взрослым рекомендуется по 2 впрыскивания аэрозоля в каждый носовой ход 3–4 р/сут, детям старше 6 лет — по 1 впрыскиванию в каждый носовой ход 3–4 р/сут. Длительность применения — не более 7 дней [15].
Заключение
Использование препарата Ринофлуимуцил® в комплексной терапии обострения хронического синусита после перенесенного COVID-19 у пациента с аллергическим ринитом и структурными изменениями полости носа способствовало улучшению мукоцилиарного транспорта, дренированию пазух и купированию в них воспалительного процесса. Хотим акцентировать внимание практикующих врачей на том, что как в о f2ечественных, так и в зарубежных рекомендациях по лечению различных форм синуситов особая роль отводится улучшению дренажной функции ОНП и восстановлению их физиологии. Применение топической муколитической терапии обеспечивает улучшение дренажа ОНП, эвакуацию патологического секрета и купирует воспалительный процесс.
RU-RIN-ENT-2200001
.
материал rmj.ru
