Введение
Актуальность артериальной гипертензии (АГ) обусловлена ее высокой распространенностью среди населения всего мира. В 2025 г. ожидалось увеличение числа пациентов с АГ до 1,5 млрд человек [1]. АГ является одним из главных факторов риска развития таких сердечно-сосудистых осложнений, как инфаркт миокарда, острое нарушение мозгового кровообращения, сердечная недостаточность, нарушения ритма сердца [2].
Течение и исход АГ во многом определяются поражением органов-мишеней и в первую очередь — структурно-функциональным ремоделированием сердца и сосудов [3]. Особую клиническую значимость приобретают вопросы дифференцированного подхода к терапии АГ с учетом индивидуальных патогенетических особенностей заболевания. Несмотря на значительные успехи в разработке новых классов антигипертензивных препаратов, остается нерешенным вопрос об оптимальном выборе терапии для коррекции ремоделирования сердца и сосудов [4, 5].
Цель исследования: комплексная оценка влияния антигипертензивных препаратов на динамику структурно-функционального ремоделирования сердца и сосудов у пациентов с АГ в зависимости от уровня ренина плазмы.
Содержание статьи
Материал и методы
Обследовано 120 пациентов (60 мужчин и 60 женщин от 25 до 76 лет, сопоставимых по возрасту) с диагностированной АГ I–II стадии, 1–3-й степени, ранее не получавших антигипертензивную терапию на постоянной основе. Пациентов с заболеваниями почек, хронической сердечной недостаточностью, бронхиальной астмой, хронической обструктивной болезнью легких в исследование не включали. Исследование было одобрено локальным этическим комитетом «Новгородского государственного университета имени Ярослава Мудрого» (протокол № 5 от 22 января 2024 г.). Информированное согласие было получено от всех участников, включенных в исследование.
Дуплексное исследование сонных артерий, эхокардиография и проба с реактивной гиперемией плечевой артерии были проведены на ультразвуковом сканере MINDRAY DC-70. Дуплексное исследование сонных артерий включало определение толщины комплекса интима-медиа (ТКИМ), обнаружение атеросклеротических бляшек. Критерием субклинического атеросклероза был принят диапазон ТКИМ от 1,0 до 1,5 мм. ТКИМ более 1,5 мм или локальное утолщение на 0,5 мм по сравнению с прилежащими участками сонной артерии являлась критерием атеросклеротической бляшки [6].
При эхокардиографии (ЭхоКГ) определяли индекс массы миокарда левого желудочка (ИММЛЖ) и относительную толщину стенки левого желудочка (ОТС). ИММЛЖ вычисляли по формуле Devereux, гипертрофию левого желудочка (ЛЖ) диагностировали при значении >115 г/м2 для мужчин и >95 г/м2 для женщин. ОТС рассчитывали по следующей формуле:
ОТС = (ТМЖП + ТЗСЛЖ) / КДР,
где ТМЖП — толщина межжелудочковой перегородки, ТЗСЛЖ — толщина задней стенки ЛЖ, КДР — конечно-диастолический размер.
Тип геометрии ЛЖ оценивали на основании ОТС и ИММЛЖ. Нормальной геометрии ЛЖ соответствовали значения ОТС ≤0,42 и нормальные показатели ИММЛЖ. Концентрическому ремоделированию ЛЖ (КРЛЖ) соответствовали значения ОТС >0,42 при нормальных показателях ИММЛЖ. Концентрической гипертрофии ЛЖ (КГЛЖ) соответствовали значения ОТС >0,42 при увеличении показателя ИММЛЖ. Эксцентрической гипертрофии ЛЖ (ЭГЛЖ) соответствовали значения ОТС ≤0,42 при увеличении показателя ИММЛЖ [7].
Проба с реактивной гиперемией плечевой артерии включала измерение исходного диаметра плечевой артерии в В-режиме, а также повторное измерение диаметра плечевой артерии после 4-минутной компрессии. Показатель эндотелий-зависимой вазодилатации (ЭЗВД) плечевой артерии рассчитывали по следующей формуле:
ЭЗВД = (Д2 — Д1) / Д1 × 100%,
где Д1 — исходный диаметр плечевой артерии, Д2 — диаметр плечевой артерии, измеренный после пробы с реактивной гиперемией.
Эндотелий-зависимую вазодилатацию считали нормальной при регистрации прироста диаметра плечевой артерии на 10% и более [8].
Содержание ренина в плазме крови определяли путем иммуноферментного анализа. Референтные значения были установлены в диапазоне 2,50–58,78 пг/мл [9]. На основании полученных результатов пациенты были распределены на 2 группы: с норморениновой АГ и гиперрениновой АГ. В группу с норморениновой АГ вошли 77 пациентов, группу с гиперрениновым типом АГ составили 43 пациента. По возрасту и полу различий между группами не было.
Тенденцией современной гипотензивной терапии является персонализированный подход [2]. На данный момент недостаточно изучены критерии оценки эффективности индивидуализированного подбора антигипертензивной терапии.
При выборе препаратов мы опирались на данные исследования, проведенного в МОНИКИ в 2010 г., в котором проводилось сравнение эффективности гипотензивной терапии у пациентов, распределенных по профилю активности ренин-ангиотензин-альдостероновой системы (РААС). В группе пациентов с низкорениновой и норморениновой АГ прием ингибитора ангиотензинпревращающего фермента (иАПФ) эналаприла вызвал переход к гиперрениновому типу АГ всех пациентов, а лозартан (сартан) недостаточно снижал артериальное давление (АД) у данной группы пациентов. Самым эффективным гипотензивным средством у пациентов с норморениновой АГ оказался блокатор кальциевых каналов (БКК) нифедипин [10]. В данном исследовании критериями эффективности служили нормализация АД и показателей ренина плазмы. Однако достижение целевого уровня АД не всегда предотвращает поражение органов-мишеней [11].
Исходя из этих данных, пациенты с высокорениновой АГ были поделены на 2 подгруппы: в первой подгруппе был назначен иАПФ периндоприл (4–8 мг), во второй подгруппе — блокатор рецепторов ангиотензина II (БРА) валсартан (80–160 мг). Пациентам с норморениновым типом АГ был назначен БКК лерканидипин (5–10 мг).
Через 6 мес. терапии было проведено повторное обследование с целью оценки динамики ремоделирования сердца и сосудов при условии достижения и стойкого удержания целевого уровня АД.
Для статистического анализа использовано программное обеспечение StatTech версии 4.8.0. При сравнении количественных показателей между группами применен парный t-критерий Стьюдента (для зависимых выборок). Уровень статистической значимости установлен при р<0,05. Для оценки различий в доле пациентов с улучшением ЭЗВД и уменьшением ТКИМ был использован точный критерий Фишера с применением поправки Бонферрони для коррекции уровня значимости при множественных сравнениях. Статистическую значимость различий определяли при р<0,05, после поправки Бонферрони уровень значимости был скорректирован до р<0,0167. Для оценки достоверности изменений качественных признаков, а именно частоты встречаемости различных типов геометрии ЛЖ до и после терапии, использовали критерий Макнемара, предназначенный для анализа парных (связанных) выборок. Критерий применяли для попарного сравнения долей каждого типа ремоделирования. За критический уровень статистической значимости принимали величину р<0,05 [12, 13].
Результаты и обсуждение
В целом у 71 (59%) обследованного пациента до лечения отсутствовали признаки ремоделирования сосудов. У 19 (16%) обследованных пациентов диагностировано увеличение ТКИМ. У 18 (15%) пациентов, страдающих АГ, были выявлены не стенозирующие просвет артерий атеросклеротические бляшки, признаки эндотелиальной дисфункции обнаружены у 38 (32%).
По результатам ЭхоКГ распределение по типам геометрии ЛЖ выглядело следующим образом: у 74 (62%) пациентов выявлена нормальная геометрия ЛЖ, у 26 (22%) — КРЛЖ, у 16 (13%) — КГЛЖ и только у 4 (3%) —ЭГЛЖ.
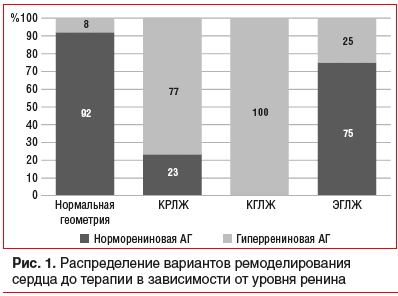
Проведенный анализ выявил наличие закономерности в структуре ремоделирования сердечно-сосудистой системы у пациентов с нормо- и гиперрениновой АГ (рис. 1). Гипертрофия миокарда ЛЖ была ассоциирована с гиперрениновым типом АГ: все (100%) случаи КГЛЖ и 77% случаев КРЛЖ были диагностированы в данной группе. Напротив, нормальная геометрия ЛЖ достоверно чаще встречалась среди пациентов с норморениновым типом АГ (92%). ЭГЛЖ также чаще (75%) диагностировали при норморениновом типе АГ.
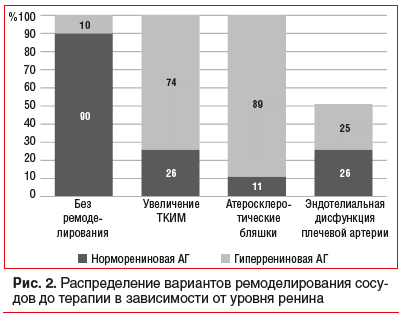
Аналогичная тенденция наблюдалась и в отношении сосудистого ремоделирования. Отсутствие признаков ремоделирования было характерно для пациентов с норморениновым типом АГ (90% случаев). В то же время увеличение ТКИМ сонных артерий и наличие атеросклеротических бляшек были значительно более распространены в группе с гиперрениновым типом АГ (в 74 и 89% случаев соответственно). Эндотелиальная дисфункция плечевой артерии также преобладала у пациентов с гиперрениновым типом АГ (рис. 2).
В течение 6 мес. всем пациентам проводилась персонализированная монотерапия одним из препаратов. При исходно повышенном уровне ренина плазмы назначались блокаторы РААС (валсартан или периндоприл), если уровень ренина был в пределах нормы, назначался БКК (лерканидипин).
Через 6 мес. антигипертензивной терапии пациентам с ремоделированием сердечно-сосудистой системы была проведена повторная оценка ТКИМ и ЭЗВД, ИММЛЖ и ОТС (см. таблицу).
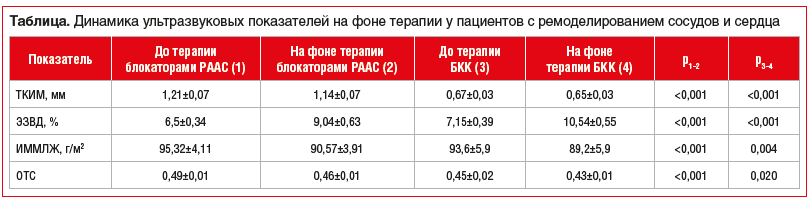
На фоне терапии БРА и БКК у всех пациентов отмечалось отсутствие прогрессирования атеросклероза сонных артерий, но без регресса имеющихся атеросклеротических бляшек. Уменьшение ТКИМ на фоне терапии валсартаном, периндоприлом и лерканидипином отмечалось у 71, 77 и 23% пациентов соответственно. Попарные сравнения с поправкой Бонферрони показали более высокую эффективность валсартана (р=0,0008) и периндоприла (р=0,0005) по сравнению с лерканидипином. Достоверных различий между группами валсартана и периндоприла выявлено не было (р=1,000).
На фоне терапии валсартаном ЭЗВД улучшилась у 76% пациентов, периндоприлом — у 73% и лерканидипином — у 92% (различия между БКК и БРА статистически значимы, р<0,05).
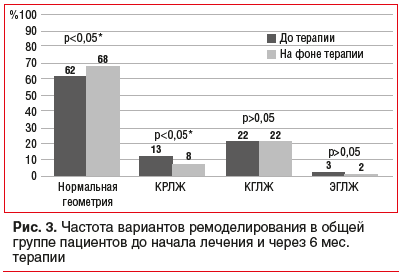
Анализ динамики ремоделирования сердца на фоне антигипертензивной терапии показал, что спустя 6 мес. терапии распределение типов геометрии ЛЖ у больных в общей группе пациентов с АГ изменилось следующим образом (рис. 3): увеличилась доля нормальной геометрии ЛЖ до 68% (р<0,05) и до 8% уменьшилась доля пациентов с КГЛЖ (р<0,05), частота концентрического ремоделирования и эксцентрической гипертрофии практически не изменилась.
У пациентов с высокорениновым типом АГ, находящихся на терапии валсартаном, при наличии исходной КГЛЖ в 50% случаев наблюдался переход в КРЛЖ, в 50% случаев тип геометрии ЛЖ остался прежним, а у пациентов с КРЛЖ в 40% случаев наблюдался переход в нормальную геометрию ЛЖ, в 60% случаев тип геометрии ЛЖ остался прежним.
В группе пациентов с высокорениновым типом АГ, находящихся на терапии периндоприлом, при наличии КГЛЖ у 38% пациентов наблюдался переход в КРЛЖ, а в 62% случаев сохранялась КГЛЖ. У пациентов с исходной КРЛЖ переход в нормальную геометрию ЛЖ отмечен у 10% пациентов, а у 90% тип геометрии не изменился.
В группе пациентов с норморениновым типом АГ, находящихся на терапии лерканидипином, при исходном КРЛЖ у 17% пациентов наблюдался переход в нормальную геометрию ЛЖ, у 83% пациентов сохранялось КРЛЖ.
У 37 пациентов с гиперрениновой АГ была проведена повторная оценка уровня ренина венозной крови на фоне приема ингибиторов РААС периндоприла и валсартана. У пациентов, принимавших валсартан, в 100% случаев достигнуты нормальные значения ренина, а на фоне терапии периндоприлом такой результат получен в 94% случаев.
Результаты исследования показали, что ультразвуковое исследование сосудов и сердца остается наиболее достоверным и общедоступным диагностическим методом, позволяющим оценить прогрессирование или регресс ремоделирования сердечно-сосудистой системы у больных АГ. С помощью ультразвукового дуплексного исследования сонных артерий и пробы с реактивной гиперемией плечевой артерии была показана эффективность персонализированного подхода к лечению АГ в виде снижения ТКИМ и повышения процента ЭЗВД. Использование фокусированной ЭхоКГ позволило выявить положительную динамику в виде тенденции к уменьшению ремоделирования ЛЖ, а именно уменьшения показателей ОТС и ИММЛЖ.
Выводы
-
Гиперрениновый тип АГ достоверно ассоциирован с более неблагоприятными структурными изменениями: КГЛЖ, увеличением ТКИМ и наличием атеросклеротических бляшек. Напротив, норморениновый тип чаще характеризуется нормальной геометрией ЛЖ и отсутствием признаков сосудистого ремоделирования.
-
Персонализированная антигипертензивная терапия, основанная на учете исходного уровня ренина, продемонстрировала высокую эффективность в регрессе структурных изменений органов-мишеней.
-
Блокаторы РААС (валсартан и периндоприл) показали значимое превосходство в способности уменьшать ТКИМ по сравнению с БКК лерканидипином (71% и 77% против 23% случаев улучшения соответственно, p<0,0167).
-
Терапия валсартаном способствовала более выраженному положительному ремоделированию ЛЖ: у большего числа пациентов с КГЛЖ отмечался переход к КРЛЖ (50% против 38% на периндоприле), а с КРЛЖ — к нормальной геометрии (40% против 10% на периндоприле).
-
Подтверждена целесообразность контроля уровня ренина для оценки адекватности блокаторов РААС: терапия валсартаном привела к нормализации уровня ренина у 100% пациентов, в то время как на фоне приема периндоприла целевых значений достигли 94% пациентов, что может частично объяснять менее выраженный регресс гипертрофии ЛЖ в этой группе.
Информация с rmj.ru