Введение
В настоящее время разработаны перспективные кератостабилизирующие операции, в частности интрастромальная имплантация полуколец из полиметилметакрилата в предварительно сформированный круговой тоннель с внутренним диаметром 5,0 мм [1–4]. С.Б. Измайловой [5] предложен алгоритм выбора тактики хирургического лечения прогрессирующих кератэктазий, согласно которому интраламеллярную кератопластику с имплантацией роговичных сегментов следует проводить для стабилизации начальных и развитых стадий эктатического процесса и одновременного повышения зрительных функций. На сегодняшний день роговичные туннели для имплантации интракорнеальных полуколец создаются как механическим способом, так и с использованием фемтосекундных технологий [6, 7]. Имплантация интрастромальных сегментов (ИСС) не способна восстановить полностью биомеханическую и структурную целостность роговицы при кератоконусе [8], но при правильном расположении ИСС возможно уменьшение иррегулярности роговицы, что позволяет существенно улучшить некорригированную остроту зрения (НКОЗ), максимально корригированную остроту зрения (МКОЗ), уменьшить сфероэквивалент рефракции, а также снизить уровень аберраций высокого порядка [9, 10].
Несмотря на существование практических рекомендаций и номограмм производителей [11–13] для выбора ИСС в зависимости от сочетания оптических, рефракционных, кератотопографических параметров роговицы пациента, в ряде случаев имплантация ИСС не дает рефракционного эффекта и даже может сопровождаться ухудшением зрения пациента после операции, а также осложнениями в виде миграции, экструзии и протрузии сегментов, отека ткани, кератита и т. д. [14]. Во многом это связано с принципиальной невозможностью учета индивидуальных особенностей геометрии, строения и свойств роговицы пациента в рамках некоторого универсального подхода.
Описание при помощи компьютерных моделей изменений в топографии, динамике и биомеханике кератоконической роговицы для различных вариантов имплантации ИСС (с точки зрения их конструкции, геометрии, позиционирования и процедуры внедрения) существенно расширяет возможности оптимизации оптических, рефракционных параметров роговицы и ее механобиологического состояния после лечения [15–20]. Кроме этого, цифровое планирование операции на геометрически и биомеханически персонифицированной для данного пациента численной модели роговицы позволяет повысить безопасность и эффективность хирургической операции [21–24].
В этой связи следует ожидать в ближайшее время роста количества исследований, посвященных разработке и использованию математических моделей для описания процессов имплантации ИСС. Однако сегодня количество публикаций по данной тематике еще сравнительно невелико (среди общего числа публикаций по моделям роговицы при различных воздействиях) как в отечественных, так и в зарубежных изданиях [25–28].
Нерешенной на сегодняшний день остается задача точного переноса рекомендуемого положения роговичного сегмента, которое определили и выбрали с помощью цифрового планирования, на роговицу пациента. Известные способы маркировки роговичных ориентиров выполняются мануально в положении сидя, что влияет на точность топографической разметки [29, 30]. Использование цифровой разметочной системы более эффективно [31], но ограничено отсутствием подобного диагностического оборудования в ряде медицинских организаций, а также сохранением необходимости мануальной разметки на этапе операции.
Вышеизложенное придает особую актуальность пациентоориентированным методикам лечения заболеваний, основывающимся на совместном использовании данных инструментального обследования пациента и персонализированных компьютерных (конечно-элементных) моделей роговицы, построенных на их основе [15, 16].
Цель исследования: анализ результатов применения персонализированного подхода к имплантации ИСС, основанного на оптимизации выбора их размеров и положения, а также прогнозирование результатов хирургического лечения прогрессирующего кератоконуса с помощью математической модели роговицы конкретного пациента.
Содержание статьи
Материал и методы
На всех этапах исследования соблюдались принципы, изложенные в Хельсинкской декларации, от всех участников было получено информированное письменное согласие. Протокол исследования получил одобрение комитета по медицинской этике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России 22 сентября 2023 г.
Исследование включало следующие этапы:
Математическое моделирование механического поведения роговицы под действием внутриглазного давления (ВГД) и воздушного импульса как в норме, так и при кератоконусе, в том числе при его различных кератотопографических паттернах, выполненное на основании данных обследования с помощью Pentacam AXL и Corvis ST 174 глаз 174 здоровых лиц с нормальной роговицей с различной рефракцией и 92 глаз 92 пациентов с I–III стадиями кератоконуса (по классификации Amsler — Krumeich). Более подробно характеристика указанных групп представлена в таблице 1.
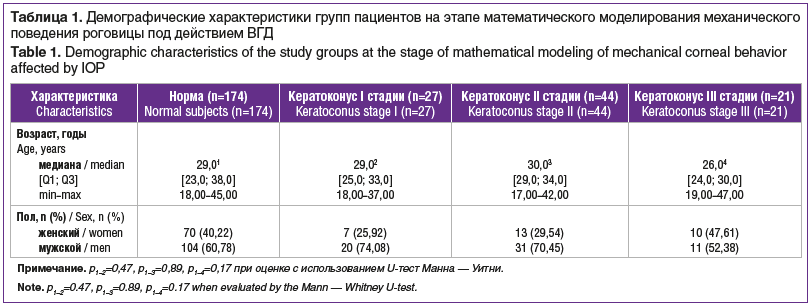
Моделирование вариантов операции и их результатов на «цифровом двойнике роговицы».
Разработка методики персонализированной роговичной разметки для определения положения ИСС.
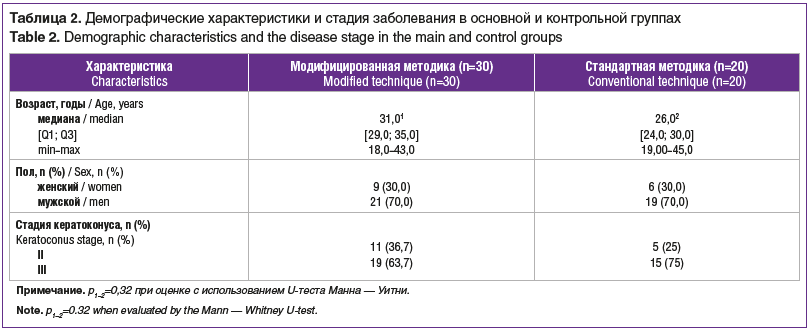
Проспективный сравнительный анализ результатов разработанных вариантов лечения 30 пациентов (30 глаз, основная группа) и результатов стандартной методики имплантации ИСС по номограмме Keraring 20 пациентов (20 глаз, контрольная группа) с прогрессирующим кератоконусом II и III стадии (по классификации Amsler — Krumeich) в клинике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России.
Возрастной и гендерный состав исследуемых групп представлен в таблице 2. Сроки наблюдения: до операции, 1-е сутки, 1 мес., 6 мес. и 1 год после операции.
Для оценки результатов до и после операции на сроках наблюдения всем пациентам проводили расширенное офтальмологическое обследование, включающее, кроме стандартных методов исследования, оптическую когерентную томографию (ОКТ) роговицы на когерентном томографе Solix (Optovue, США), регистрацию гистоморфологических изменений роговицы и определение плотности эндотелиальных клеток (ПЭК) с помощью конфокальной микроскопии (Confoscan 4, Nidek, Япония). С помощью Pentacam AXL и Corvis ST (OCULUS Optikgeräte GmbH, Германия) оценивали максимальное значение кератометрии (Кmax) и показатель жесткости роговицы (Stiffness Parameter (SP-A1)).
На 1-м и 2-м этапах исследования для каждого пациента с использованием системы компьютерного моделирования Comsol Multiphysics была построена и изучена геометрически и биомеханически персонализированная конечно-элементная модель роговицы, описывающая изменения ее топографии, биомеханических свойств, напряженно-деформированного состояния при внешних воздействиях в ходе диагностики и хирургического лечения [14, 15].
На основе интерполяции экспортированных данных Pentacam AXL обследования конкретного пациента воспроизводилась трехмерная геометрия передней и задней поверхностей роговицы с формированием твердотельной и конечно-элементной модели.
Полученная 3D-модель далее использовалась для расчетной идентификации биомеханических характеристик материала роговицы с поиском закона их распределения в интактной части и в зонах эктазии. В качестве искомых рассматриваются коэффициенты жесткости с1, с2, с3 гиперупругого материала, а также значения максимального относительного снижения жесткости ψimax в зоне кератоконуса и радиуса Ri этой зоны. Эти коэффициенты являются параметрами модели Yeoh, описывающей гиперупругое поведение материала роговицы, в форме соотношения для плотности энергии деформации Wiso и первого инварианта I–1 правого тензора деформаций Коши — Грина [14]:
Wiso = (1 — ψimax) × [с1(I–1 — 3) + с2(I–1 — 3)2 + с3(I–1 — 3)3].
Для отыскания указанных коэффициентов применялась процедура минимизации отклонения расчетных профилей роговицы от измеренных при помощи Pentacam AXL величин кривизны передней и задней поверхностей (более чем в 8000 точках на каждой из них), а также амплитуды деформации роговицы (для 140 моментов времени действия воздушного импульса), полученных на пневмотонометре Corvis ST на этапе приборной диагностики данного пациента.
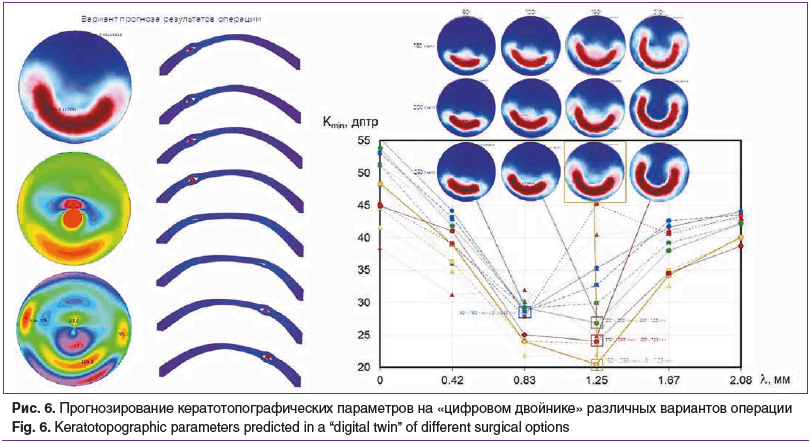
Модель, настроенная таким образом по персональным данным пациента, приобрела функции «цифрового двойника» и применялась для предоперационного планирования операций с количественной оценкой вариантов лечения и составлением для каждого из них послеоперационного прогноза в ближайшей перспективе. В частности, проведена серия вычислительных экспериментов, в ходе которых оценивались топографические и деформационные характеристики роговицы после «виртуальной» имплантации роговичного сегмента различной толщины — от 150 до 250 мкм с шагом 50 мкм, различной длины — 90°, 120°, 160° и 210°, в различные положения — со смещением роговичного тоннеля парацентрально по направлению к Kmax, точке с наибольшей элевацией, точке с наименьшей пахиметрией на различные расстояния — с целью прогноза послеоперационной кератотопографии и выбора наилучшего варианта.
На основании расчетного этапа работы определяли наилучший вариант ИСС по длине дуги, толщине и его положение, обеспечивающие наибольшее снижение значения Kmax, в каждом случае. Для точного позиционирования роговичного тоннеля в необходимом положении предложен автоматизированный способ разметки на роговице, позволяющий с учетом кератотопографии и циклоторсии отмечать целевой ориентир с помощью эксимерного лазера.
Получаемый при использовании предлагаемого способа технический результат состоит в точном интраоперационном установлении центра роговицы, а также любого необходимого целевого ориентира на роговице с учетом циклоторсии, что обеспечивает правильное положение в роговице роговичных тоннелей и точное желаемое позиционирование в них роговичных сегментов. Достигается результат тем, что кератотопографические данные пациента, полученные при обследовании с помощью Шаймпфлюг-анализатора Sirius (SCHWIND, Германия), передаются в эксимерный лазер SCHWIND Amaris-1050, на роговицу пациента с его помощью наносятся точные эпителиальные метки путем проведения точечной процедуры фототерапевтической кератэктомии (ФТК), относительно которых позиционируется роговичный тоннель и ИСС в этом тоннеле.
В контрольной группе планирование имплантации ИСС осуществлялось с помощью номограммы Keraring — по данным манифестной рефракции с учетом положения сильной оси роговичного астигматизма.
Эффективность изучаемых методик оценивали по улучшению функциональных показателей — повышению НКОЗ и МКОЗ, уменьшению значения Kmax. Также оценивалось влияние имплантации ИСС на биомеханические свойства роговицы по изменению значения показателя жесткости роговицы SP-A1. Безопасность оценивалась по частоте возникновения различных осложнений как в раннем, так и в отдаленном послеоперационном периоде.
Статистический анализ был выполнен с использованием программного обеспечения SPSS Statistics for Windows (версия 22.0, IBM Corp.). По тестам Колмогорова — Смирнова и Шапиро — Уилка распределение данных соответствовало ненормальному распределению, поэтому полученные результаты были представлены в виде медианы (Ме), квартилей [Q1; Q3], а также минимального и максимального значений. Для сравнения медианных значений в двух группах применяли U-критерий Манна — Уитни. Для определения различий между полученными результатами в различные сроки наблюдения относительно исходных значений в каждой группе применяли Т-критерий Уилкоксона. При его критической величине выше эмпирической и показателе значимости различий p<0,05 различие расценивали как статистически значимое.
Результаты исследования
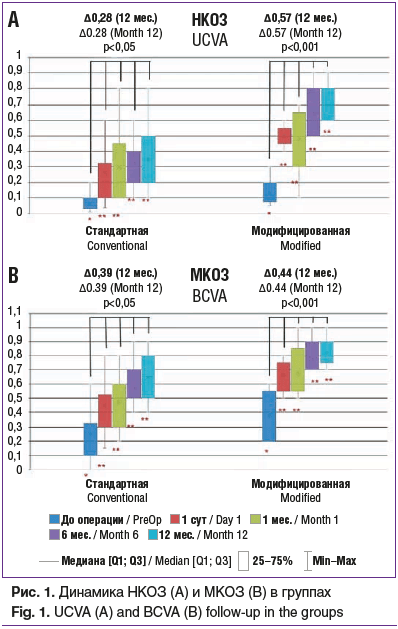
Динамика остроты зрения в основной и контрольной группах была сходной. Статистически значимое повышение НКОЗ и МКОЗ в основной группе (p<0,001) и в контрольной группе (p<0,05) отмечалось на всех сроках наблюдения. В основной группе прибавка НКОЗ и МКОЗ на сроке наблюдения 12 мес. составила 0,57 и 0,44, в контрольной группе — 0,28 и 0,39 соответственно (рис. 1).
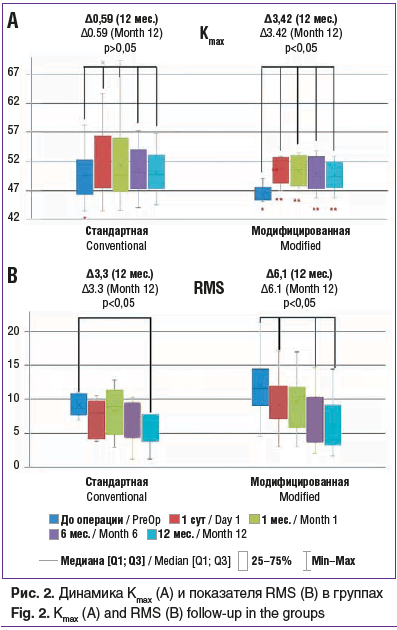
Улучшение остроты зрения на всех сроках наблюдения было обусловлено статистически значимым уменьшением значения Kmax и повышением регулярности поверхности роговицы в оптической зоне (p<0,05) в обеих группах, что выразилось в уменьшении среднего квадратичного значения ошибок волнового фронта (RMS — root mean square). В основной группе снижение среднего значения Kmax на сроке наблюдения 12 мес. составило 3,42 дптр, в контрольной группе — 0,59 дптр, как и уменьшение среднего значения RMS на сроке наблюдения 12 мес. — 6,1 и 3,3 мкм в основной и контрольной группах соответственно (рис. 2).
Показатель жесткости SP-A1 и биомеханически компенсированное ВГД существенно не изменялись в течение периода наблюдения в обеих группах (рис. 3).
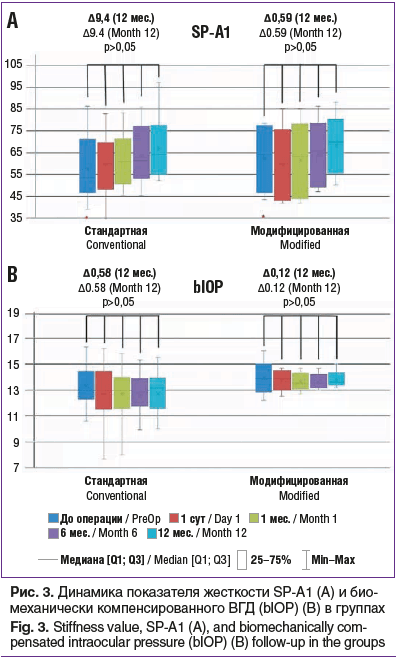
Установили, что ПЭК оставалась неизменной в обеих группах на всех сроках наблюдения. Интра- и послеоперационных осложнений ни в одном случае отмечено не было.
Клиническое наблюдение
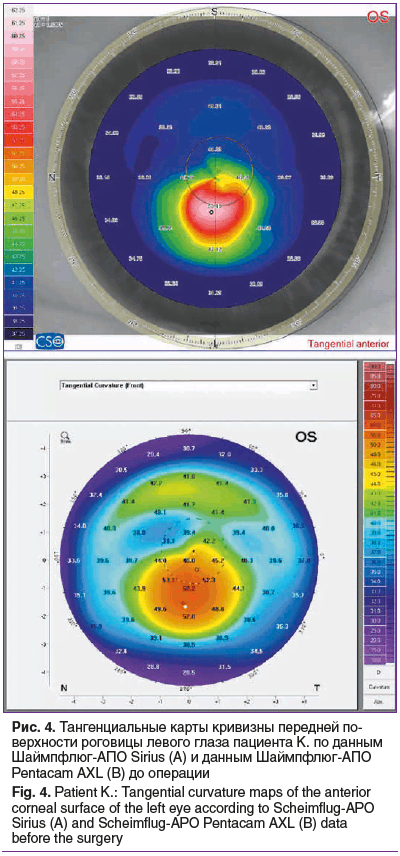
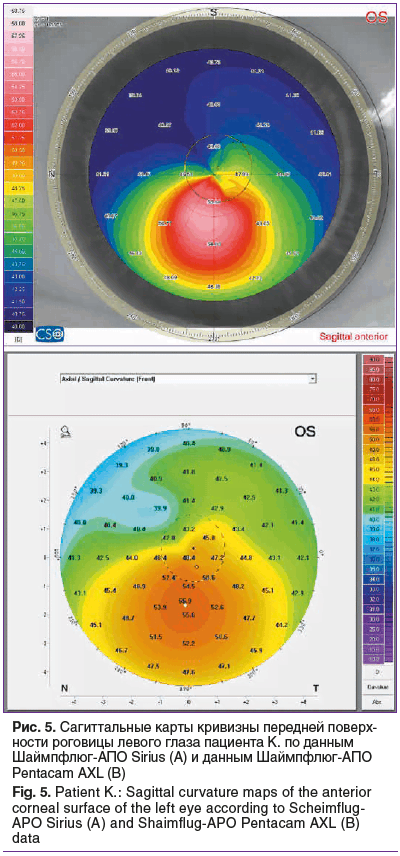
Пациент К., 32 года, обратился в офтальмологическое отделение коррекции аномалий рефракции Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России с жалобами на прогрессивное снижение остроты зрения вдаль на обоих глазах в течение последних 5 лет. Оптические средства коррекции не использует. Пациент был включен в основную группу исследования, от него было получено информированное письменное согласие на участие в исследовании и на публикацию полученных результатов. Было проведено полное офтальмологическое обследование, получены следующие клинико-функциональные результаты: НКОЗ OD=0,2, МКОЗ OD=0,6, рефракция OD: sph -2,00 дптр, cyl -2,00 дптр, ax 65°; НКОЗ OS=0,01, МКОЗ OS=0,5, рефракция OS: sph -1,50 дптр, cyl -3,75 дптр, ax 120°, величина ПЗО OD=24,49 мм, ПЗО OS=24,53 мм, пахиметрия в центральной оптической зоне OD=521 мкм, минимальное значение пахиметрии OD=495 мкм, пахиметрия в центральной оптической зоне OS=505 мкм, минимальное значение пахиметрии OS=482 мкм. ПЭК OD=2902 СD/мм2, ПЭК OS=2550 СD/мм2. Кератотопографически на OD — паттерн асимметричного галстука-бабочки со смещением широкой части к нижненаружному отделу, на OS — паттерн кератоконуса в нижнем отделе (рис. 4, 5). Кератометрия на вершине кератоконуса OD по данным Шаймпфлюг-АПО Sirius — 53,25 дптр, OS — 60,17 дптр.
По данным пневмотонометрии (Corvis ST): показатели жесткости роговицы OS — SP-A1 и SSI составляли 71,7 и 0,84 соответственно, значения корнеального гистерезиса СН и фактора резистентности роговицы СRF — 8,7 и 8,3 соответственно. Толщина эпителия на вершине кератоконуса 47 мкм. Поставлен клинический диагноз: кератоконус OS II стадии, рефракционная амблиопия слабой степени.
На OS апекс роговицы смещен на 0,04 мм и на 45° от центра зрачка, точка максимальной кератометрии Kmax смещена на 1,2 мм на 255°, положение сильной оси роговичного астигматизма соответствует 60°, ось комы — 83°.
При проведении ОКТ роговицы OS с помощью ОКТ Solix (Optovue, США) в режиме Corneal Map определено минимальное значение пахиметрии OS — 489 мкм, минимальное значение толщины эпителия роговицы OS — 50 мкм.
По результатам обследования установлен клинический диагноз: кератоконус правого глаза II стадии, кератоконус левого глаза (OS) III стадии. Пациенту было запланировано хирургическое лечение кератоконуса левого глаза —интраламеллярная кератопластика с фемтосекундным лазерным сопровождением с имплантацией ИСС.
На основании расчетного этапа работы были выбраны наилучший вариант ИСС — с длиной дуги 160° и толщиной 200 мкм, а также оптимальное положение тоннеля — со смещением его относительно центра зрачка на 1,25 мм, с центром ИСС на 263° и положением роговичного разреза 5° (рис. 6).
Для проведения операции использовали результаты расчетно-экспериментального этапа.
В условиях стерильной операционной под двукратной инстилляционной анестезией 0,5% раствора проксиметакаина гидрохлорида наложен на веки блефаростат, на эксимерлазерной установке Amaris-1050 (SCHWIND, Германия) выполнена персонализированная программированная ФТК эпителиального слоя роговицы на глубину эпителиального слоя 15 мкм в виде двух округлых зон диаметром 0,5 мм парацентрально на расстоянии 7,5 мм друг от друга, с центром, смещенным на 1,22 мм и на 261° от центра зрачка (рис. 7).
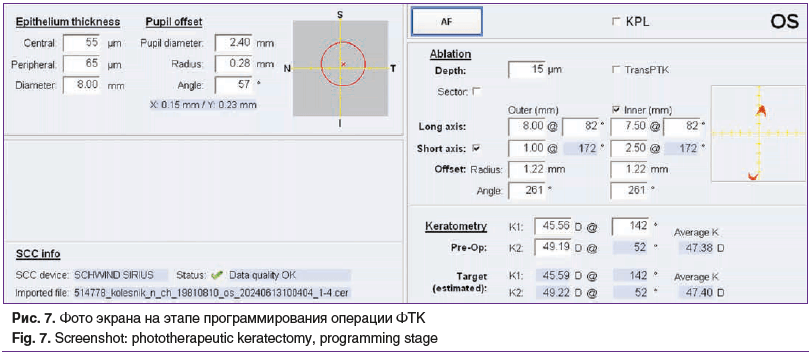
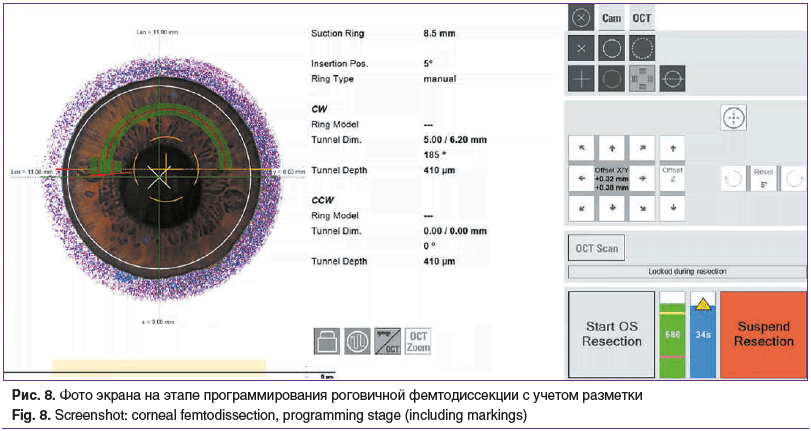
Полученные деэпителизированные зоны окрасили операционным маркером. Они являлись ограничивающими ориентирами для позиционирования роговичного тоннеля, нижняя метка соответствовала середине имплантируемого ИСС. Установили на роговицу концентрически лимбу стерильный интерфейс на рукоятке фемтосекундного лазера. На глубине 410 мкм сформирован роговичный тоннель в виде сегмента длиной 185° с внутренним диаметром 5,0 мм, наружным диаметром 6,2 мм, направлением разреза 5° в соответствии с разметкой с учетом циклоторсии (рис. 8).
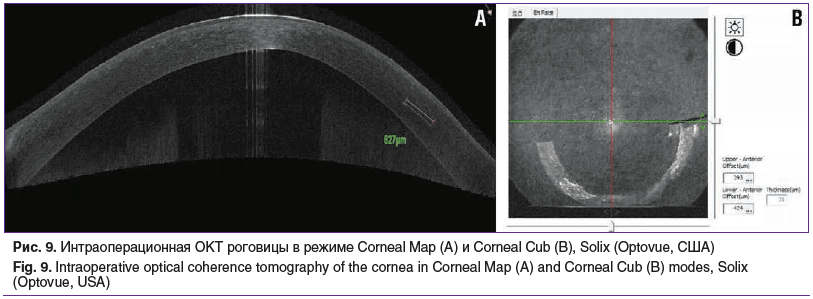
После выполнения этапа фемтодиссекции проведено контрольное исследование роговицы методом ОКТ с целью визуализации и фотофиксации размеров роговичного тоннеля до имплантации ИСС (рис. 9).
В сформированный роговичный тоннель имплантирован ИСС с длиной дуги 160° и толщиной 200 мкм. Однократно инстиллирован раствор антибиотика (0,5% раствор левофлоксацина), удален блефаростат.
Сразу после операции проведена ОКТ роговицы с целью раннего контроля положения ИСС в роговичном тоннеле.
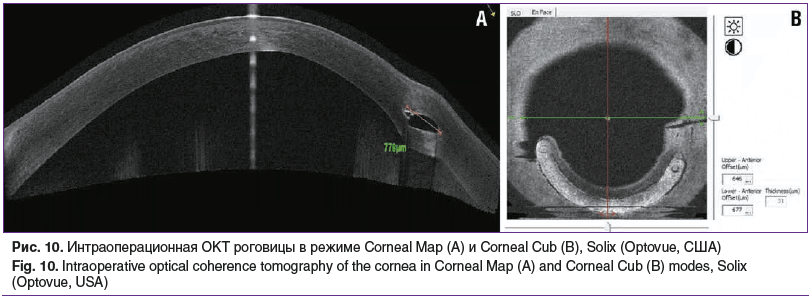
На рисунке 10 в режиме Corneal Map визуализируется расположение сегмента в роговичном тоннеле в соответствии с планируемым. В раннем послеоперационном периоде назначена антибактериальная, противовоспалительная и кератопротективная инстилляционная терапия.
На следующие сутки после операции: НКОЗ OS=0,1, рефракция левого глаза: sph -1,50 дптр, cyl 2,75 дптр, ax 180°, МКОЗ OS=0,7; ПЭК OS 2510 СD/мм2. Объективно: положение ИСС соответствует запланированному, роговичный разрез адаптирован.
Проведено инструментальное обследование, включающее кератотопографическое исследование с помощью Шаймпфлюг-анализаторов переднего отрезка глазного яблока Sirius (SCHWIND, Германия) и Pentacam AXL (OCULUS Optikgeräte GmbH, Германия), биомеханических свойств роговицы — с помощью пневмотонометра Corvis ST (OCULUS Optikgeräte GmbH, Германия), ОКТ роговицы с помощью томографа Solix (Optovue, США).
При сопоставлении прогностической расчетной кератотопограммы и кератотопограммы, полученной на 1-е сутки после операции, отмечается совпадение данных (рис. 11).
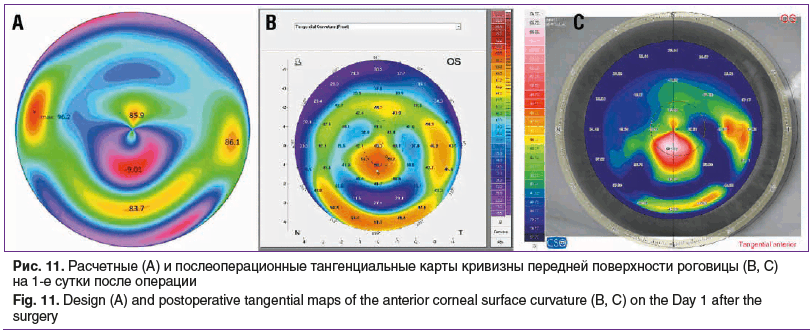
Обсуждение
На сегодняшний день ведется активный научный поиск в отношении оптимизации интраламеллярной кератопластики с имплантацией ИСС с целью обеспечения наилучшего функционального результата для пациента как за счет разработки новых моделей роговичных имплантов [32], так и за счет попыток рассчитать и спрогнозировать поведение роговицы после имплантации ИСС [13, 14, 18–20]. В данной работе показаны возможности планирования результата интраламеллярной кератопластики с имплантацией ИСС с помощью «цифрового двойника» роговицы, индивидуального для каждого конкретного пациента. С помощью виртуальной модели отрабатываются варианты имплантации различных по размеру ИСС, анализируется влияние положения сегмента на кератотопограмму в послеоперационном периоде. Наиболее сложной для реализации является задача переноса на роговицу разработанного плана операции. Этап аппланации при формировании роговичного тоннеля с использованием фемтоассистенции и изменение положения тела пациента меняют конфигурацию роговицы и смещают топографические роговичные ориентиры, относительно которых необходимо сформировать роговичный тоннель и расположить в нем интрастромальные импланты. Такими ориентирами являются центр роговицы, апекс роговицы, положение сильной оси астигматизма, положение оси АПВ coma. Требуется нанесение точных топографических ориентиров на роговицу до этапа докинга и ее аппланации. Известен способ нанесения разметки в вертикальном положении тела пациента за щелевой лампой только горизонтального меридиана с использованием роговичного метчика и красителя [29], способ нанесения разметки в вертикальном положении тела пациента за щелевой лампой сильной и слабой осей роговицы с использованием роговичного метчика и красителя, ориентируясь на разметку кератотопограммы и проведение компенсации циклоторсии до начала докинга [30]. Основным недостатком указанных способов является недостаточная точность разметки при мануальном выполнении манипуляции. Авторами предложена оригинальная автоматизированная методика разметки на роговице, позволяющая с учетом кератотопографии и циклоторсии отмечать целевой ориентир с помощью эксимерного лазера при любых кераторефракционных вмешательствах.
При стандартной методике выбора параметров роговичных сегментов по разработанной номограмме [11–13] принимаются во внимание величина сферического и циллиндрического компонентов рефракции, а также паттерн кератоконуса, но не учитываются индивидуальные деформационные характерстики роговицы. Приведенный клинический пример наглядно показывает возможности «цифрового двойника» роговицы по прогнозированию деформации роговицы после имплантации различных сегментов с выбором оптимального варианта. Сравнение клинико-функциональных результатов в группах демонстрирует явную эффективность модифицированной методики имплантации ИСС перед стандартной, подтвержденную более достоверным и выраженным повышением НКОЗ, МКОЗ, снижением значений Kmax и RMS. Полученные нами результаты подтверждают отсутствие влияния имплантируемых в роговицу конструкций на ее биомеханические свойства, что согласуется с данными литературы [8], а также подтверждают влияние ИСС, в первую очередь на визуальные функции, за счет изменения геометрии передней поверхности роговицы.
Выводы
Цифровое планирование операции на геометрически и биомеханически персонифицированной для данного пациента численной модели роговицы позволяет повысить безопасность и эффективность хирургической операции, что подтверждается полученными кератотопографическими результатами, которые соответствуют расчетным, отмечается повышение как НКОЗ, так и МКОЗ на всех сроках наблюдения. При этом выявлено, что за счет изменения размеров и положения роговичного сегмента можно гибко управлять топографическими и томографическими характеристиками роговицы, обеспечивая их наилучшее соответствие целевым показателям после операции.
Предложенная методика автоматизированной разметки любых необходимых топографических ориентиров на роговице позволяет реализовать персонализированный подход к выполнению интраламеллярной кератопластики с имплантацией ИСС.
Сведения об авторах:
Солодкова Елена Геннадиевна — к.м.н., заместитель директора по научной работе Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 80; ORCID iD 0000-0002-7786-5665
Измайлова Светлана Борисовна — д.м.н., заведующая отделом трансплантационной и оптико-реконструктивной хирургии переднего отрезка глазного яблока ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0002-3516-1774
Захаров Игорь Николаевич — д.т.н., заведующий кафедрой сопротивления материалов ВолгГТУ; 400005, Россия, г. Волгоград, пр-т им. В.И. Ленина, д. 28; ORCID iD 0000-0001-7177-7245
Фокин Виктор Петрович — д.м.н., профессор, главный специалист организационно-методического отдела Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 80; ORCID iD 0000-0002-2513-9709
Балалин Сергей Викторович — д.м.н., заведующий научным отделом Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 80; ORCID iD 0000-0002-5250-3692
Лобанов Eвгений Валерьевич — инженер отдела по ремонту и обслуживанию медицинской техники Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 80; ORCID iD 0000-0001-9112-3230
Сиволобов Виталий Александрович — инженер отдела по ремонту и обслуживанию медицинской техники Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 80; ORCID iD 0009-0001-6347-2449
Лэ Ван Хоанг — аспирант кафедры сопротивления материалов ВолгГТУ; 400005, Россия, г. Волгоград, пр-т им. В.И. Ленина, д. 28; ORCID iD 0000-0002-1536-3061
Контактная информация: Солодкова Елена Геннадиевна, e-mail: mntk@isee.ru
Источник финансирования: исследование выполнено за счет гранта Российского научного фонда (№ 25-25-00303, https://rscf.ru/project/25-25-00303/).
Конфликт интересов: отсутствует.
Статья поступила 11.11.2024.
Поступила после рецензирования 04.12.2024.
Принята в печать 27.12.2024.
About the authors:
Elena G. Solodkova — C. Sc. (Med.), Deputy Director for Scientific Work, Volgograd Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 80, Zemlyachka str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-7786-5665
Svetlana B. Izmailova — Dr. Sc. (Med.), Head of the Department of Transplantation and Opto-Reconstructive Surgery of the Anterior Segment of the Eyeball, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0002-3516-1774
Igor N. Zakharov — Dr. Sc. (Tech.), Head of the Department of Structural Performance of Materials, Volgograd State Technical University; 28, V.I. Lenin ave., Volgograd, 400005, Russian Federation; ORCID iD 0000-0001-7177-7245
Viktor P. Fokin — Dr. Sc. (Med.), Professor, Chief Specialist of the Organizational and Methodological Department, Volgograd Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 80, Zemlyachka str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-2513-9709
Sergei V. Balalin — Dr. Sc. (Med.), Head of the Scientific Department, Volgograd Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 80, Zemlyachka str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-5250-3692
Evgenii V. Lobanov — Engineer, Department of Medical Equipment Maintenance, Volgograd Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 80, Zemlyachka str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0001-9112-3230
Vitalii A. Sivolobov — Engineer, Department of Medical Equipment Maintenance, Volgograd Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 80, Zemlyachka str., Volgograd, 400138, Russian Federation; ORCID iD 0009-0001-6347-2449
Le Van Hoang — Postgraduate Student, Department of Structural Performance of Materials, Volgograd State Technical University; 28, V.I. Lenin ave., Volgograd, 400005, Russian Federation; ORCID iD 0000-0002-1536-3061
Contact information: Elena G. Solodkova, e-mail: mntk@isee.ru
Financial Disclosure: the study was funded by a grant from the Russian Science Foundation (Grant No. 25-25-00303, https://rscf.ru/project/25-25-00303/).
There is no conflict of interest.
Received 11.11.2024.
Revised 04.12.2024.
Accepted 27.12.2024.
материал rmj.ru
