Введение
Меланома хориоидеи (МХ) — злокачественное внутриглазное новообразование меланоцитарного происхождения, характеризующееся агрессивным течением и имеющее неблагоприятный прогноз при развитии метастазов [1]. Из всех случаев меланомы глаза и его придаточного аппарата на увеальную меланому (УМ) приходится 93%, на меланому конъюнктивы — 5%, на меланому других структур придаточного аппарата глаза — 2% [2].
Энуклеация на сегодняшний день перестала быть методом выбора и применяется в исключительных случаях: при большой протяженности (более 16 мм) и высоте опухолей (более 7 мм), а также пери- и юкстапапиллярной локализации с распространением опухоли на диск зрительного нерва (ДЗН).
Несмотря на успехи в развитии локального лечения УМ, особо проблемной задачей при отказе пациента от энуклеации остается лечение «больших» опухолей (высотой от 6 до 10 мм) [3]. Трудность лечения данной категории пациентов обусловлена исходно большими размерами опухолями, что влечет за собой изначально, как правило, более низкие зрительные функции, а также больший риск осложнений при проведении органосохраняющих операций [4].
Брахитерапия (БТ) является основным методом лечения МХ в связи с высокой эффективностью, а также с наибольшей доступностью данного метода лечения. В нашей стране для лечения МХ наиболее широко используется БТ с Ru-106 [1, 5–7]. Однако эффективность БТ с Ru-106 снижается при высоте опухоли более 5,5–6 мм, а облучение опухолей более 6 мм может приводить к постлучевым осложнениям, для купирования которых могут потребоваться витреоретинальные вмешательства [8–10]. К другим лучевым методам лечения МХ относятся протонотерапия и стереотаксическая радиохирургия/радиотерапия. Протонотерапия имеет серьезный недостаток — облучение от 1,5 до 3 мм здоровых тканей по периферии опухоли, а также необходимость проведения хирургического этапа для фиксации танталовых маркеров к склере. Это связано с необходимостью расширения зоны облучения ввиду возможных погрешностей при «прицеливании», а также микродвижений глаз пациента.
Стереотаксическая радиохирургия «Гамма-нож» и «Кибер-нож» в настоящее время показывает многообещающие результаты в лечении меланомы хориоидеи, однако данный вид лечения сопряжен с риском развития потенциально опасных для зрения радиоиндуцированных осложнений (катаракта, гемофтальм, лучевая ретинопатия, атрофия зрительного нерва и неоваскулярная глаукома). Вероятность развития постлучевых осложнений прямо пропорциональна размеру очага [11].
Еще один способ лечения УМ больших размеров — хирургическое удаление опухоли, применяются 2 варианта: транссклеральная резекция или «блокэксцизия» (склерувеоэктомия) для периферических и иридоцилиохориоидальных опухолей и трансретинальная резекция или «эндорезекция» (ЭР) для лечения МХ постэкваториальной локализации. При «больших» МХ грибовидной формы первичная ЭР с последующей БТ склерального ложа с противорецидивной целью может стать операцией выбора, так как существенно снижает лучевую нагрузку на структуры глаза. Количество публикаций, посвященных применению ЭР МХ в зарубежной литературе, немногочисленно, а в отечественной литературе — всего одно исследование, в котором результаты первичной ЭР представлены вместе с результатами ЭР после БТ [12].
Цель исследования: представить результаты 10-летнего опыта лечения пациентов с МХ методом первичной ЭР.
Содержание статьи
Материал и методы
Методом первичной ЭР за период с 2014 по 2024 г. было пролечено 35 пациентов (35 глаз) в возрасте от 30 до 75 лет (средний возраст — 58 лет) с МХ. Среди них было 9 (26%) женщин и 26 (74%) мужчин.
По международной классификации TNM (AJCC) (2017 г.), у 11 (31%) пациентов опухоль соответствовала стадии T3, у 24 (69%) — T2. Ни у одного пациента на момент лечения метастазов МХ выявлено не было. Высота опухоли до лечения варьировалась от 6,0 до 11,6 мм (средняя — 8,2 мм), протяженность — от 7,8 до 13,9 мм (средняя — 11 мм).
В 32 (91%) случаях имела место вторичная отслойка сетчатки, средняя высота которой составила 3,7 мм (от 0,6 до 6,8 мм). МХ локализовалась в нижневнутреннем отделе у 1 пациента (3%), в нижненаружном — у 10 (28%), в нижнем — у 2 (6%), в наружном — у 6 (17%), во внутреннем — у 1 (8%), в верхненаружном — у 3 (8%), в верхневнутреннем — у 5 (14%), в верхнем — у 6 (17%).
Средняя величина максимально корригированной остроты зрения (МКОЗ) до лечения составляла 0,4 (0,005–1,0).
Операцию проводили под общей или местной ретробульбарной анестезией. На начальных этапах исследования при эндовитреальном удалении опухоли с одновременной БТ склерального ложа операцию выполняли под общим обезболиванием (n=13 (37%)). Во время наркоза создавали медикаментозно-контролируемую гипотонию с уровнем систолического артериального давления примерно 60–70 мм рт. ст. с целью снижения риска интраоперационного кровотечения. Впоследствии все операции проводили под местной анестезией и акинезией.
Для снижения риска гематогенного метастазирования по предложенному способу (патент РФ на изобретение № 2688966, приоритет от 28.06.2018) [13] после обеспечения доступа, тщательного осмотра эписклеральной поверхности в области проекции опухоли проводили блокировку одной или двух вортикозных вен, находящихся в квадрантах локализации МХ, на расстоянии не менее 1,5–2,0 см от места выхода вены из склеры.
В случаях, когда имелись помутнения хрусталика, затрудняющие визуализацию глазного дна, проводилась факоэмульсификация катаракты (ФЭК) по стандартной бимануальной технологии с имплантацией интраокулярной линзы (ИОЛ) в капсульный мешок.
Эндовитреальную хирургию начинали с установки 3 портов в проекции плоской части цилиарного тела с учетом локализации опухолевого очага. Для дополнительного освещения и возможности применения бимануальной техники удаления МХ устанавливали проводник 29 G, в который фиксировали эндоосветитель — шандельер высокой интенсивности Vivid (Synergetics, США). Далее проводили стандартную субтотальную витрэктомию. С помощью ретинального пинцета проводили удаление эпиретинальных мембран, а также участков плотной фиксации стекловидного тела к сетчатке. Для адаптации сетчатки, снижения риска интраоперационного кровотечения и предотвращения диссеминации опухолевых клеток витреальную полость заполняли перфторорганическим соединением (ПФОС). Следующим этапом выполняли диатермокоагуляцию сетчатки и сосудистой оболочки до склеры вокруг видимого в операционный микроскоп основания опухолевого очага на расстояние не менее 1–1,5 мм. Далее проводили ретинотомию по границе диатермокоагуляции с последующей ретинэктомией над МХ. При удалении части МХ, обращенной к периферии глазного дна, использовали частоту резов витреотома 2000 резов/мин, а при удалении части МХ ближе к фовеа и ДЗН — 5000 резов/мин на максимальном вакууме. После удаления МХ формировали хирургическую колобому с захватом 1 мм слоя окружающих тканей с одновременной коагуляцией кровеносных сосудов. Полученный материал отправляли срочно в лабораторию для исследования. По краю хирургической колобомы и по поверхности склерального ложа выполняли эндолазеркоагуляцию для осуществления ретинопексии и профилактики рецидива МХ. Затем проводили замену ПФОС на газ или силиконовое масло и выполняли циркулярную эндолазеркоагуляцию (ЭЛК) в 2 ряда. После тампонады витреальной полости извлекали порты и на места склеротомий для герметизации накладывали узловые швы с использованием шовного материала викрил 8-0. В местах установки портов проводили криопексию в течение 30–45 с для профилактики экстра- и интрасклеральных рецидивов МХ.
С целью облучения ложа опухоли и профилактики локальных рецидивов проводили одномоментную БТ путем подшивания к эписклере на проекцию хирургической колобомы офтальмоаппликатора (ОА) с Ru-106 с поглощенной дозой облучения на внутреннюю поверхность склеры не менее 150 Гр. Снятие ОА осуществляли на следующий день после достижения необходимой поглощенной дозы на внутреннюю поверхность склеры.
Статистическая обработка данных проводилась с использованием компьютерных программ MedCalc19.5.3. и Microsoft Office Excel 2019 и включала методы описательной статистики, анализ трех- и пятилетней выживаемости методом Каплана — Мейера. Для сравнения количественных признаков в зависимых выборках с учетом отсутствия нормального распределения использовался непараметрический критерий Уилкоксона.
Средний срок наблюдения пациентов составил 69 мес. (от 16 до 132 мес.).
Результаты исследования
При гистологическом исследовании материала ЭР МХ были обнаружены 2 варианта фенотипов меланоцитов — веретеноклеточный (23 случая) и смешанный эпителиоидно-веретеноклеточный (12 случаев).
К особенностям послеоперационного периода (1-я неделя после ЭР) относились транзиторные осложнения: незначительный отек век (n=35), большой отек и инъекция конъюнктивы (n=35), отек роговицы и складки десцеметовой мембраны (n=3), экссудат в передней камере (n=3), отслойка сосудистой оболочки (ОСО) в виде пузыря (n=1), отек сетчатки в макуле и парамакулярной области (n=5), гифема до 3 мм (n=2), частичный гемофтальм (n=1). В 1 случае развилась заднекапсулярная катаракта из-за контакта с газо-воздушной смесью.
В отдаленном периоде наблюдения (от 3 до 18 мес.) осложнения отмечались у 62% пациентов. Наиболее часто наблюдали заднекапсулярную катаракту (n=15). Реже отмечались вторичная катаракта (n=6), кистозный макулярный отек (n=6), эмульгация силиконового масла (n=5), рецидив отслойки сетчатки после удаления силиконового масла (n=4), пролиферативная витреоретинопатия (n=3), эпиретинальный фиброз (n=2), фиброз задней капсулы хрусталика (n=2), частичная атрофия зрительного нерва (n=2). Отмечались также рецидивирующее кровоизлияние в витреальную полость (n=1), увеит (n=1), гемофтальм (n=1), нейроретинопатия (n=1), субатрофия глазного яблока (n=1), дислокация макулярной зоны (n=1).
После лечения МКОЗ была в диапазоне от светоощущения с неправильной светопроекцией до 0,8 (средняя — 0,15). У 19 (54%) пациентов показатель МКОЗ после лечения снизился от 25 до 80%, у 10 (28%) — более чем на 80%, у 3 (9%) отмечено незначительное улучшение МКОЗ. В целом отмечалось статистически значимое снижение МКОЗ после ЭР (p<0,0001, рассчитанный по критерию Уилкоксона).
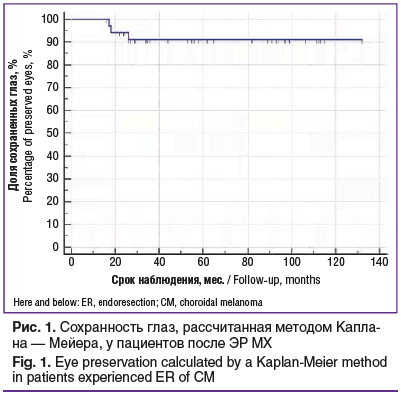
В 32 (91%) случаях удалось сохранить пролеченные глаза, хотя они, согласно клиническим рекомендациям (2020) по лечению МХ, подлежали энуклеации. В 3 случаях была выполнена энуклеация ввиду рецидива опухоли (n=2) или развития осложнений (n=1). Рецидив опухоли выявлен через 10 и 15 мес. после ЭР. Трех- и пятилетний уровень сохранности глаз, рассчитанный методом Каплана — Мейера, составил 91% (рис. 1).
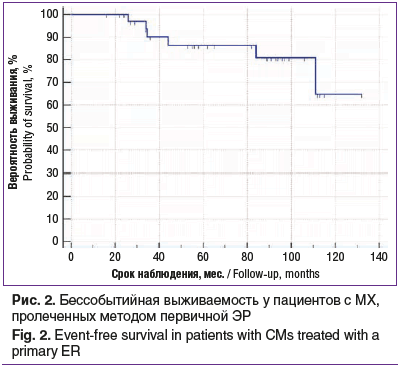
У 4 пациентов при сроках наблюдения 17, 20, 24, 65 мес. выявлено метастатическое поражение печени. Средний срок наблюдения за пациентами, у которых признаков диссеминации опухоли выявлено не было, составил 73 мес. (от 16 до 132 мес.). Трех- и пятилетний показатель бессобытийной выживаемости, рассчитанный методом Каплана — Мейера, составил 90 и 86% соответственно (рис. 2).
Обсуждение
На сегодняшний день БТ является эффективным локальным методом лечения и «золотым стандартом» среди существующих органосохраняющих методов лечения МХ, что подтверждается отечественными и зарубежными исследованиями [1, 4, 5–7]. При этом показатели метастазирования и специфической выживаемости пациентов после БТ соответствуют таковым при использовании других методов лечения МХ [14]. Фактором, существенно ограничивающим использование БТ, является высота опухолевого очага. Так, БТ с изотопом I-125, являющимся источником γ-излучения, эффективна в облучении опухолей высотой до 10 мм, по некоторым данным, до 16,8 мм. В РФ главным образом используется БТ с β-источником — Ru-106. Считается, что ОА с Ru-106 способен облучать опухоли высотой до 5–6 мм, а в ряде случаев, в комбинации с транспупиллярной термотерапией, до 8–10 мм.
Альтернативой энуклеации при лечении «больших» МХ может послужить ЭР МХ. Главным аргументом, выступающим против применения ЭР МХ, является мнение о том, что данный метод может вызывать интраоперационную диссеминацию опухолевых клеток, что может приводить к локальным рецидивам и повышать риск метастазирования [15]. Примером является опыт B. Damato et al. [16, 17], которые продемонстрировали результаты применения первичной ЭР МХ у 41 пациента, среди которых рецидив выявлялся в 8 (19%) случаях, сохранность глаз составила 70% (n=29). Стоит отметить, что это один из первых мировых опытов выполнения ЭР МХ, также хирургом не были использованы троакары с клапанами и не контролировалось внутриглазное давление во время операции.
M.J. Caminal et al. [18] сравнивали отдаленные результаты ЭР МХ и БТ I-125. Авторами были получены следующие результаты: метастатическое поражение наблюдалось у 11 пациентов в группе БТ с I-125 и у 1 пациента в группе ЭР (20,4 и 3,7% соответственно, p=0,053), локальный рецидив выявлен у 3 пациентов: у 1 — в группе БТ с I-125 и у 2 — в группе ЭР (1,8 и 7,4% соответственно). Десяти пациентам была выполнена вторичная энуклеация: в группе БТ — 7 (13%), в группе ЭР — 3 (11,1%). Авторы исследования пришли к выводу, что ЭР при МХ была эффективным методом лечения с результатами, аналогичными результатам использования БТ с I-125.
В то же время R. Karkhaneh et al. [19] продемонстрировали опыт применения ЭР МХ у 20 пациентов с возникновением рецидива в 5 (25%) случаях, что превышает частоту рецидива МХ после ЭР у других авторов. Метастатическое поражение наблюдалось у 1 пациента через 26 мес. после операции. Сами авторы делают вывод, что ЭР МХ является приемлемым вариантом лечения для сохранения глазного яблока и функционального зрения у отдельных пациентов, а отдаленные метастазы — нечастое явление при применении этого метода лечения.
С 2011 г. в системе государственного здравоохранения Бразилии использование БТ с ОА Ru-106 прекращено, A.A. Vidoris et al. [20] использовали ЭР МХ у 14 пациентов в качестве альтернативного метода лечения МХ, чтобы избежать энуклеации. По результатам 5-летнего опыта авторы сообщают о 100% сохранности глаз, отсутствии внутриглазного рецидива. Один пациент умер через 12 мес. после операции от метастатического заболевания.
За период наблюдения в исследовании J. García-Arumí et al. [21], который варьировал от 12 до 72 мес., ни одному из 25 пациентов не пришлось подвергаться энуклеации. МКОЗ варьировалась в диапазоне от движения руки у лица до 0,6 (в среднем — 0,2), что соответствует нашим результатам. В целом существенное ухудшение МКОЗ после ЭР МХ является закономерным с учетом размеров опухоли, необходимости дополнительного иссечения здоровых тканей, а также исходной локализации опухоли (53% опухолевых очагов располагались в наружной полусфере глазного дна).
Процент осложнений после ЭР МХ в нашем исследовании коррелирует с данными литературы и варьируется от 62 до 86% [16–21]. Наиболее часто встречаются катаракта, макулярный отек и рецидив отслойки сетчатки, что соответствует и нашим данным. Развитие осложнений и их клинических проявлений приходится на 3–18-й месяц после операции, что также подтверждается результатами настоящего исследования. Самое частое осложнение — это заднекапсулярная катаракта, что является закономерным, учитывая тампонаду силиконовым маслом. Данное осложнение является курабельным и может быть безопасно устранено методом ФЭК + ИОЛ; для купирования других осложнений могут потребоваться дополнительные многократные вмешательства, в том числе и повторная эндовитреальная хирургия.
Заключение
Таким образом, наш многолетний опыт наблюдения за пациентами с МХ, пролеченными методом ЭР, обосновывает эффективность, безопасность и целесообразность более широкого применения данного метода у пациентов с «большими» МХ, что позволяет избегать энуклеации без повышения риска метастазирования.
Сведения об авторах:
Яровой Андрей Александрович — д.м.н., заведующий отделом офтальмоонкологии и радиотерапии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0003-2219-7054
Горшков Илья Михайлович — к.м.н., заведующий отделением витреоретинальной хирургии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0002-9370-5549
Яровая Вера Андреевна — к.м.н., врач-офтальмолог отдела офтальмоонкологии и радиотерапии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0001-8937-7450
Мирошников Владимир Игоревич — врач-офтальмолог, аспирант отдела офтальмоонкологии и радиотерапии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0009-0006-4839-1428
Володин Денис Павлович — к.м.н., врач-офтальмолог, младший научный сотрудник ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0002-3660-7803
Контактная информация: Мирошников Владимир Игоревич, e-mail: vladimir.miroshnikov@icloud.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 20.12.2024.
Поступила после рецензирования 10.01.2025.
Принята в печать 30.01.2025.
About the authors:
Andrey A. Yarovoy — Dr. Sc. (Med.), Head of the Department of Ophthalmo-oncology and Radiotherapy, S. Fyodorov Eye
Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0003-2219-7054
Il’ya M. Gorshkov — C. Sc. (Med.), Head of the Department of Vitreoretinal Surgery, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0002-9370-5549
Vera A. Yarovaya — C. Sc. (Med.), Ophthalmologist, Department of Ophthalmo-oncolology and Radiotherapy, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0001-8937-7450
Vladimir I. Miroshnikov — Ophthalmologist, Postgraduate Student of the Department of Ophthalmo-oncology and Radiotherapy, S. Fyodorov Eye Microsurgery Federal State
Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0009-0006-4839-1428
Denis P. Volodin — C. Sc. (Med.), Ophthalmologist, Junior Scientific Officer, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0002-3660-7803
Contact information: Vladimir I. Miroshnikov, e-mail: vladimir.miroshnikov@icloud.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 20.12.2024.
Revised 10.01.2025.
Accepted 30.01.2025.
материал rmj.ru
