Введение
Неоваскулярная возрастная макулярная дегенерация (нВМД) — дегенеративное заболевание сетчатки, которое ведет к необратимому снижению центрального зрения и является причиной 8,7% всех случаев слепоты в мире, особенно у людей старше 60 лет [1]. Внедрение в повседневную офтальмологическую практику антиангиогенной терапии, основанной на определении роли дисрегуляции эндотелиального сосудистого фактора роста (vascular endothelial growth factor — VEGF) в патогенезе хориоидальной неоваскуляризации (ХНВ) и разработке эффективных препаратов ингибиторов ангиогенеза, революционно изменило подходы к лечению нВМД [2–4].
Одним из осложнений нВМД, которое манифестирует резким снижением зрения и может возникнуть даже на фоне проводимой регулярной антиангиогенной терапии, является обширное субретинальное кровоизлияние (СРК) в макулярной области, обусловленное разрывом сосудов хориоидальной неоваскулярной мембраны с выходом крови в пространство между нейроретиной и пигментным эпителием сетчатки (ПЭС) или между ПЭС и хориоидеей [5]. В связи с увеличением средней продолжительности жизни в развитых странах и, соответственно, увеличением доли пациентов пожилого возраста выявляемость нВМД с каждым годом растет, что сопровождается в том числе и ростом количества случаев нВМД, осложненной СРК [6]. Так, в популяции частота СРК площадью более 1 диаметра диска (ДД) зрительного нерва составляет 24 человека на 1 млн в год, частота СРК площадью более 2 ДД — 5,4 человека на 1 млн в год [7].
Важным аспектом эффективного лечения СРК при нВМД является проведение терапии в кратчайшие сроки от развития кровоизлияния для получения положительного эффекта за счет прилегания фовеолярной сетчатки к ПЭС и предотвращения развития вторичных дегенеративных изменений нейросенсорной ткани. В соответствии с градацией FLATCAPS (Foveal involvement, Layer, Age, Thickness, Cause/Pathogenesis, Size), можно выделить малые (1–5 ДД), средние (более 5 ДД) и массивные (выходящие за пределы сосудистых аркад) СРК [5]. При этом для лечения в зависимости от объема кровоизлияния используются различные монотерапевтические и комбинированные подходы:
монотерапия анти-VEGF препаратами, наиболее эффективная при малых СРК [8, 9];
пневмодислокация с тромболизисом (интравитреальное введение (ИВВ) тромболитических препаратов и перфторорганического газа) с анти-VEGF терапией и без таковой, которые могут быть эффективны при малых и средних СРК [10];
субретинальное введение тромболитических препаратов с пневмодислокацией с анти-VEGF терапией и без нее с витрэктомией и без таковой при массивных СРК [5, 11].
При позднем обращении пациентов с СРК за медицинской помощью, особенно при массивных кровоизлияниях, когда уже запущены и длительно идут процессы организации субретинального кровяного сгустка, методы лечения, основанные на тромболизисе и пневмодислокации крови из макулярной области, даже на фоне патогенетически ориентированной антиангиогенной терапии, малоперспективны [12]. Общепринятых эффективных методов лечения в таких случаях не существует. Также нет общепринятого подхода в случаях неэффективности описанных выше лечебных алгоритмов.
Одним из направлений по лечению таких сложных ситуаций является пересадка аутологичного ПЭС, при которой не только происходит удаление из-под сетчатки макулярной области патологического содержимого (организовавшаяся кровь, детрит, ХНВ), но и компенсируется неизбежно возникающий в таких случаях дефект слоя ПЭС [5, 13, 14].
Цель исследования: изучить эффективность и без-опасность пересадки аутологичного ПЭС при лечении нВМД, осложненной обширным СРК.
Содержание статьи
Материал и методы
В проспективное исследование, проведенное в Санкт-Петербургском филиале ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, включили 8 пациентов (8 глаз) с нВМД, осложненной обширным СРК. Исследование проведено в 2021–2024 гг. в соответствии с требованиями Хельсинкской декларации (в редакции 2003 г.), все участники подписывали информированное добровольное согласие на диагностическое обследование и хирургическое вмешательство.
Критерии включения: нВМД, осложненная обширным (более 5 ДД зрительного нерва) СРК. Критерии исключения: максимально корригированная острота зрения (МКОЗ) более 0,1, ХНВ, не связанная с нВМД, увеиты в анамнезе, недостаточная для проведения хирургического лечения и диагностических исследований прозрачность оптических сред, сосудистые заболевания органа зрения (диабетическая и постокклюзионная ретинопатия), отслойка сетчатки и макулярный разрыв (независимо от наличия в анамнезе и успешности хирургического лечения), афакия, дислокация или подшивная фиксация интраокулярной линзы, единственный видящий глаз.
При наличии собственного хрусталика первым этапом выполняли факоэмульсификацию с имплантацией искусственного хрусталика.
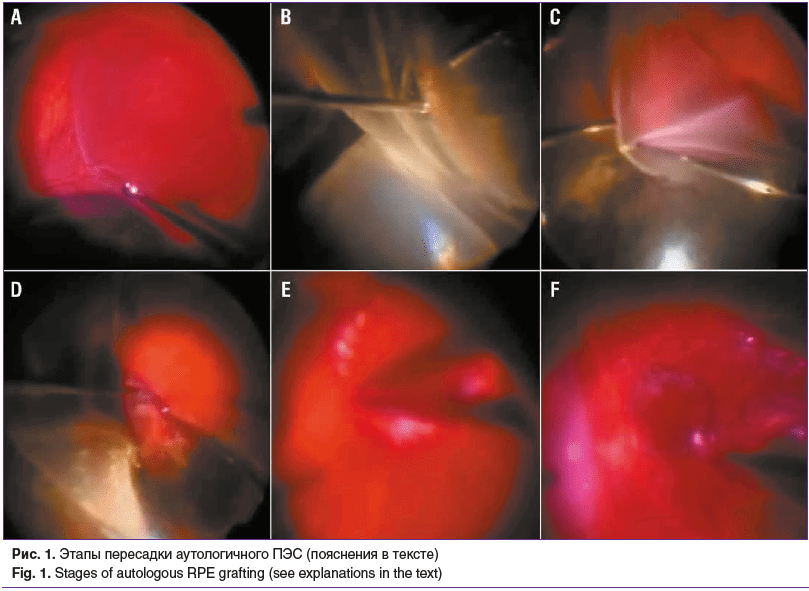
На этапе пересадки аутологичного ПЭС сначала проводили субтотальную трехпортовую витректомию 25 G. Далее выполняли индукцию отслойки сетчатки в наружных квадрантах путем субретинального введения сбалансированного раствора с помощью канюли 38 G (рис. 1A). Затем следовало гидродинамическое отслоение сетчатки в макуле путем аппаратной замены жидкости в преретинальном пространстве на стерильный воздух. Следующим этапом выполняли периферическую ретинотомию 270° в наружных квадрантах (рис. 1B), отгибали мобилизированную сетчатку к диску зрительного нерва для доступа в субретинальное пространство (рис. 1C) и удаляли из него патологическое содержимое (кровь, детрит, ХНВ) (рис. 1D). Далее проводили диатермическое отграничение и последующее выкраивание в нижненаружном квадранте в зоне интактного ПЭС полнослойного лоскута ПЭС — хориоидею округлой формы площадью 3–4 ДД (рис. 1E), после чего перемещали выкроенный аутолоскут ПЭС в макулярную область и позиционировали его в проекции фовеа (рис. 1F). Затем восстанавливали нормальное положение сетчатки введением перфторорганического соединения, выполняли по краю ретинотомии лазеркоагуляцию и замещали пер-фторорганическое соединение на силиконовое масло. Удаление силиконового масла проводили в сроки от 1,5 до 2 мес. после аутотранслокации ПЭС.
Всем пациентам проводили стандартное офтальмологическое обследование. Анатомическую эффективность пересадки ПЭС оценивали по данным офтальмоскопии с фоторегистрацией и оптической когерентной томографии (ОКТ), функциональную эффективность — по данным визометрии и микропериметрии.
Фоторегистрация глазного дна. Проводили ее с помощью лазерного офтальмоскопа, встроенного в микропериметр Compass (CenterVue, Италия). ОКТ. Структурные изменения сетчатки и подлежащих тканей, включая трансплантат, анализировали с помощью томографов Cirrus HD-OCT 5000 (Carl Zeiss Meditec, Германия) и Solix (Optovue, США). На линейных сканах через фовеа оценивали сохранность слоев нейроретины, наличие интраретинального отека, положение аутотрансплантата ПЭС. Визометрия. Исследование МКОЗ проводили монокулярно в стандартных условиях с использованием проектора знаков Huvitz CCP-3100 (Huvitz, Корея) с предъявлением буквенных оптотипов. Фундус-контролируемая микропериметрия. Световую чувствительность (СЧ) в макулярной области исследовали с помощью микропериметра Compass (CenterVue, Италия), используя протокол 10–2 (68 точек и 1 точка фиксации, пороговая стратегия 4–2, ахроматический объект III по Гольдману, время предъявления стимула 200 мс). Данные тестирования принимали для анализа при частоте ложноположительных и ложноотрицательных результатов менее 20%. Анализировали СЧ в точке фиксации, а также среднее значение СЧ для 13 точек, располагавшихся концентрично в проекции фовеа и парафовеа, и площадь зоны фиксации, которые определялись прибором автоматически.
Оптическую когерентную томографию и визометрию проводили перед пересадкой аутологичного ПЭС, затем через 1, 3, 6, 12 и 18 мес., а также при проведении дополнительных лечебных мероприятий. Фоторегистрацию и микропериметрию выполняли до лечения, через 6, 12 и 18 мес. (через 1 и 3 мес. по техническим причинам не проводили, так как силиконовая тампонада препятствует проведению микропериметрии). Безопасность пересадки ПЭС оценивали по частоте и спектру возникших в послеоперационном периоде осложнений, а также по возможности их устранения дополнительными лечебными мероприятиями.
Статистическая обработка результатов исследования проводилась с использованием методов непараметрического анализа в программе Statistica 12.0 (StatSoft Inc., США). Все количественные данные представлены как медиана и 1-й и 3-й квартили (Me [Q1; Q3]). При сравнении групп с зависимыми переменными использовали критерий Уил-коксона. Статистически значимыми считали результаты с уровнем значимости p<0,05.
Результаты исследования
Исследуемую группу составили женщины в возрасте от 60 до 83 лет (средний возраст — 72 года) (см. таблицу). Длительность СРК до проведения пересадки ПЭС варьировала от 14 до 180 дней (в среднем 75 дней). Три пациента (№ 5, № 6, № 7) ранее получали антиангиогенную терапию по поводу нВМД (от 4 до 9 инъекций). Трем пациентам (№ 2, № 6, № 8), обратившимся в ургентном порядке по поводу СРК в сроки 6, 22 и 60 дней после кровоизлияния, первым этапом была предпринята попытка пневмодислокации с фибринолизом (ИВВ рекомбинантной проурокиназы и газа C3F8) в комбинации с ингибитором ангиогенеза, что не привело к значимому улучшению зрения. У трех пациентов в анамнезе имелось сопутствующее заболевание — открытоугольная глаукома (I и II стадия), по поводу которой пациенты получали медикаментозное гипотензивное лечение.
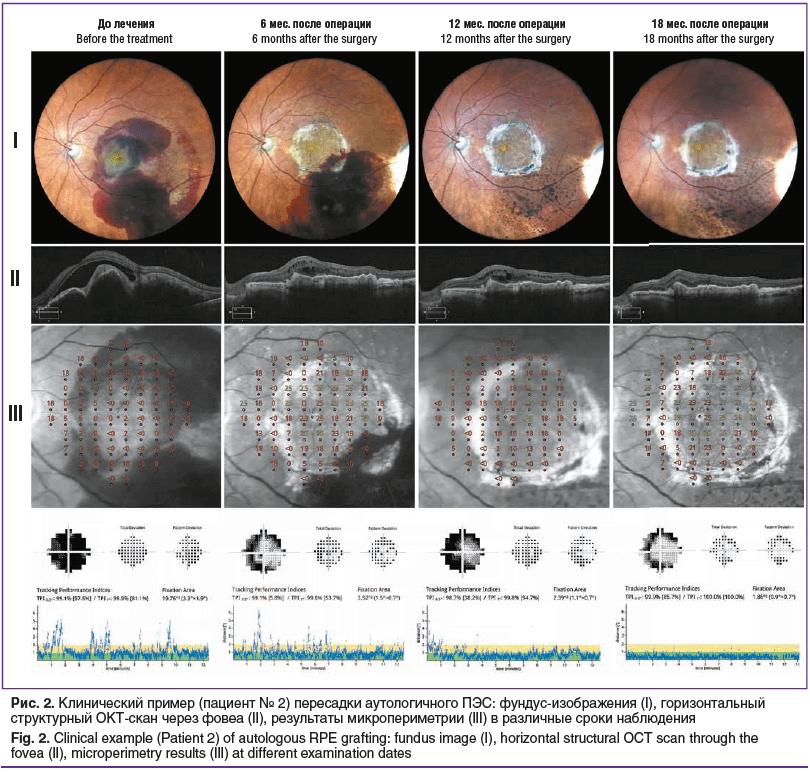
Хирургическое лечение проведено в соответствии с протоколом, без интраоперационных осложнений. По данным ОКТ и офтальмоскопии, у всех пациентов перемещенный аутолоскут располагался под макулярной зоной сетчатки в правильной ориентации пигментным эпителием к нейросенсорному слою (рис. 2). При этом фовеа располагалась над центральной зоной лоскута с интактным ПЭС. Через 1 мес. после аутотранслокации наблюдали незначительный отек аутолоскута, который полностью купировался к 3-му месяцу послеоперационного наблюдения и в последующем более не определялся.
При анализе функциональных показателей значение МКОЗ до пересадки ПЭС составило 0,05 [0,02; 0,08], через 1 и 3 мес. после хирургического лечения значимо не изменилось и составило 0,07 [0,04; 0,1] и 0,09 [0,05; 0,1] соответственно (p=0,25 и р=0,14) (рис. 3). Через 6 мес. МКОЗ увеличилась до 0,1 [0,05; 0,13], но значимо не отличалась от предоперационного уровня (р=0,09). Через 12 и 18 мес. отмечено дальнейшее увеличение показателей МКОЗ до 0,13 [0,1; 0,2] и 0,18 [0,14; 0,2] и значимое отличие от предоперационных значений (p=0,01) (см. рис. 3).
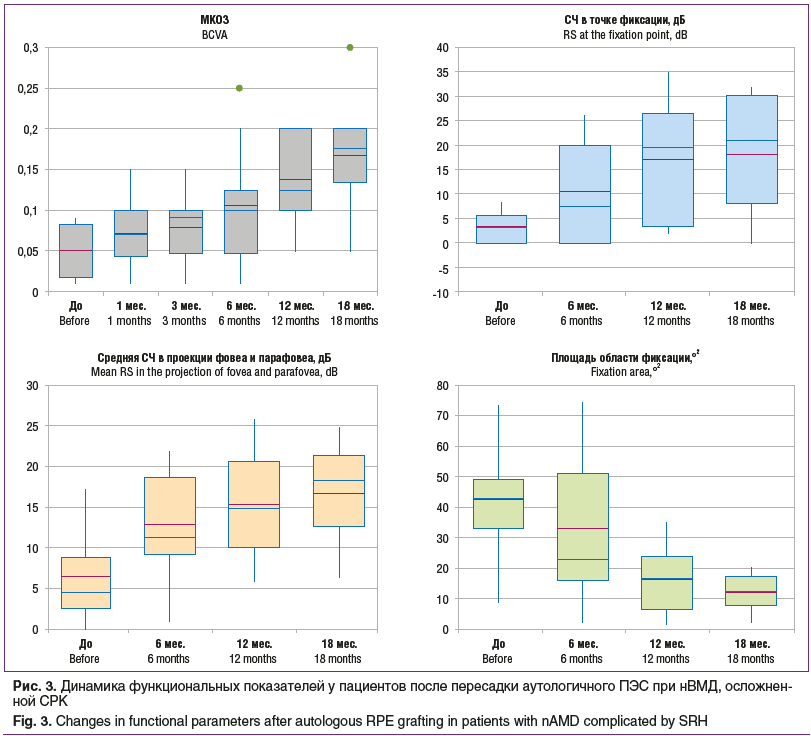
При проведении микропериметрии до пересадки ПЭС СЧ в точке фиксации варьировала от 0 до 8 дБ, составляя в целом в группе 3,0 [0; 5,5] дБ. Через 6 мес. было отмечено увеличение СЧ в точке фиксации до 7,5 [0; 20,0] дБ (р=0,08). Значимое увеличение СЧ в точке фиксации было выявлено при контрольных осмотрах через 12 и 18 мес. — 19,5 [3,5; 26,5] и 21,0 [8,0; 30,0] дБ соответственно (р=0,01 и р=0,02).
При анализе средней СЧ в 13 точках паттерна, проецирующихся в зону фовеа и парафовеа, дооперационный показатель составил 4,5 [2,5; 8,7] дБ (см. рис. 3). Через 6 мес. показатель увеличился до 11,3 [9,1; 18,6] дБ, но значимо не отличался от предоперационного (р=0,09). Значимое увеличение средней СЧ было отмечено через 12 и 18 мес. — 14,9 [10,0; 20,6] и 18,2 [12,5; 21,3] дБ соответственно (p=0,03).
Площадь области фиксации при проведении микропериметрии до проведения аутотранслокации составляла 42,7 [32,6; 49,0]°2, варьируя от 8,7до 73,3°2 (см. рис. 3). Через 6 мес. после пересадки ПЭС площадь области фиксации уменьшилась до 22,6 [15,9; 51,0]°2 (p=0,26), при этом значения также находились в широком диапазоне — от 2,5 до 74,3°2. В дальнейшем площадь области фиксации продолжила уменьшаться, составив 16,7 [6,44; 23,8] и 12,3 [7,9; 17,2]°2 через 12 и 18 мес. после аутотранслокации соответственно (p=0,01).
Послеоперационные осложнения были выявлены в 2 случаях в виде пролиферативной витреоретинопатии (ПВР), манифестировавшей отслойкой сетчатки. В обоих случаях ПВР развилась в раннем послеоперационном периоде на этапе силиконовой тампонады. Для купирования ПВР предпринимали повторное витреоретинальное вмешательство с ретампонадой силиконовым маслом. В одном случае для купирования ПВР оказалось достаточно однократной ретампонады, во втором потребовалась третья витреоретинальная операция с повторной ретампонадой силиконом, после чего была достигнута компенсация пролиферативного процесса в стекловидной камере. У этих же 2 пациентов после купирования ПВР был выявлен кистозный отек сетчатки, по поводу чего проводили ИВВИА.
У 1 пациента в послеоперационном периоде развился рецидив ХНВ, манифестировавший СРК вокруг пересаженного аутолоскута ПЭС, потребовавший возобновления регулярной антиангиогенной терапии.
Обсуждение
В проведенное исследование были включены случаи с массивными СРК, при которых кровь занимала всю область макулы и распространялась за ее пределы, то есть клинические ситуации, при которых использование традиционных методов лечения, как правило, малоэффективно [10]. Длительность кровоизлияния, превышавшая в 2 случаях 1 мес., а в 5 из 8 случаев — 2 мес., также указывает на низкие шансы функционального улучшения при традиционном лечении, поскольку продукты распада крови оказывают дополнительное токсическое воздействие на нейроретину и ПЭС, уже ранее патологически измененные вследствие нВМД, а сохраняющийся между нейросенсорной сетчаткой и сосудистой оболочкой плотный патологический субстрат в виде организовавшегося кровяного сгустка препятствует нормальной трофике сетчатки [12]. Поэтому в 3 случаях, когда до пересадки ПЭС были предприняты попытки тромболизиса и пневмодислокации крови из макулы, лечение не привело к какому-либо улучшению зрения у пациентов.
Субретинальное хирургическое вмешательство с пересадкой аутологичного интактного ПЭС с периферии глазного дна в макулярную область позволяет не только удалить патологическое содержимое под нейроретиной, но и компенсировать дефект слоя ПЭС, что создает условия для улучшения питания сохранившихся участков нейроретины с их функциональным восстановлением и улучшением зрительных функций глаза. Действительно, у всех пациентов нейроретина примыкала к транслоцированному лоскуту ПЭС, что свидетельствует о наличии устойчивого контакта наружных слоев сетчатки (фоторецепторного слоя) с клетками ПЭС. Отсутствие в послеоперационном периоде отслойки нейроретины и отека в макуле также свидетельствует о полноценном функционировании пересаженного лоскута с ПЭС и обеспечении им трофической и барьерной функции.
Несмотря на многоэтапность хирургического лечения и длительный период реабилитации, у всех пациентов наблюдалось медленное, но улучшение регистрируемых функциональных показателей, полученные результаты свидетельствуют о функциональной эффективности методики пересадки. При этом положительная динамика наблюдается уже через 6 мес. после пересадки ПЭС, а статистически значимые изменения регистрируются через 1 год после оперативного вмешательства.
Основной используемый в клинической практике функциональный показатель — МКОЗ. У всех пациентов в послеоперационном периоде наблюдалось увеличение МКОЗ, при этом через 1 год только у 1 пациента значение было менее 0,1, в то время как у 3 пациентов МКОЗ достигла 0,2 и более, хотя при поступлении на лечение не превышала 0,05 в условиях прозрачных оптических сред. Сходные результаты были ранее получены и другими исследователями [15–18].
Тем не менее при выраженных изменениях сетчатки вследствие нВМД показатель МКОЗ не может в полной мере отражать изменение качества зрения у пациента, поэтому для анализа эффективности хирургического вмешательства нами были использованы результаты микропериметрии. Ранее изучение динамики СЧ после такого вмешательства проводилось лишь в единичных работах на отдельных клинических наблюдениях [17]. Полученные в нашем исследовании данные являются уникальными. Наблюдаемая динамика увеличения СЧ соответствует изменению МКОЗ в послеоперационном периоде, при этом важно, что СЧ неравномерно, но увеличивалась не только в точке фиксации, но и по всей площади фовеа и парафовеа, что согласуется со структурными изменениями нейроретины над пересаженным лоскутом ПЭС.
Еще один учитываемый показатель — площадь области фиксации в условиях низких значений МКОЗ позволяет оценить сохранность центрального зрения и способности фиксировать объект. Выявленное уменьшение площади области фиксации в послеоперационном периоде также согласуется со структурно-функциональным восстановлением нейроретины в макуле. Таким образом, можно говорить об улучшении не только остроты зрения, но и центрального поля зрения.
Наиболее частым осложнением пересадки аутологичного ПЭС у пациентов в нашем исследовании стала ПВР с формированием отслойки сетчатки, что соответствует данным литературы [15, 18]. Причиной ПВР при субретинальных вмешательствах является наличие комплекса факторов, к которым относятся интраоперационно вызываемая отслойка сетчатки, обширная ретинотомия, хориоидотомия в зоне забора аутолоскута, большая длительность операции. В целом частота осложнений соответствовала опубликованным ранее данным [15, 18].
Проведенное исследование имеет определенные ограничения. В частности, выборка была ограничена 8 пациентами, не учитывалось возможное влияние на функциональное состояние сетчатки проведенного ранее лечения и имеющихся сопутствующих заболеваний (глаукома). Тем не менее использованные методы анализа и наблюдаемая динамика показателей позволяют оценить методику пересадки аутологичного ПЭС по выбранным параметрам.
Заключение
Проведение пересадки аутологичного ПЭС при нВМД, осложненной обширным СРК, позволяет улучшить как остроту зрения, так и центральное поле зрения. Своевременно выявленные побочные эффекты и осложнения могут быть успешно купированы дополнительными лечебными мероприятиями без влияния на конечный функциональный результат.
Сведения об авторах:
Сергей Викторович Сосновский — к.м.н., доцент, заместитель директора Санкт-Петербургского филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0002-7413-7478
Эрнест Витальевич Бойко — д.м.н., профессор, директор Санкт-Петербургского филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; заведующий кафедрой офтальмологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-7413-7478
Алексей Александрович Суетов — к.м.н., врач-офтальмолог Санкт-Петербургского филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0002-8670-2964
Таисия Александровна Докторова — врач-офтальмолог Санкт-Петербургского филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0003-2162-4018
Дарья Игоревна Шумова — врач-офтальмолог Санкт-Петербургского филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0002-1659-1576
Контактная информация: Суетов Алексей Александрович, e-mail: ophtalm@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.11.2024.
Поступила после рецензирования 04.12.2024.
Принята в печать 27.12.2024.
About the authors:
Sergey V. Sosnovskii — Cand. Sc. (Med.), Assistant Professor, Deputy Director of the Saint Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0002-7413-7478
Ernest V. Boiko — Dr. Sc. (Med.), Professor, Director of the St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; Head of the Department of Ophthalmology, North West State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-7413-7478
Alexey A. Suetov — Cand. Sc. (Med.), Ophthalmologist, St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0002-8670-2964
Taisiya A. Doktorova — Ophthalmologist, St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0003-2162-4018
Dariya I. Shumova — Ophthalmologist, St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., St. Petersburg, 192283, Russian Federation; ORCID iD 0000-0002-1659-1576
Contact information: Alexey A. Suetov, e-mail: ophtalm@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.11.2024.
Revised 04.12.2024.
Accepted 27.12.2024.
материал rmj.ru
