Введение
Глаукомная оптическая нейропатия (ГОН) и неартериитная передняя ишемическая оптическая нейропатия (НАПИОН) являются основными причинами необратимого снижения зрительных функций у лиц среднего и пожилого возраста, оставаясь серьезной медицинской и социальной проблемой [1, 2].
Структурные изменения диска зрительного нерва (ДЗН) и аксонов ганглиозных клеток сетчатки являются основными клиническими показателями тяжести обоих заболеваний.
При глаукоме прогрессирующее ретроградное повреждение аксонов ганглиозных клеток сетчатки инициировано в головке зрительного нерва и ассоциировано с острым и/или хроническим повышением внутриглазного давления (ВГД) [3]. Основным местом повреждения аксонов является решетчатая мембрана, ремоделирование которой происходит в результате увеличения трансмембранного градиента давления. В результате этого развивается папиллярная гипоперфузия с последующей гибелью волокон зрительного нерва. Эти изменения могут формироваться при повышении ВГД, низком перфузионном давлении и/или низком давлении спинномозговой жидкости [4–6]. Изменения при ГОН необратимы, но при своевременной диагностике и лечении могут быть предотвращены или замедлены.
Этиология и патофизиология НАПИОН остаются дискутабельными [7–9]. Тем не менее общепризнано, что основная причина заболевания — транзиторная неперфузия и гипоперфузия коротких задних цилиарных артерий, головки зрительного нерва у лиц среднего и пожилого возраста [10, 11]. При воздействии местных и системных факторов риска возникают субклиническая ишемия и гипоксия головки зрительного нерва, нарушение аксоплазматического транспорта в волокнах зрительного нерва, аксональный отек, компрессия капилляров, развитие клинически значимой ишемии [12–14].
Диагностика в острой фазе заболевания при безболезненной потере зрения в течение нескольких часов или дней, отеке ДЗН не вызывают трудностей. Атрофия зрительного нерва (секторальная или диффузная) развивается спустя 1,5–3 мес., картина потери перипапиллярного слоя нервных волокон сетчатки (СНВС) и дефектов поля зрения может быть сходной с изменениями при глаукоме (рис. 1) [8, 15]. Эффективные методы лечения НАПИОН отсутствуют. Терапия заболевания сводится к выявлению и курации системных факторов риска сосудистых нарушений с целью предотвращения рецидивов и развития острой ишемии на парном глазу [16].
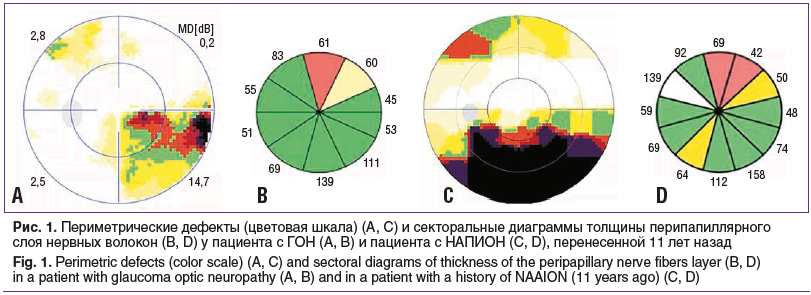
Сложности верификации НАПИОН и ГОН возникают при атипичных или незначительных изменениях ДЗН и неизвестном анамнезе [15, 17].
Вместе с тем недостаточная перфузия ДЗН может быть независимым фактором в патогенезе ГОН при коморбидных состояниях у возрастных пациентов, усугубляя выраженность структурно-функциональных изменений. В свою очередь, трудности диагностики могут быть сопряжены с ошибочно выбранной тактикой ведения таких пациентов.
Учитывая, что заболевания с различными патогенетическими механизмами и принципиально различными подходами к терапии могут характеризоваться сходными структурно-функциональными изменениями, вопрос их дифференциальной диагностики остается актуальным. Для использования в рутинной клинической практике требуется скрининговый универсальный метод объективной оценки биомаркеров нейродегенеративных заболеваний различного генеза.
Оптическая когерентная томография (ОКТ) признана основным методом диагностики структурных изменений сетчатки и зрительного нерва. Неинвазивность, высокая воспроизводимость определяют ценность метода как для рутинной клинической практики, так и для исследовательских целей.
Цель исследования: выявить ОКТ-маркеры структурных повреждений сетчатки и зрительного нерва при ГОН и перенесенной НАПИОН.
Содержание статьи
Материал и методы
В ходе проспективного исследования обследовано 22 пациента (возраст от 39 до 67 лет) с клинически значимой первичной открытоугольной глаукомой и 16 пациентов с НАПИОН, перенесенной не ранее 6 мес. до включения в исследование (возраст от 47 до 65 лет).
Для включения в исследование были отобраны пациенты с максимальной корригированной остротой зрения не ниже 0,4, прозрачными оптическими средами, длиной переднезадней оси глаза не более 25 мм, сферической рефракцией не более ±5 дптр или астигматизмом не более ±3 дптр без предшествующих хирургических вмешательств. Всем пациентам было проведено стандартное офтальмологическое обследование: визометрия, рефрактометрия, биометрия, тонометрия по Маклакову, гониоскопия, стандартная автоматизированная периметрия, ОКТ.
Диагноз ГОН основывался на данных комплексного офтальмологического обследования (эпизоды офтальмогипертензии, асимметрия угла передней камеры, экскавация ДЗН с истончением нейроретинального пояска в верхнем и нижнем секторах, периметрические дефекты) с учетом данных ОКТ. В исследование включены пациенты со II стадией глаукомы. При двустороннем поражении в статистическую выборку был включен только 1 глаз.
Неартериитная передняя ишемическая оптическая нейропатия была диагностирована с учетом характерного анамнеза (предшествующие острые безболезненные эпизоды снижения зрения), клинических признаков (отечный ДЗН в острой стадии, сегментарная атрофия или бледность ДЗН, соответствующие периметрические дефекты). Для исключения нисходящей атрофии зрительного нерва вследствие интракраниального поражения всем пациентам проведена магнитно-резонансная томография. У 5 пациентов с учетом анамнестических данных и данных истории болезни НАПИОН была диагностирована на обоих глазах. Период возникновения симптоматики на парном глазу варьировал от 1,5 года до 11 лет. При двустороннем поражении в исследование был включен лучший глаз.
Для тестирования поля зрения использовали ТОP-стратегию (tendency-oriented perimetry) пороговой оценки светочувствительности сетчатки в центральной зоне (30°), позволяющую оценить потерю светочувствительности сетчатки, глубину и форму дефектов, обусловленных заболеванием (Octopus 900, Haag-Streit AG, Швейцария). При сравнении двух групп использовали средний дефект — среднюю потерю светочувствительности (MD — mean defect).
Оптическую когерентную томографию проводили на спектральном томографе Optopol Revo NX (Optopol technology, Польша). Выполняли стандартное сканирование макулы и ДЗН (по протоколам 3D macula 8 мм, 3D disc 6 мм). Полученные результаты интерпретировали, используя встроенные алгоритмы и инструменты анализа: анализ макулярной области для исключения патологических изменений; анализ макулярного ганглиозного комплекса сетчатки (ГКС); анализ ДЗН и перипапиллярной сетчатки, включая оценку толщины СНВС. Анализировали протоколы с уровнем сигнала не менее 60%, отсутствием артефактов, вызванных движением глаз, морганием, плохой центрацией или ошибками сегментации. Для анализа формировали комбинированные протоколы и оценивали: параметры ДЗН (площадь диска, толщина преламинарной части и решетчатой мембраны); толщину перипапиллярного СНВС в 8 сегментах (верхний, нижний, назальный, темпоральный, верхненазальный, верхнетемпоральный, нижненазальный, нижнетемпоральный), включая средний показатель; толщину макулярного ГКС (верхняя и нижняя полусферы, средний показатель).
Кроме количественных показателей толщины макулярного ГКС и перипапиллярного СНВС оценивали форму дефектов поврежденных аксонов ганглиозных клеток сетчатки, используя вероятностные карты (signification map). Карты формируются автоматически путем преобразования карт толщины СНВС и ГКС при сравнении значений конкретного пациента с референтными значениями встроенной нормативной базы данных (соответствующей возрастной группы, этнической и половой принадлежности). В макулярной области анализировали изменения трех внутренних слоев сетчатки: СНВС (nerve fiber layer — NFL), слоя ганглиозных клеток (Ganglion cell layer — GCL), внутреннего плексиформного слоя (inner plexiform layer — IPL) (NFL + GCL + IPL significant), перипапиллярно — СНВС (NFL significant). Оценивали локализацию дефектов и их однородность. Цвет карт вероятностей определяет уровень значимости отклонений от референтных значений со шкалой от желтого (p>0,1) до красного (p<0,001).
Статистический анализ проводили с использованием программы StatTech v. 4.6.1 (разработчик ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка. Количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и интерквартильного интервала [IQR]. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполняли с помощью t-критерия Стьюдента, при неравных дисперсиях — с помощью t-критерия Уэлча. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна — Уитни. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Группы были сопоставимы по полу (М/Ж: 9/13 — ГОН, 9/7 — НАПИОН), возрасту (57,88±6,99 и 55,00±5,46 года соответственно), длине глаза (23,9 [23,8–24,8] и 23,9 [2,95–24,65] мм соответственно).
Не было выявлено достоверных различий толщины показателя перипапиллярного СНВС (среднего, в назальном и темпоральном квадрантах), толщины макулярного ГКС (среднего, верхней и нижней полусфер), толщины хорио-идеи.
Вместе с тем у пациентов с глаукомой выявлено статистически значимое истончение СНВС перипапиллярной сетчатки в нижнем и нижнетемпоральном сегментах с минимальными значениями в нижнетемпоральном секторе, истончение преламинарной части ДЗН и решетчатой мембраны (см. таблицу).
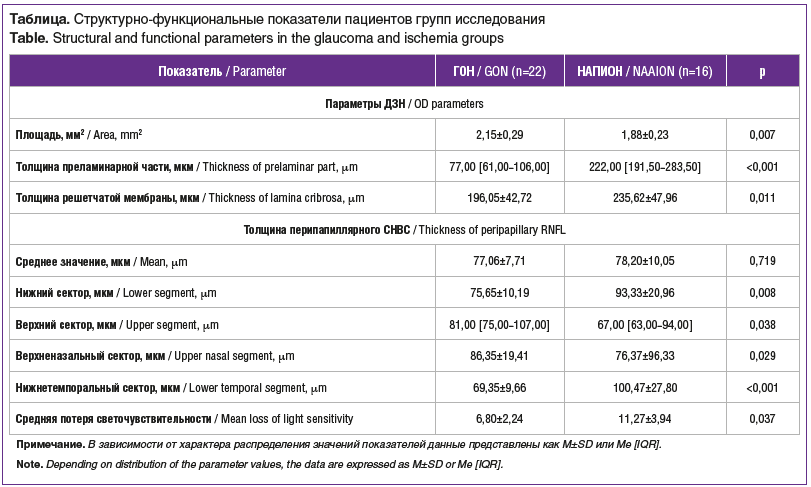
Для пациентов с ишемией характерны меньшая площадь ДЗН, более выраженная потеря световой чувствительности (MD). СНВС наиболее уязвим в верхненазальном сегменте (см. таблицу). Глубокие друзы ДЗН выявлены у 3 пациентов.
Анализ карт вероятности продемонстрировал, что локальные дефекты СНВС и ГКС могут быть не только локализованы, но и оценены по форме, площади и однородности. Выявлена вариабельность дефектов с характерными признаками для обеих нозологий.
Для дефектов перипапиллярного СНВС при глаукоме характерна клиновидная форма. Продолжением дефектов СНВС являются парафовеальные аркуатные дефекты макулярного ГКС (рис. 2). Окраска дефекта неоднородная — по оси дуги в центре преобладает красное окрашивание, по краю участки желтого цвета.

Выявленные дефекты СНВС при ишемии диффузные, занимают практически всю площадь перипапиллярной сетчатки между сосудистыми аркадами. В отличие от глаукомных, дефекты ГКС горизонтально ориентированы. Преобладает монохромно красный цвет дефектов с четко очерченными узкими границами желтого цвета (рис. 3).
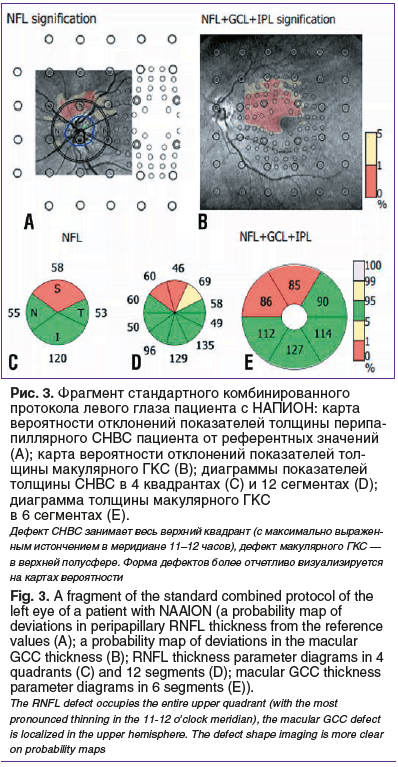
Таким образом, анализ карт вероятных отклонений структурных показателей от нормы, лежащий в основе полученных изображений, расширяет потенциал ОКТ.
Обсуждение
Истончение СНВС не является специфичным для глаукомы и может быть выявлено при различных неглаукомных оптических нейропатиях.
С учетом того, что топография выявленных дефектов согласуется с топографией нервных волокон сетчатки и уровнем инициации патологического процесса, понимание закономерностей повреждений, выявленных с помощью ОКТ, позволяет предположить патогенез выявленных изменений.
Так, прямое ретроградное повреждение аксонов ганглиозных клеток сетчатки при глаукоме инициировано в головке зрительного нерва механической компрессией при колебании ВГД. Выявленные в настоящем исследовании зоны уязвимости соответствуют выводам D.C. Hood et al. [18, 19]. Дезорганизация и нарушение архитектоники решетчатой мембраны зрительного нерва при глаукоме являются признаками ее ремоделирования и приводят к истончению преламиллярной ткани при гибели аксонов [20]. Гетерогенная окраска выявленных дефектов на ранних стадиях заболевания (красные участки в центре, желтые по периферии) характеризует процесс, растянутый во времени, и определяет направление прогрессии.
Меньшая площадь ДЗН и размер экскавации рассматриваются как один из факторов риска развития НАПИОН [20–23]. Авторами доказано, что при одинаковой площади отверстия мембраны Бруха и глубине залегания решетчатой мембраны средняя толщина преламинарной ткани у пациентов с НАПИОН больше, чем в группе здоровых лиц.
Ишемический паттерн повреждения аксонов ганглиозных клеток согласуется с анатомией артериального круга Цинна — Галлера, образованного дистальными ветвями задних коротких цилиарных артерий и состоящего из нижней и верхней половин. В отличие от ГОН, капиллярная неперфузия ретроламиллярной ткани зрительного нерва индуцирует повреждение аксонов без деформации и повреждения решетчатой мембраны [24] с деколорацией ДЗН и гипертрофией глиальной ткани без формирования в большинстве случаев экскавации. Считается, что глиальные клетки устойчивы к ишемии [25, 26].
Большая площадь и монохромная окраска дефектов характеризуют одномоментную гибель большего числа аксонов и согласуются с формой и глубиной периметрических дефектов [27].
Таким образом, комплексная оценка комбинированных ОКТ-протоколов с использованием карт вероятности отклонений имеет ряд преимуществ для оценки структурных повреждений, так как карты могут быть интегрированы в одном изображении, демонстрирующем зоны уязвимости. Основное преимущество использования карт отклонения — объективная визуализация результатов количественного анализа.
Ограничением настоящего исследования является небольшой объем выборки. Для подтверждения наших выводов необходимо проведение более масштабного исследования.
Заключение
Использование карт вероятности в комбинированных протоколах анализа структурных изменений сетчатки расширяет потенциал ОКТ.
Характерная картина повреждения аксонов ганглиозных клеток сетчатки при оптической нейропатии различного генеза позволяет облегчить понимание патогенетических механизмов повреждения и дифференцировать глаукомные изменения от неглаукомных.
Простота визуализации, высокое разрешение, воспроизводимость, экономичность, наличие инструментов количественной оценки, возможность проведения обследования в амбулаторных условиях объясняют привлекательность и перспективность использования ОКТ в скрининговой диагностике оптических нейропатий различного генеза.
Сведения об авторах:
Жукова Светлана Ивановна — к.м.н., врач-офтальмолог высшей категории, заведующая диагностическим отделением Иркутского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 664033, Россия, г. Иркутск, ул. Лермонтова, д. 337; ORCID iD 0000-0002-0227-7682
Самсонов Дмитрий Юрьевич — к.м.н., врач-офтальмолог высшей категории, заведующий научно-образовательным отделом Иркутского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 664033, Россия, г. Иркутск, ул. Лермонтова, д. 337; ORCID iD 0000-0001-7971-4521
Прозорова Татьяна Владимировна — врач-офтальмолог Иркутского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 664033, Россия, г. Иркутск, ул. Лермонтова, д. 337; ORCID iD 0009-0000-5286-5784
Контактная информация: Жукова Светлана Ивановна, e-mail: zhukswetlana@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 19.12.2024.
Поступила после рецензирования 21.01.2025.
Принята в печать 13.02.2025.
About the authors:
Svetlana I. Zhukova — C. Sc. (Med.), Board-Certified Ophthalmologist, Head of the Diagnostic Department of Irkutsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 337, Lermontov str., Irkutsk, 664033, Russian Federation; ORCID iD 0000-0002-0227-7682
Dmitryi Yu. Samsonov — C. Sc. (Med.), Board-Certified Ophthalmologist, Head of the Scientific and Educational Department, Irkutsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 337, Lermontov str., Irkutsk, 664033, Russian Federation; ORCID iD 0000-0001-7971-4521
Tatyana V. Prozorova — Ophthalmologist, Irkutsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 337, Lermontov str., Irkutsk, 664033, Russian Federation; ORCID iD 0009-0000-5286-5784
Contact information: Svetlana I. Zhukova, e-mail: zhukswetlana@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 19.12.2024.
Revised 21.01.2025.
Accepted 13.02.2025.
материал rmj.ru
