Введение
Сочетание катаракты и глаукомы вызывает трудности в выборе хирургической тактики ведения пациентов. Для компенсации внутриглазного давления (ВГД) и улучшения зрительных функций применяется комбинированная операция, а также поэтапная хирургия катаракты и глаукомы [1–3]. Экстракция катаракты с гипотензивным компонентом приводит к единовременному снижению ВГД и улучшению остроты зрения [4–7]. Однако данная манипуляция требует определенных хирургических навыков, сопровождается повышенным риском интра- и послеоперационных осложнений и продолжительным реабилитационным периодом в связи со своей сложностью и длительностью комбинированной хирургии [8].
Отдельная поэтапная операция заключается в гипотензивной хирургии и экстракции катаракты у пациентов с сочетанной патологией. Многие авторы в своих работах описывают как первый этап проведение антиглаукомной операции (синустрабекулэктомия (СТЭ), непроникающая глубокая склерэктомия), второй — факоэмульсификация (ФЭ) с имплантацией интраокулярной линзы [9]. Данная тактика помимо своих положительных зрительных и гипотензивных результатов несет определенные риски в послеоперационном периоде. Проведение первым этапом антиглаукомной операции может спровоцировать набухание и помутнение хрусталика в раннем послеоперационном периоде [10]. Это происходит за счет контакта хрусталика с эндотелием роговицы при выраженной гипотонии в результате гиперфильтрации внутриглазной жидкости или при отслойке сосудистой оболочки. Воспалительный процесс, развивающийся в результате гипотензивной хирургии, приводит к формированию иридо-хрусталиковых синехий, которые препятствуют полноценному медикаментозному мидриазу во время экстракции катаракты. Также активность сформированной фистулы в углу передней камеры ведет к фильтрации сбалансированного солевого раствора (BSS-раствора) во время ФЭ в субконъюнктивальное пространство с набуханием теноновой капсулы, что мешает работе хирурга.
В литературе приводятся данные исследований в области хирургии осложненной катаракты у пациентов с оперированной глаукомой [11]. Все пациенты, которым проводилась ФЭ, имели развитую или далеко зашедшую стадии глаукомы с ранее проведенной гипотензивной хирургией (давностью от 1 мес. до 4 лет). Данный факт говорит о катарактогенном свойстве антиглаукомной операции, способствующей возникновению и прогрессированию изменений в хрусталике. Также имеются работы, в которых описывается снижение фильтрационной активности ранее проведенной антиглаукомной операции после ФЭ, что приводит к повышению ВГД [12].
На сегодняшний день в литературе описано относительно мало исследований эффективности СТЭ после ФЭ. По мнению некоторых авторов, ранее проведенная экстракция катаракты является фактором риска избыточного рубцевания фильтрационной подушки после СТЭ [13]. Данная поэтапная хирургия катаракты и глаукомы (ФЭ и СТЭ) вызвала у нас интерес и явилась предметом изучения гипотензивной и зрительных функций у этих пациентов.
Цель исследования — клинически и морфологически обосновать эффективность двухэтапной хирургии (ФЭ и СТЭ) у пациентов с осложненной катарактой и глаукомой.
Материал и методы
Клиническая часть
В наше исследование вошло 87 пациентов c осложненной катарактой и некомпенсированной глаукомой, из которых женщин — 39 (44,8%), мужчин — 48 (55,2%).
Критерии включения: наличие осложненной катаракты и некомпенсированной глаукомы, наличие письменного информированного согласия.
Критериями исключения явились случаи с выраженной нестабильностью связочного аппарата хрусталика и ригидностью зрачка, а также наличие гипотензивной хирургии в анамнезе. Подвывих хрусталика и узкий зрачок потребовали дополнительного использования интраоперационных имплантатов — крючкообразных ирисретракторов, ирисретрактора Малюгина, интракапсулярных колец, что вызывает повышенную воспалительную реакцию после операции. Отсутствие гипотензивного результата антиглаукомной операции говорит о наличии факторов повышенного рубцевания операционной зоны, что требует хирургического вмешательства с использованием дренажей.
Перед операцией все больные получали гипотензивные средства в виде неселективных и селективных β-адреноблокаторов, ингибиторов карбоангидразы, аналогов простагландинов, а также диуретический препарат на ночь перед ФЭ (при отсутствии противопоказаний со стороны других органов и систем).
Первым этапом проведена ФЭ с имплантацией интраокулярной линзы (ИОЛ) по стандартной методике. Было имплантировано 38 (43,7%) Akreos Adapt AO (Bausch&Lomb, США), 9 (10,4%) Optimed (Optimed, Россия), 6 (6,9%) «Аквамарин» («НанОптика», Россия), 17 (19,5%) Acryfold 601 (Appasamy ocular devices LTD, Индия), 5 (5,7%) Naspro NA S207 (Appasamy ocular devices LTD, Индия), 12 (13,8%) Synthesis SIPY (Cutting Edge S.A.S., Франция).
Через 14 дней после ФЭ вторым этапом проведена СТЭ по стандартной методике. Проведен паралимбальный разрез конъюнктивы Г-образной формы, основанием к лимбу выкроен поверхностный склеральный лоскут 4×4 мм на 1/3 толщины склеры. Затем отсепарован глубокий склеральный лоскут со вскрытием передней камеры и удален вместе с трабекулярной тканью, далее проведена базальная сквозная иридэктомия. Для герметизации на поверхностный склеральный лоскут наложен узловой шов нитью 10,0. Над операционной зоной удалена теноновая капсула с профилактической целью склеро-конъюнктивального рубцевания. Конъюнктива уложена на прежнее место, на нее наложены узловые швы. С целью профилактики отслойки сосудистой оболочки в 4 мм от лимба (в проекции плоской части цилиарного тела) проводилась трепанация склеры в нижне-наружном квадранте.
Биоптаты глубокого склерального лоскута, радужки (после иридэктомии) и удаленной теноновой капсулы отправлены на морфологическое исследование для определения характера воспалительного ответа тканей после экстракции катаракты.
Содержание статьи
Морфологическая часть
Взятые во время СТЭ биоптаты (склера, теноновая капсула, радужка) фиксированы в 10% растворе нейтрального формалина. После этого проводилось обезвоживание и обезжиривание в растворах спирта восходящей концентрации (50, 80, 96, 100%). Далее материалы были пропитаны смесью растворителя (ацетона) и заливочной среды (парафина) в соотношении 1:1, а затем чистой заливочной средой. После стандартной проводки из каждого фрагмента изготовлены парафиновые блоки, а из них выполнены срезы толщиной 4–6 мкм, затем получено по 5 микропрепаратов, которые окрашены гематоксилином и эозином. Затем проводилось исследование гистологических срезов с использованием микроскопа фирмы CarlZeiss и фотографической насадки Axioskop. Выполнялось по 5 микрофотографий каждого препарата.
Для количественных признаков уровня ВГД (мм рт. ст.) и остроты зрения статистическая обработка проводилась при помощи программы Statistica 10 для Windows. В данной работе переменные соответствовали закону нормального распределения и были представлены в виде М±σ.
Результаты и обсуждение
Клиническая часть
Характеристики пациентов при поступлении представлены в таблице. Из 87 больных 18 (20,7%) имели развитую и 69 (79,3%) – далеко зашедшую стадии глаукомы. Дооперационное тонометрическое давление составило 28,4±1,4 мм рт. ст., некорригированная острота зрения (НКОЗ) — 0,18±0,07 (от pr.l. certae до 0,3); максимальная корригированная острота зрения (МКОЗ) — 0,29±0,09 (от pr.l. certae до 0,6). Применение гипотензивных средств перед операцией позволило понизить ВГД до 25,1±1,3 мм рт. ст. (см. таблицу).
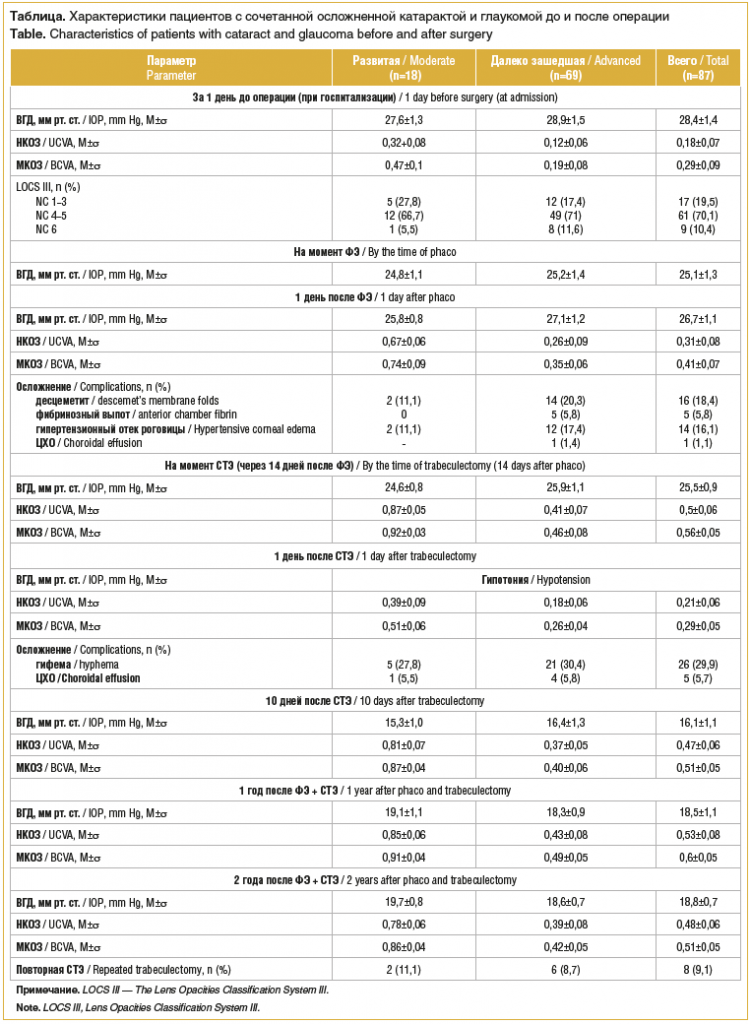
Во время первого этапа хирургии (ФЭ с имплантацией ИОЛ) было выявлено 3 (3,4%) случая злокачественной офтальмогипертензии.
В раннем послеоперационном периоде наблюдались: офтальмогипертензия с отеком роговицы, десцеметит, фибринозный выпот, а также цилиохориоидальная отслойка (ЦХО) (см. таблицу). На фоне гипотензивной и противовоспалительной терапии отек роговицы, десцеметит и фибринозный выпот окончательно разрешились к 7-му дню после ФЭ, а пациенту с ЦХО выполнена задняя трепанация склеры на 2-й день после ФЭ.
Показатели уровня ВГД, НКОЗ и МКОЗ на 14-й день послеоперационного периода представлены в таблице: к 14-му послеоперационному дню ВГД составило 25,5±0,9 мм рт. ст., НКОЗ — 0,5±0,06 и МКОЗ — 0,56±0,05.
Через 14 дней проводилась СТЭ с профилактической задней трепанацией склеры. Стоит отметить, что 63 (70,8%) пациента на момент операции длительное время принимали антикоагулянты и антиагреганты, что и послужило причиной относительно высокого процента послеоперационной гифемы — 29,9%. Профилактическая трепанация склеры снизила частоту отслойки сосудистой оболочки до 5,7% случаев.
Через 2 года наблюдения ВГД уменьшилось до 18,8±0,7 мм рт. ст., а МКОЗ увеличилась до 0,51±0,05. За этот срок из-за повышения ВГД повторная СТЭ проведена у 8 (9,2%) больных: у 2 (11,1%) пациентов с развитой и у 6 (8,7%) с далеко зашедшей стадиями.
В большинстве случаев первостепенно хирурги выбирают проведение гипотензивной хирургии у пациентов с сочетанной глаукомой и осложненной катарактой. Однако ФЭ как второй этап лечения этих больных сопровождается осложнением — повышением ВГД в ранние послеоперационные сроки.
A. Longo et al. [9] проведено исследование влияния ФЭ на состояние ВГД в различные сроки после СТЭ. Данная работа показала, что в течение первых 6 мес. после СТЭ идет формирование путей оттока внутриглазной жидкости и фильтрационной подушки. Проведение ФЭ в течение полугода после гипотензивной хирургии приводит к повышению ВГД из-за снижения активности фильтрационной зоны, что требует дополнительного назначения лекарственных средств.
В другой работе проведен анализ результата СТЭ у 248 пациентов, из которых 40 больным выполнена ФЭ в течение 2 лет после СТЭ [14]. Сравнивалась гипотензивная эффективность в течение 5 лет у пациентов после СТЭ и у больных после СТЭ с последующей ФЭ. Авторы пришли к выводу, что экстракция катаракты после гипотензивной хирургии негативно влияет на ВГД и требует дополнительного применения лекарственных средств.
В исследование D.Q. Nguyen et al. [15] вошло 2 группы больных: пациентам 1-й группы проведена ФЭ после СТЭ, пациентам 2-й группы выполнялась СТЭ не ранее 6 мес. после ФЭ. Пациентам 1-й группы потребовалась гипотензивная терапия в 39% случаев в течение первого послеоперационного года, а 2-й — в 10% случаев. Однако к концу второго года наблюдения различий между группами не было.
Приведенные данные вышеуказанных исследований демонстрируют несовершенство общепринятого двухэтапного лечения глаукомы и катаракты в следующем порядке — вначале гипотензивная хирургия, а затем ФЭ. Предложенная нами тактика ФЭ-СТЭ спустя 2 года наблюдения имеет высокие результаты: МКОЗ составила 0,51±0,05, а ВГД — 18,8±0,7 мм рт. ст. Данные показатели ВГД соответствуют уровню давления «цели» для развитой и далеко зашедшей стадий развития глаукомы. Стоит отметить, что хирургия катаракты у пациентов с глаукомой сопровождается повышенным риском интра- и послеоперационных осложнений. В работе А.А. Гинояна [11] описывается лазерная (n=69) и ультразвуковая (n=68) экстракция катаракты у пациентов с глаукомой, при которых во время операции наблюдалось капиллярное кровотечение из сосудов радужки в 18,8% (n=13) и 16,2% (n=11) случаев соответственно. В послеоперационном периоде у 23,5% (n=16) пациентов 1-й и 40% (n=26) пациентов 2-й групп наблюдалась офтальмогипертензия. Автор указывает на статистически значимое преимущество повышения ВГД у пациентов с далеко зашедшей стадией глаукомы (58%) и с неоперированной глаукомой в анамнезе (38%). Из других послеоперационных осложнений отмечалась экссудативная реакция глаза в 6 (8,8%) и 5 (7,7%) случаях соответственно, а также отек роговицы у 6 (8,8%) и 11 (16,9%) пациентов 1-й и 2-й групп. В нашем исследовании в раннем послеоперационном периоде после ФЭ наблюдались десцеметит в 18,4% случаев, фибринозный выпот — в 5,8%, гипертензионный отек роговицы — в 16,1% и ЦХО в 1,1% случаев.
Морфологическая часть
На 14-е сутки после ФЭ на биопсийное исследование были взяты фрагменты склеры, теноновой капсулы и радужной оболочки.
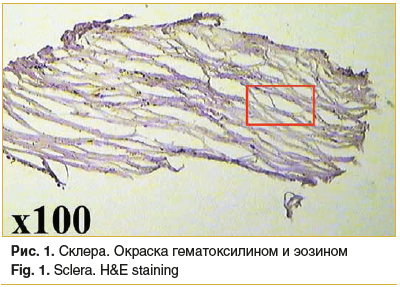
Склера: коллагеновые волокна в составе склеры упорядочены, наблюдается выраженный отек (волокна расположены на расстоянии друг от друга), воспалительных изменений не наблюдается (рис. 1, 2).
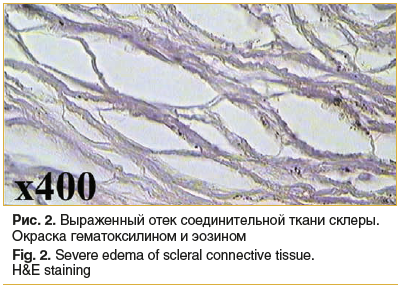
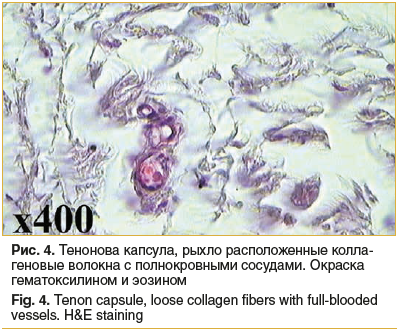
Тенонова капсула: как и в склере, в теноновой капсуле видны признаки отека и участки умеренного полнокровия, клеточной инфильтрации не наблюдается (рис. 3, 4).
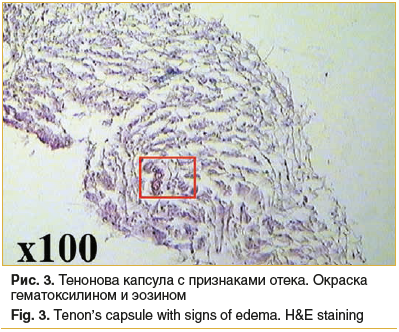
Радужка: фрагмент радужной оболочки также без выраженных изменений, с признаками отека (рис. 5, 6).
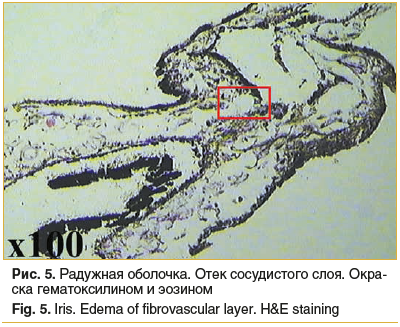
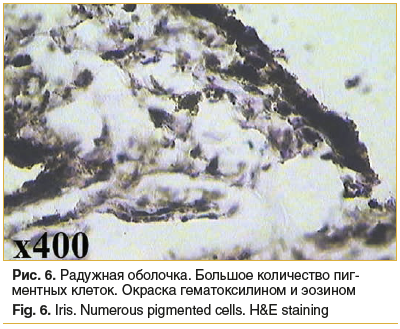
Таким образом, во всех фрагментах тканей глаза в операционной зоне происходит умеренное нарушение микроциркуляции, выражающееся в отеке тканей, приводящем к более рыхлому расположению волокон, присутствуют признаки отека и умеренное полнокровие теноновой капсулы. Повреждающий эффект операции недостаточен для того, чтобы вызвать клеточную реакцию, и, как следствие, классического течения воспалительного процесса не наблюдается.
Выводы
Проведение ФЭ с последующей СТЭ через 14 дней дает стабильный гипотензивный результат с компенсацией ВГД с 28,4±1,4 до 18,8±0,7 мм рт. ст. и улучшение зрительных функций с 0,29±0,09 до 0,51±0,05 у пациентов с поздними стадиями глаукомы в течение 2 лет наблюдения.
В раннем периоде после ФЭ в 18,4% случаев наблюдался десцеметит, в 16,1% — гипертензионный отек роговицы, в 5,8% — фибринозный выпот и в 1,1% — ЦХО. После СТЭ в 29,9% случаев наблюдалась гифема, в 5,7% — отслойка сосудистой оболочки. Все осложнения положительно разрешились на фоне консервативного или хирургического лечения.
При морфологическом исследовании склеры, теноновой капсулы и радужки, взятых во время СТЭ, выявлены признаки отека и умеренное полнокровие теноновой капсулы. Клеточных элементов, характерных для воспалительного процесса, не обнаружено. Данная картина указывает на отсутствие активного воспалительного процесса переднего отрезка глаза через 14 дней после ФЭ.
Клинически и морфологически доказана эффективность и безопасность ФЭ с последующей СТЭ через 14 дней. Предложенная операционная тактика может быть рекомендована к применению в качестве хирургического лечения пациентов с осложненной катарактой и некомпенсированной глаукомой для нормализации ВГД и улучшения зрительных функций.
Сведения об авторах:
Ивачев Евгений Александрович — к.м.н., доцент кафедры челюстно-лицевой хирургии с курсом офтальмологии и оториноларингологии ФГБОУ ВО «ПГУ»; 440026, Россия, г. Пенза, ул. Красная, д. 40; заведующий офтальмологическим отделением ЧУЗ «КБ «РЖД-Медицина» г. Пенза»; 440600, Россия, г. Пенза, ул. Урицкого, д. 118; ORCID iD 0000-0001-5662-4195.
Федорова Мария Геннадьевна — к.м.н., доцент, заведующая кафедрой морфологии Медицинского института ФГБОУ ВО «ПГУ»; 440026, Россия, г. Пенза, ул. Красная, д. 40; ORCID iD 0000-0003-4177-8460.
Контактная информация: Ивачев Евгений Александрович, e-mail: eivachov1@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.07.2023.
Поступила после рецензирования 24.07.2023.
Принята в печать 14.08.2023.
About the authors:
Evgeniy A. Ivachev — C. Sc. (Med.), associate professor of the Department of Maxillofacial Surgery with the Course of Ophthalmology and Otorhinolaryngology, Penza State University; 40, Krasnaya str., Penza, 440026, Russian Federation; Head of the Ophthalmological Department, Clinical Hospital «RZD-Meditsina» of the city of Penza; 118, Uritskiy str., Penza, 440600, Russian Federation; ORCID iD 0000-0001-5662-4195.
Mariya G. Fedorova — C. Sc. (Med.), associate professor of the Department of Morphology of the Medical Institute, Penza State University; 40, Krasnaya str., Penza, 440026, Russian Federation; ORCID iD 0000-0003-4177-8460.
Contact information: Evgeniy A. Ivachev, e-mail: eivachov1@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 03.07.2023.
Revised 24.07.2023.
Accepted 14.08.2023.
материал rmj.ru
