Введение
Аортальная регургитация (АР, недостаточность аортального клапана) характеризуется ретроградным током крови из аорты в левый желудочек. АР может развиваться вследствие врожденных аномалий аортального клапана (АК) и/или аорты, кальциноза АК, инфекционного эндокардита, миксоматозной дегенерации створок, острой ревматической лихорадки, расширения или расслоения корня аорты (с поражением АК или без такового) и др. Распространенность АР среди лиц в возрасте от 21 года до 35 лет составляет около 0,8%, причем в 40% случаев отмечается легкое течение заболевания. Частота встречаемости и тяжесть течения АР значительно увеличиваются с возрастом [1].
Независимо от клинической картины и давности заболевания у всех пациентов с диагностированным или подозреваемым поражением клапанного аппарата сердца необходимо тщательно собрать анамнез, провести физикальное и комплексное лабораторно-инструментальное обследование. При эхокардиографии (ЭхоКГ) для оценки степени тяжести АР и решения вопроса о наличии показаний к хирургическому вмешательству следует оценить следующие параметры:
морфологию клапана;
качественные характеристики АР при цветовом допплеровском картировании и постоянно-волновой допплерографии;
конечную диастолическую скорость обратного кровотока в нисходящем отделе аорты;
ширину перешейка регургитации (Vena contracta);
время полуспада градиента давления;
эффективную площадь отверстия регургитации;
объем регургитации;
конечно-диастолический размер (КДР);
конечно-систолический размер (КСР);
фракцию выброса (ФВ) левого желудочка (ЛЖ).
Наличие хотя бы одного из следующих эхокардиографических признаков свидетельствует о тяжелой АР:
молотящая створка АК;
значительное нарушение смыкания створок АК;
эксцентричный (направленный в сторону передней створки митрального клапана или в сторону межжелудочковой перегородки) или широкий (>60% выходного отдела левого желудочка) поток АР при цветовом допплеровском картировании;
плотный поток АР при постоянно-волновой допплерографии;
конечная диастолическая скорость обратного кровотока в нисходящей аорте >20 см/с;
ширина перешейка регургитации (Vena contracta >6 мм);
время полуспада градиента давления (рressure half-time) <200 мc;
эффективная площадь отверстия регургитации ≥30 мм2;
объем регургитации ≥60 мл;
дилатация ЛЖ.
Хирургическое лечение рекомендовано всем пациентам с АР, сопровождающейся значительным расширением восходящего отдела аорты, или с клинически явной тяжелой АР. Бессимптомным пациентам с тяжелой АР хирургическое лечение показано при ФВ ЛЖ ≤50%, либо КДР ЛЖ >70 мм, либо КСР ЛЖ >50 мм (рис. 1) [2].
![Рис. 1. Алгоритм ведения пациентов с АР [2] Рис. 1. Алгоритм ведения пациентов с АР [2]](https://medblog.su/wp-content/uploads/2023/06/Otdalennye-rezultaty-protezirovaniya-aortalnogo-klapana-klinicheskoe-nablyudenie-Reznik-EV.png)
В настоящее время одним из основных методов хирургического лечения пороков АК служит протезирование механическим протезом, а в случае сочетания с аневризмой корня аорты — протезирование кондуитом, содержащим клапан, по методике Bentall — De Bono [3, 4]. Однако осложнения, связанные с необходимостью приема антикоагулянтов после клапан-замещающих операций с использованием механических протезов, требуют тщательного анализа и персонализированного подхода к ведению каждого пациента. Хирургические вмешательства по замене АК целесообразны только при строгих показаниях, указанных выше [2, 5].
Тромбоз с возможным развитием тромбоэмболических осложнений — одно из самых распространенных осложнений в отдаленном периоде после протезирования клапанов сердца с использованием механических протезов. Геморрагические осложнения, возникающие на фоне проводимой антикоагулянтной терапии, — вторые по распространенности. Зачастую подобные осложнения развиваются при неправильном дозировании антикоагулянтных препаратов или отсутствии должного контроля за значениями международного нормализованного отношения (МНО) [2].
В представленном клиническом наблюдении рассмотрены причины развития осложнений после протезирования АК у молодой пациентки и возможные пути их предотвращения.
Клиническое наблюдение
В возрасте 11 лет через 2,5 нед. после перенесенного острого респираторного заболевания с субфебрильной температурой тела у пациентки развились гиперкинезы, скорость оседания эритроцитов увеличилась до 50 мм/ч, была диагностирована острая ревматическая лихорадка 3-й степени активности с малой хореей, без патологии сердца. Длительно наблюдалась у ревматолога, попытка профилактики бензатина бензилпенициллином осложнилась развитием аллергической реакции по типу крапивницы. До 30 лет чувствовала себя удовлетворительно, толерантность к физическим нагрузкам сохранялась высокой.
В 30 лет (2002 г.) пациентка была госпитализирована в связи с развитием гипертонического криза с повышением артериального давления (АД) до 230/120 мм рт. ст., сопровождавшимся рвотой и головной болью. Данные электрокардиографии (ЭКГ): синусовый ритм с частотой сердечных сокращений (ЧСС) 95 в 1 мин, отклонение электрической оси сердца влево, неполная блокада передней ветви левой ножки пучка Гиса, диффузные изменения миокарда ЛЖ. Данные трансторакальной ЭхоКГ представлены в таблице 1. Также при ЭхоКГ были отмечены толщина межжелудочковой перегородки 1,4 см, толщина задней стенки ЛЖ 1,3 см, умеренная гипертрофия ЛЖ, пролапс митрального клапана 1-й степени.
По результатам обследования рекомендованы прием атенолола 25 мг, эналаприла 5 мг, ацетилсалициловой кислоты 125 мг/сут, консультация кардиохирурга, от которой пациентка отказалась.
В 32 года (2004 г.) во время беременности на сроке 28 нед. пациентке была проведена плановая ЭхоКГ (см. табл. 1). Выявлено уплотнение створок АК, максимальная скорость кровотока на АК 180 см/с. Створки митрального клапана плотные, утолщены, подвижность сохранена, митральная регургитация 1-й степени. Правое предсердие — 3,4 см, легочная артерия — 2,2 см, максимальная скорость кровотока — 0,62 м/с. Трикуспидальный клапан не изменен. Рекомендована консультация кардиохирурга после родов. На 39 нед. беременности плановое родоразрешение путем кесарева сечения в родильном отделении общего профиля. Родился здоровый ребенок, 8,5 балла по шкале Апгар.
Через 4 мес. после родов (2004 г.) пациентке проведена ЭхоКГ (см. табл. 1). Обнаружены фиброзные изменения на створках АК, кальциноз 2-й степени, ограничение подвижности створок, фиброзное кольцо — 22 мм. Кардиохирург диагностировал аортальный порок сердца с преобладанием АР 2-й степени. Проведено хирургическое вмешательство в объеме протезирования АК механическим протезом SORIN-19 мм. Послеоперационный период протекал без особенностей. Назначена антикоагулянтная терапия аценокумаролом в дозе 2 мг под контролем показателя МНО (МНО при выписке 2,23). С 32 до 36 лет пациентка за медицинской помощью не обращалась, чувствовала себя удовлетворительно, физические нагрузки переносила хорошо, с высокой толерантностью, принимала постоянно аценокумарол, поддерживая МНО в диапазоне 2,5–3,0.
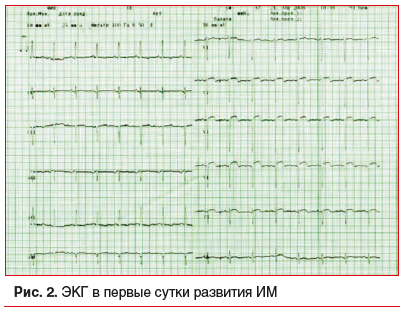
В 36 лет пациентка перешла на прием варфарина. Через 3 мес. после перехода на варфарин на фоне нестабильных значений МНО (от 0,9 до 3,5) пациентка отметила появление острых ангинозных болей за грудиной и была госпитализирована с направительным диагнозом: острый коронарный синдром. На основании изменений ЭКГ (рис. 2), повышения кардиоспецифических ферментов и тропонина I до 0,75 нг/мл (N до 0,1 нг/мл), результатов ЭхоКГ был диагностирован распространенный передний инфаркт миокарда (ИМ) с подъемом сегмента ST. Коронароангиографию не проводили ввиду отсутствия необходимого оборудования. На фоне консервативного лечения ангинозные боли не рецидивировали. Подбирали дозу варфарина (от 2,5 до 10 мг/сут), были достигнуты показатели МНО около 2,0, однако колебания МНО сохранялись, что требовало постоянной самостоятельной коррекции дозы варфарина.
Через 6 мес. после перенесенного острого ИМ госпитализирована в стационар для коррекции терапии в связи с появлением множественных подкожных гематом, одышки, слабости. Показатель МНО 5,1. Антропометрия: рост 158 см, масса тела 66 кг, индекс массы тела 26,4 кг/м2. При аускультации сердца выслушивалась мелодия работы аортального протеза, систолический шум с максимумом на аорте, проводящийся на сосуды шеи. АД 130/80 мм рт. ст. Данные ЭКГ: синусовый ритм, ЧСС 78 в 1 мин, блокада передней ветви левой ножки пучка Гиса, признаки гипертрофии ЛЖ, отрицательный зубец Т в V1–V4. Данные ЭхоКГ (2008 г.) представлены в таблице 1. Кроме того, выявлены дискинез в области верхушки, митральная регургитация 1-й степени. В аортальной позиции визуализируется механический протез с амплитудой раскрытия запирательного элемента 1,45 см. Повторная попытка подбора дозы варфарина не привела к стабилизации значений МНО. Был рекомендован прием аценокумарола (ввиду стабильных показателей МНО на протяжении нескольких лет на фоне его приема) в дозе 2 мг и достигнуто МНО 2,5.
В 38 лет госпитализирована в неврологический стационар с картиной инфаркта головного мозга в бассейне левой средней мозговой артерии с умеренным правосторонним гемипарезом, афазией. При поступлении на фоне применения аценокумарола МНО 1,3, протромбиновое время 25 с, активное частичное тромбопластиновое время (АЧТВ) 49 с. При компьютерной томографии головного мозга выявлена гиподенсивная зона ишемии в левом полушарии в височно-теменной области размером 25–30 мм. На фоне проведенного лечения состояние пациентки улучшилось: восстановилась речь, гемипарез регрессировал до пирамидного дефицита.
Вновь было решено вернуться к приему варфарина, подобрана доза, и при выписке из стационара показатель МНО был 3, протромбиновое время 83 с, АЧТВ 54 с. Однако в дальнейшем пациентка отметила продолжающиеся колебания МНО с разбросом показателей от 1,3 до 6.
С учетом нестабильных цифр МНО с высоким градиентом разброса на фоне контролируемого и мониторируемого применения варфарина пациентка направлена на консультацию к гематологу. При обследовании обнаружена мутация в гене метилентетрагидрофолатредуктазы (гетерозиготное наследование). В генах V фактора и протромбина мутаций не выявлено. Содержание гомоцистеина было 30 мкмоль/л (N 4,6–12,4 мкмоль/л), а эндотелина — 35 фмоль/л (N 0,1–1 фмоль/л), что значительно превышало референсные значения. Были снижены уровни протеина С до 40% (N 70–140%), протеина S до 48% (N 54,7–123,7%), антитромбина III до 54% (N 66–124%). Пациентке вновь рекомендован прием аценокумарола в дозе 2 мг, был достигнут стабильный целевой уровень МНО — 2,5. В 2014 г. проведена плановая коронароангиография, по данным которой окклюзионно-стенотические поражения коронарного русла отсутствовали.
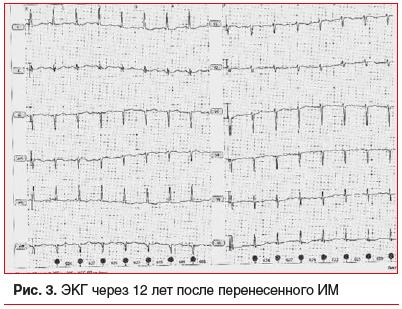
В ноябре 2020 г. в плановом порядке проведены ЭКГ (рис. 3) и трансторакальная ЭхоКГ (см. табл. 1). По данным ЭхоКГ пульсация ритмичная, амплитуда удовлетворительная, стенка аорты без изменений. Выявлен дискинез апикального сегмента межжелудочковой перегородки передней стенки ЛЖ и верхушки. Створки митрального клапана уплотнены, движутся дискордантно, раскрытие полное, включения кальция отсутствует, митральная регургитация 2-й степени, узким потоком. Трикуспидальная регургитация 1-й степени, систолическое давление в легочной артерии 25 мм рт. ст. Механический протез в аортальной позиции с пиковым/средним градиентом давления — 31,2/18,3 мм рт. ст.
В середине июля 2021 г. перенесла новую короновирусную инфекцию, осложнившуюся двусторонней нижнедолевой пневмонией с поражением не более 20% легочной ткани. Не вакцинирована.
В настоящее время пациентке 51 год, рост 158 см, масса тела 65 кг, индекс массы тела 26 кг/м2. Жалоб не предъявляет, неврологический дефицит регрессировал, ведет активный образ жизни (работает, катается на роликах с двумя детьми), принимает аценокумарол в дозе 2,5 мг/сут, показатель МНО сохраняется в диапазоне 2–3. Данные ЭхоКГ, проведенной в 2022 г., представлены в таблице 1.
Обсуждение
При использовании различных механических протезов клапанов сердца возможно развитие ряда осложнений: инфицирование клапана, тромбозы и тромбоэмболические события, кровотечения вследствие неверно подобранной антикоагулянтной терапии, дисфункция запирательных элементов протеза. Развитие любого из перечисленных осложнений может потребовать проведения повторного вмешательства и замены протеза.
Борьба с тромбозами и тромбоэмболическими осложнениями — основа стратегии ведения таких пациентов, и именно ее успешность во многом определяет прогноз. Поэтому таким пациентам показана пожизненная антикоагулянтная терапия (класс доказанности 1В) [2]. При подборе дозы перорального антикоагулянта у большинства пациентов с механическим протезом АК необходимо достигнуть целевые значения МНО, которые определяются типом протеза и совокупностью факторов риска (табл. 2) [2].
![Таблица 2. Таргетное МНО при механических клапанных протезах [2] Таблица 2. Таргетное МНО при механических клапанных протезах [2]](https://medblog.su/wp-content/uploads/2023/06/1687703917_386_Otdalennye-rezultaty-protezirovaniya-aortalnogo-klapana-klinicheskoe-nablyudenie-Reznik-EV.png)
В представленном клиническом наблюдении у пациентки был установлен механический протез SORIN-19 с заявленным производителем низким уровнем тромбогенности. Однако на фоне колебаний значений МНО (рекомендованы целевые показатели МНО 2,5–3,0) у пациентки развились тромбоэмболические осложнения: ИМ и инфаркт головного мозга.
При анализе целесообразности хирургической коррекции порока АК в представленном наблюдении очевидно, что показаний к ее проведению в соответствии с современными рекомендациями не было. Однако проведенная операция привела к необходимости назначения вынужденной пожизненной антикоагулянтной терапии у молодой пациентки и осложнениям, связанным со сложностями в подборе препаратов и дозировок [2].
Ситуация усугубилась генетической предрасположенностью к тромбофилии (мутации в гене метилентетрагидрофолатредуктазы) у пациентки, что в значительной мере осложнило достижение таргетного уровня МНО и его дальнейшую стабилизацию [6]. Мутация в гене метилентетрагидрофолатредуктазы приводит к повышению уровня гомоцистеина, что ведет к дисфункции эндотелия, увеличению содержания эндотелина и повышенной предрасположенности к тромбозам [6]. Кроме того, гомоцистеин в высоких концентрациях стимулирует агрегацию тромбоцитов и ингибирует функцию естественных антикоагулянтов, таких как антитромбин III и протеин С [7]. Высокие дозы варфарина, которые пациентка была вынуждена принимать для достижения таргетных значений МНО, в свою очередь, способствовали снижению содержания протеина С (до 40%), что повысило вероятность тромбообразования. Кроме того, снижение уровня протеина С — противопоказание к приему варфарина [8]. Аценокумарол относят к группе пероральных непрямых антикоагулянтов, но, в отличие от варфарина, его прием не приводит к снижению уровня протеина С и позволяет достигать стабильных целевых значений МНО при низких дозах. При приеме аценокумарола в нашем наблюдении отмечены стабильные значения МНО, что позволяет пациентке вести полноценную жизнь без развития новых тромбоэмболических осложнений.
Диагностика предрасположенности к тромбофилии до начала приема варфарина и проведения хирургического вмешательства на клапанном аппарате сердца (с высокой вероятностью использования в качестве имплантата механического протеза), возможно, позволила бы исключить варфарин из спектра возможных к применению антикоагулянтов либо тщательно подбирать его дозу под тщательным контролем МНО (например, с помощью домашних систем контроля), чтобы избежать значительных колебаний МНО. Этот подход, на наш взгляд, с высокой вероятностью позволил бы избежать развития тромбоэмболических осложнений на фоне приема варфарина, а на этапе выбора метода хирургической коррекции — отказаться от механического протеза клапана сердца в пользу клапансохраняющей или реконструктивной методики (например, операции Озаки), либо, учитывая отсутствие выраженных изменений гемодинамики и вероятность их восстановления по окончании беременности и послеродового периода, вообще отказаться от ее проведения.
Таким образом, угрожающие жизни тромботические осложнения у молодой пациентки с умеренной аортальной недостаточностью после протезирования АК, вероятнее всего, были обусловлены сочетанием превышения показаний к проведению хирургического вмешательства, выбора метода протезирования клапана сердца механическим протезом, отсутствием должного мониторинга МНО, неоднократной сменой антикоагулянтного препарата в ходе лечения, недооценкой возможных генетических причин тромбофилии. Несмотря на перенесенный обширный острый ИМ и ишемический инфаркт головного мозга с развитием неврологического дефицита, спустя 19 лет после перенесенной операции пациентка сохраняет приемлемое качество жизни.
Заключение
У пациентов с клапанными пороками сердца показания к хирургическому вмешательству следует определять строго в соответствии с актуальными национальными и международными клиническими рекомендациями. Следует учитывать возможность обратимости изменений показателей ЭхоКГ, развивающихся при беременности, через 3–6 мес. после родоразрешения. При выборе метода хирургического вмешательства важно учитывать преимущества клапан-сохраняющих реконструктивно-пластических вмешательств на клапанном аппарате сердца (в том числе аортальном клапане), включающих в себя как открытые (особенно у пациентов молодого возраста), так и рентгенэндоваскулярные вмешательства с применением биологических протезов или материалов (главным образом, у пациентов пожилого возраста и пациентов из групп высоких периоперационных рисков). При определении режима антикоагулянтной терапии после протезирования клапанов сердца необходимо своевременно диагностировать/исключать тромбофилические состояния и вести указанных пациентов мультидисциплинарной командой, включающей кардиохирурга, кардиолога и гематолога. Список литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru
