Введение
Коронарные артерии, в норме располагающиеся на поверхности эпикарда, на определенном участке могут «погружаться» в миокард и «появляться» из него («ныряющие» или «туннельные» артерии). Мышца, прикрывающая венечную артерию, получила название «миокардиальный мостик» (ММ) [1]. В зависимости от метода диагностики ММ распространенность в популяции варьирует [2]. По данным коронароангиографии (КАГ) встречаемость аномалии составляет 1,5–16%, а при использовании провокационных тестов во время проведения КАГ из-за сдавливания коронарной артерии в систолу выявляется еще у 40%. По данным аутопсии встречаемость ММ превышает 80% [3].
По данным литературы, ММ могут потенцировать развитие атеросклероза в коронарных артериях. Сдавление коронарной артерии ММ в систолу приводит к изменению ламинарного тока крови на турбулентный и даже ретроградный в проксимальной ее части. Данное изменение кровотока сопровождается снижением касательной силы, возникающей в результате воздействия потока движущейся крови на поверхность эндотелия, и характеризуется таким показателем, как пристеночное напряжение сдвига (ПНС) [4, 5]. Считается, что участок артериальной стенки, подверженный воздействию низкого ПНС, имеет эндотелиальные клетки плоской и многоугольной формы, обладает повышенной проницаемостью эндотелия и, следовательно, повышенным риском инфильтрации клеток, а также характеризуется эндотелиальной дисфункцией [3]. Это проявляется снижением образования таких атеропротективных и антитромботические агентов, как оксид азота (NO) и простациклин, которые вызывают вазодилатацию, снижают адгезию моноцитов к эндотелию и агрегацию тромбоцитов. Данная структурная и эндотелиальная дисфункция приводит к развитию атеросклероза в пораженном участке артерии, а также характеризуется повышенной спастической реакцией на различные раздражители. Поэтому в проксимальной части коронарной артерии пациентов с ММ, где выявляется низкое ПНС, отмечается формирование атеросклеротических бляшек чаще, чем в остальных ее участках [4–6].
В области самого ММ выявляется истончение стенки сосуда, интима состоит в основном из гладкомышечных клеток сократительного типа и интерстициального спиралевидного коллагена. Отмечается повышение ПНС, что рассматривается как защитный механизм от формирования атеросклеротической бляшки в этой области. В то же время многочисленные исследования говорят о повышенной вазоспастической реакции туннелированной области коронарного сосуда. Спазм может выявляться не только в области ММ, но и в проксимальном и дистальном отделах коронарной артерий. Описывают случаи развития тромбоза в различных областях туннелированных коронарных артерий [6–9].
Клиническими проявлениями изолированных ММ могут быть стенокардия, аритмии, а также развитие диссекции коронарных артерий, инфаркты миокарда (ИМ) и внезапная сердечная смерть [3, 7, 10, 11].
Чаще всего при жизни ММ остаются недиагностированными. Для выявления аномального расположения коронарной артерии оптимальным методом является КАГ, в ходе которой отмечается типичный эффект «доения» («milking effect») — феномен, обусловленный компрессией в систолу туннелированного сегмента коронарной артерии и характеризующийся ее систолическим сужением и полным или частичным диастолическим расправлением. Также наблюдается другой феномен — эффект «ступеньки» («step up — step down»), заключающийся в двухфазном «пошаговом» заполнении контрастным веществом «ныряющей» артерии [12]. Другим эффективным методом диагностики ММ является мультиспиральная компьютерная томография (МСКТ), которая позволяет выяснить протяженность и глубину залегания туннелированного сегмента коронарной артерии, а также диаметр и уровень компрессии в систолу и диастолу [1, 3]. Самым информативным методом является внутрисосудистое ультразвуковое исследование (ВСУЗИ) в сочетании с допплерофлоуметрией, которое выявляет феномен «кончика пальца» — удлинение времени нарастания скорости диастолического кровотока; феномен «полумесяца» (ореола) — поперечную площадь ММ, которая изменяется на протяжении систолы и диастолы [12]. Оптическая когерентная томография, принцип действия которой основан на световой интерферометрии с разрешающей способностью 10–15 мкм, позволяет увидеть в диастолу неоднородную низкой интенсивности веретенообразную сферу с четко очерченными границами, указывающую на проходящую через миокард туннельную артерию, напоминающую феномен «полумесяца», выявляемый при ВСУЗИ, которая непосредственно представляет миокард, окружающий артерию. Тяжесть систолической компрессии ММ связана с изменением размера веретенообразной сферы. При увеличении компрессии размеры сферы уменьшаются, и наоборот. Также данный метод позволяет выявить атеросклеротические бляшки в проксимальной области коронарной артерии, истончение стенки артерии и отсутствие vasa vasorum адвентиции в области ММ [13, 14].
При ангиографически подтвержденных и клинически значимых ММ лечение начинается с медикаментозной терапии β-блокаторами, блокаторами кальциевых каналов и антитромбоцитарными препаратами. При безуспешности консервативного подхода, ишемии миокарда, доказанной инструментально, систолической компрессии коронарной артерии более 75% применяется стентирование туннелированного сегмента или открытые хирургические вмешательства, такие как аортокоронарное шунтирование или супраартериальная миотомия [1].
Представляем клиническое наблюдение пациента с ИМ и ММ в инфаркт-зависимой артерии.
Клиническое наблюдение
Пациент С., 56 лет, поступил в отделение реанимации и интенсивной терапии ГБУЗ «ГКБ им. С.С. Юдина ДЗМ» по скорой медицинской помощи (СМП) из поликлиники, предъявляя жалобы на жгучие боли за грудиной, выраженную слабость.
Анамнез заболевания: с 2015 г. пациент периодически отмечал повышение артериального давления (АД) до 160/100 мм рт. ст. при привычных цифрах АД 125/80 мм рт. ст. Регулярно гипотензивную терапию не принимал. 14.01.2020 в 05:00 у пациента впервые в жизни развились интенсивные жгучие боли за грудиной, которые он расценил как изжогу, терпел и безуспешно пытался купировать смектой. Вечером того же дня появилась слабость. Боли за грудиной продолжались в течение 2 сут. 16.01.2020 утром жгучие боли за грудиной усилились, сохранялась выраженная слабость, в связи чем в пациент обратился в поликлинику ФБУЗ «Лечебно-реабилитационный центр» Минэкономразвития России. Был осмотрен терапевтом, снята ЭКГ, на которой были выявлены изменения. С направительным диагнозом: ОКС с подъемом сегмента ST по СМП госпитализирован в отделение реанимации и интенсивной терапии ГБУЗ «ГКБ им. С.С. Юдина ДЗМ».
Анамнез жизни: употребление алкогольных напитков и наркотиков отрицает. Курение на протяжении 33 лет по 5 сигарет в день (индекс курильщика — 8,25 пачка/лет). Редкие острые респираторные вирусные инфекции. Поллиноз в весенне-летний период. Семейный анамнез по сердечно-сосудистым заболеваниям отягощен: гипертоническая болезнь у матери. Работает инженером. Профессиональных вредностей не имел.
Результаты физикального обследования при поступлении. Состояние тяжелое. Сознание ясное. Кожные покровы обычного цвета. Пастозность нижних конечностей. Дыхание ровное, ритмичное, ЧДД 22 в 1 мин. При аускультации дыхание везикулярное усиленное, хрипов нет. Границы сердца расширены влево. Тоны сердца приглушены, ритмичны. Сердечные шумы не выслушиваются. АД 160/100 мм рт. ст., ЧСС 95 в 1 мин. Живот симметричный, мягкий, безболезненный. Печень не увеличена, не пальпируется. Стул оформленный, регулярный, обычного цвета и консистенции. Мочеиспускание свободное, произвольное.
Данные ЭКГ амбулаторные (16.01.2020 в 11:52; рис. 1A): ритм синусовый, правильный, ЧСС 84 в 1 мин. ЭОС отклонена влево. Остроконечный и увеличенный по амплитуде до 4 мм зубец P в отведениях II, III, aVF. Подъем сегмента ST до 3–4 мм в отведениях I, aVL, V1–V4. Заключение: острая перегрузка правого предсердия. Острая стадия переднеперегородочного с переходом на верхушку ИМ левого желудочка (ЛЖ).

Данные ЭКГ при поступлении (16.01.2020 в 13:22; рис. 1B): ритм синусовый, правильный, ЧСС 95 в 1 мин. ЭОС отклонена влево. Подъем сегмента ST в отведениях I, aVL, V2–V3. Заключение: отсутствуют признаки острой перегрузки правого предсердия. Острая стадия переднеперегородочного ИМ ЛЖ.
Данные ЭКГ при выписке (25.01.2020; рис. 1C): ритм синусовый, правильный, ЧСС 78 в 1 мин. Электрическая ось сердца отклонена влево. Сохраняется незначительный подъем ST с уменьшением амплитуды зубца Т в I, aVL, V2, V3. Заключение: замедленная динамика переднеперегородочного ИМ ЛЖ.
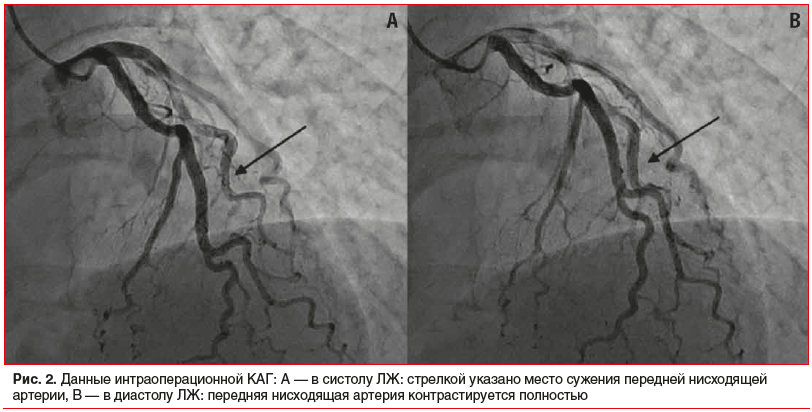
Данные КАГ (16.01.2020; рис. 2): тип кровоснабжения сердца правый. Ствол левой коронарной артерии обычно развит, неровности контуров. Передняя нисходящая артерия — неровности контуров, в среднем сегменте — гемодинамически незначимый миокардиальный мостик (<50% стеноза). В диагональной ветви — неровности контуров, без гемодинамически значимых стенозов. Огибающая ветвь — неровности контуров, без гемодинамически значимых стенозов. Ветвь тупого края — неровности контуров, без гемодинамически значимых стенозов. Правая коронарная артерия — неровности контуров, без гемодинамически значимых стенозов.
После удаления интродьюсера наложена давящая повязка, пациент переведен в отделение реанимации и интенсивной терапии.
Данные ЭхоКГ в В- и М-режимах с допплеровским анализом (17.01.2020): аорта не изменена, размер 3,5 см. Форма раскрытия аортального клапана правильная, размер раскрытия 2,2 см. Подвижность створок не ограничена, клапан не изменен. Митральный клапан уплотнен, движения створок разнонаправленные. Трикуспидальный клапан и клапан легочной артерии не изменены. Левое предсердие 4,0×4,9 см (норма <4,4×4,8 см), правое предсердие 3,5×4,6 см (норма <4,4×4,8 см). Правый желудочек: переднезадний размер 2,5 см (норма 2,1–3,5 см). Межжелудочковая перегородка (МЖП) 1,2 см (норма 0,6–1,0 см). Задняя стенка ЛЖ 1,2 см (норма 0,6–1,0 см). ЛЖ: конечный диастолический размер 5,0 см (норма у мужчин 4,2–5,8 см), конечный систолический размер 3,5 см (норма у мужчин 3,1–4,3 см). Фракция выброса ЛЖ 55%. Асинхронное движение МЖП и незначительный гипокинез ее верхушечной трети. Разделения листков перикарда нет. Нижняя полая вена коллабирует >50%. Допплеровский анализ: аортальный клапан — не выявлено регургитации, митральный клапан, трикуспидальный клапан — регургитация 1-й степени. Систолическое давление в легочной артерии — 27 мм рт. ст. Клапан легочной артерии: 1-я степень регургитации.
Заключение: камеры сердца не увеличены. Умеренная гипертрофия миокарда ЛЖ. Асинхронное движение МЖП и незначительный гипокинез ее верхушечной трети. Глобальная сократимость миокарда ЛЖ удовлетворительная. Диастолическая дисфункция ЛЖ 1-го типа. Недостаточность митрального клапана 1-й степени, недостаточность трикуспидального клапана 1-й степени, недостаточность клапана легочной артерии 1-й степени.
Данные рентгенографии органов грудной клетки в прямой проекции стоя (19.01.2020): очагово-инфильтративной патологии не определяется. Легочные поля воздушные. Легочный рисунок не усилен и не деформирован. Корни легких не расширены, структурные. Тень средостения не смещена. Тень сердца не расширена. Диафрагма с четкими и ровными контурами. Наружный синус затемнен, с четким верхним уровнем. Возможно наличие небольшого количества жидкости в плевральной полости справа.
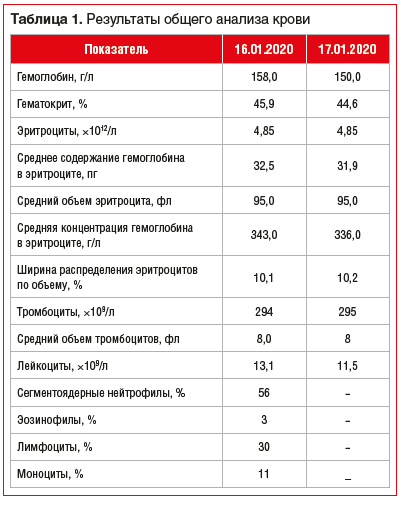
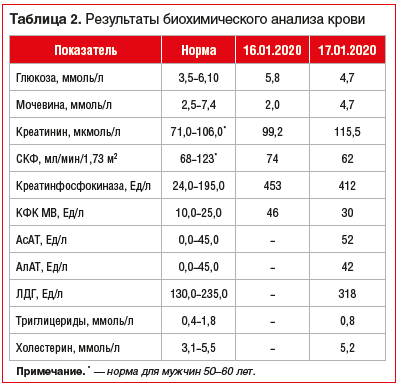
Результаты лабораторных методов исследования в динамике наблюдения представлены в таблицах 1, 2.
Общий анализ мочи (17.01.2020): цвет желтый, прозрачность неполная, относительная плотность 1,015 г/л, pH мочи 8,0 Ед, уробилиноиды 1,6 мкмоль/л, белок мочи 0,3 г/л, реакция на кровь 10 количество/мкл; глюкоза мочи, кетоновые тела, билирубин мочи, лейкоциты, нитриты — не обнаружены.
Коагулограмма (16.01.2020): фибриноген 2,69 г/л (норма 2,0–4,0), D-димер 240 нг/мл (норма <250), МНО 0,99 (норма 0,8–1,3), протромбиновое время 14,4 с (норма 12,0–17,0), протромбиновый тест по Квику 105% (норма 70–120).
Кардиоспецифические ферменты: тропонин I: 16.01.2020 — 5,22 нг/мл, 17.01.2020 — 4,67 нг/мл (норма <0,200).
На основании типичной клинической картины ИМ в виде интенсивных жгучих болей за грудиной длительностью до 2 сут; характерных данных ЭКГ: подъема сегмента ST в отведениях I, aVL, V1–V3 с замедленной динамикой; повышения уровня кардиоспецифических ферментов — тропонина I до 5,22 нг/мл; выявленных при ЭхоКГ асинхронного движения МЖП и незначительного гипокинеза ее верхушечной трети; данных КАГ об отсутствии признаков обструкции коронарных артерий и наличия ММ в среднем сегменте передней нисходящей артерии был выставлен клинический диагноз: основное заболевание: ИБС. Трансмуральный переднеперегородочный с переходом на верхушку инфаркт миокарда левого желудочка с подъемом сегмента ST от 14.01.2020. Гемодинамически незначимый ММ среднего сегмента передней нисходящей артерии (стеноз <50%) по данным КАГ от 16.01.2020. Фоновый: гипертоническая болезнь, 2-я степень, III стадия, риск 4. Осложнение основного заболевания: острая аневризма межжелудочковой перегородки левого желудочка. Хроническая болезнь почек C2А2 по классификации KDIGO. Сопутствующие заболевания: поллиноз.
Лечение. Ввиду отсутствия окклюзии коронарных артерий и выявления ММ, провоцирующего вазоспазм, чрескожное коронарное вмешательство не проводилось. Медикаментозная терапия с 16.01.2020 по 25.01.2020: эналаприл 5 мг 2 р/сут утром и вечером, амлодипин 2,5 мг утром, аторвастатин 40 мг вечером, ацетилсалициловая кислота 100 мг вечером, тикагрелор 90 мг утром и вечером, омепразол 20 мг 2 р/сут.
Обсуждение
В представленном наблюдении у пациента выявлены следующие факторы риска ИБС: мужской пол, возраст 56 лет, наличие повышения АД и отягощенная наследственность по ССЗ.
Больной курит на протяжении 33 лет по 5 сигарет в день; индекс курильщика — 8 пачка/лет, который формально не является значимым для развития ИБС, но, возможно, способствует эндотелиальной дисфункции и повышению чувствительности коронарных сосудов к спастическим влияниям [15].
При КАГ не было выявлено атеросклеротических изменений и тромботической обструкции коронарной артерии, которые служат причиной развития ИМ с окклюзией коронарной артерии, но был обнаружен изолированный ММ в среднем сегменте передней нисходящей артерии. Эта артерия кровоснабжает переднеперегородочную область ЛЖ, где и произошел ИМ. При отсутствии признаков острой коронарной окклюзии наличие ММ в инфаркт-зависимой артерии может рассматриваться как одна из вероятных причин развития переднеперегородочного ИМ ЛЖ. С учетом того, что ММ (<50% стеноза) по данным КАГ расценивался как гемодинамически незначимый, необходимо рассмотреть другие патогенетические механизмы ИМ.
По данным литературы, в проксимальной части коронарной артерии на фоне низкого ПНС у пациентов с ММ отмечается развитие эндотелиальной дисфункции, которая в большинстве случаев сопровождается развитием эпикардиальной дисфункции и клинически проявляется вазоспазмом. Длительное курение табака пациентом могло способствовать развитию более выраженной эндотелиальной дисфункции, снижению выработки оксида азота (NO) и потенцировать развитие спазма коронарных артерий, вероятнее всего, в проксимальной части [5, 7, 16].
Механизм ишемии при ММ сложен и заключается в нарушении тока крови как в систолу, так и в диастолу. В норме лишь 15% коронарного кровотока наблюдается в систолу, поэтому более значимыми являются изменения в диастолу. Характерные проявления диастолических нарушений при ММ в коронарной артерии — частичное диастолическое расправление, удлинение времени нарастания скорости диастолического кровотока, снижение диастолического потока и диастолического коронарного резерва [3, 12].
При поступлении пациента в больницу отмечено повышение АД до 160/100 мм рт. ст. и ЧСС. Это могло быть как ответом на ишемию, болевой синдром, так и фактором, способствовавшим ишемии миокарда. Подъем АД сопровождается повышением тонуса коронарных сосудов, нарушением диастолического расслабления, увеличением нагрузки на миокард и потребности миокарда в кислороде. Данные изменения на фоне ММ могли привести к значительной ишемии миокарда.
На первой ЭКГ пациента на фоне развития болевого синдрома ЧСС составила 84 в 1 мин, что расценивается как норма. При поступлении ЧСС 95 в 1 мин. Известно, что увеличение ЧСС сопровождается укорочением диастолы, нарушением релаксации желудочков, а при ММ приводит к еще большему снижению основного диастолического потока и диастолического коронарного резерва потока. В итоге сочетание повышения АД и ЧСС со спазмом коронарной артерии могло привести к длительной ишемии, а затем к некрозу миокарда. Клинически это проявилось затяжным, около 2 сут, болевым синдромом и развитием трансмурального с аневризмой ИМ ЛЖ. В патогенезе ИМ у данного пациента, особенно вначале, полностью нельзя исключить образование нестойкого тромба [2, 11, 17].
Заключение
Особый клинический интерес данного наблюдения заключается в том, что у пациента с гемодинамически незначимым (<50% стеноз) ММ при отсутствии атеросклеротического и тромботического поражения коронарных артерий развился инфаркт миокарда без окклюзии коронарных артерий (ИМБОКА), чему, вероятнее всего, способствовал ишемический потенциал ММ в сочетании с факторами риска ИБС и ИМ. В связи с этим наличие ММ может быть рассмотрено как фактор риска развития ИМБОКА. Это свидетельствует о необходимости наблюдения за пациентами с ММ и модификации факторов риска развития ИБС.
Существует противоречие между данными различных исследований, показывающих, что наличие ММ не приводило к увеличению риска ИМ, и значительным количеством клинических случаев ИМБОКА у пациентов с ММ, что требует дальнейшего изучения аномалии и прояснения патогенетических механизмов ИМ у данной группы пациентов [10, 11, 18, 19].
Информация с rmj.ru






