Введение
Борьба с новой коронавирусной инфекцией COVID-19 не теряет своей актуальности. Для этого заболевания характерно развитие вирусной атипичной пневмонии с вовлечением в воспалительный процесс бронхиол, альвеол, мельчайших сосудов. В результате этого сильно страдает газообмен легких, в кровь поступает меньше кислорода, что приводит к возникновению гипоксии и отрицательно сказывается на работе всего организма. Кроме того, при поражении легких вирусом SARS-CoV-2 наблюдается нарушение синтеза сурфактанта, что может способствовать образованию необратимых изменений в легочной паренхиме, в том числе рубцовой ткани, т. е. развитию фиброза [1–4].
В настоящее время краткосрочные результаты компьютерной томографии (КТ) после перенесенной новой коронавирусной инфекции в значительной степени описаны [5–8]. Известно, что при выписке из отделения реанимации и интенсивной терапии (ОРИТ) у 94% пациентов сохраняются изменения в паренхиме легких, преимущественно в виде остаточного «матового стекла». По данным зарубежных и отечественных исследователей, через 6 мес. после выздоровления у 35–48% пациентов и через 12 мес. у 24–27% пациентов наблюдались изменения в легких, такие как остаточное «матовое стекло», участки консолидации, паренхиматозные тяжи, перилобулярные затемнения, тракционные бронхо- и бронхиолоэктазы, фиброзоподобные изменения (включая ретикуляцию, утолщение междольковых перегородок, соты), неравномерность вентиляции / воздушные ловушки, мозаичная перфузия [1, 9–12]. При этом остается неясным, насколько обратимы эти изменения и есть ли возможность их дальнейшего прогнозирования.
Также необходимо учитывать тот факт, что пациенты, перенесшие новую коронавирусную инфекцию в тяжелой форме, находятся под наблюдением врачей длительное время и продолжают обследоваться, а пациенты, лечившиеся амбулаторно, как правило, не проходят расширенное лучевое обследование легких. При этом у некоторых из них более 1 года после болезни сохраняется утомляемость, одышка, головная, мышечная и суставная боль [2, 13].
После завершения эпидемий атипичной пневмонии, вызванных вирусом гриппа А/Н1N1 и SARS-CoV, при долгосрочном обследовании у примерно 4% пациентов выявлялись остаточные изменения в легких в виде участков локального и мультифокального фиброза, участков консолидации, тракционных бронхоэктазов, уплотнений междолькового интерстиция, изменений по типу «сот» [14, 15]. В связи с тем, что нуклеокапсидный белок SARS-CoV-2 более чем на 90% аналогичен белку SARS-CoV-1 [16], можно предполагать, что подобные последствия будут наблюдаться и после эпидемии новой коронавирусной инфекции. С учетом того, что количество учтенных переболевших COVID-19 в нашей стране приближается к 2 млн человек, это может стать огромной нагрузкой для системы здравоохранения. В настоящий момент информации о клинико-лучевых предикторах изменений в легких у пациентов, перенесших пневмонию, вызванную вирусом SARS-CoV-2, и об их долгосрочных последствиях, крайне мало [17].
Цель работы: определить последствия пневмонии, вызванной вирусом SARS-CoV-2, у пациентов, перенесших новую коронавирусную инфекцию в период 2020–2021 гг., оценить возможные клинико-лучевые предикторы этих изменений и их обратимость.
Содержание статьи
Материал и методы
В нашей работе были проанализированы результаты лучевых исследований, выполненных 68 пациентам (21 мужчина, 47 женщин, средний возраст 68,7±15,4 года), переболевшим новой коронавирусной инфекцией в период 2020–2021 гг. и направленным на обследование из клиник ПСПбГМУ им. И.П. Павлова и поликлиник г. Санкт-Петербурга и Ленинградской области для оценки изменений кровообращения в легких и выявления осложнений заболевания.
Критерии включения в работу: пациенты, более 1 года назад переболевшие инфекцией, вызванной вирусом SARS-CoV-2, подтвержденной представленной медицинской документацией, и предъявляющие жалобы на сохраняющуюся одышку, слабость, невозможность выполнения трудовой деятельности в полном объеме. По данным мультиспиральной компьютерной томографии (МСКТ) об объеме первичного поражения легочной паренхимы пациенты были разделены на 2 группы: КТ I–II — 30 человек, КТ III–IV — 38 человек.
Критерии исключения: нахождение на искусственной вентиляции легких в период острого заболевания, хронические заболевания легких, застойная сердечная недостаточность, возраст моложе 18 лет, тяжелая печеночная и почечная недостаточность, злокачественные новообразования.
У всех пациентов оценивались результаты комплексного лучевого исследования — МСКТ, однофотонной эмиссионной компьютерной томографии (ОФЭКТ), а также спирометрии и определения диффузионной способности легких по монооксиду углерода (DLCO). Был проведен анализ результатов исследований, выполненных через 6 мес., 9 мес., 1 год и более (до 2 лет) от начала заболевания. Диагностика с помощью лучевых методов проводилась по назначению лечащего врача и в соответствии с приказом Министерства здравоохранения РФ от 09.06.2020 № 560н «Об утверждении Правил проведения рентгенологических исследований», с подписанием пациентом или его представителем информированного согласия на проведение исследования. ОФЭКТ легких выполнялась на 2-детекторной гамма-камере Philips Forte 2005 (USA) по стандартной программе Lung Spect. КТ-исследования легких пациентов в ПСПбГМУ им. И.П. Павлова проводились на 16- и 64-срезовых томографах фирмы GE по стандартной методике, с использованием программы высокого разрешения.
Основной задачей радиологического исследования (ОФЭКТ легких) у пациентов являлось выявление степени изменений микроциркуляции (МЦ) после коронавирусной инфекции с использованием программы искусственного интеллекта (анализатор изображений перфузионной сцинтиграфии легких (LungScintAnalyser)) [18]. Был выполнен количественный расчет изменений МЦ. С помощью цветовой шкалы оценивали интенсивность накопления γ-квантов радиофармпрепарата на сцинтиграмме при удалении от нормальных значений: снижение отмечалось синим цветом, а повышение — красным. Границы нормальных значений находились в пределах от 0,85 до 1,15, гипоперфузии соответствовали значения от 0,3 до 0,7, гиперперфузии — от 1,3 и выше. Значения меньше 0,3 расценивались как дефект накопления.
Для оценки точного процента поражения легочной ткани и степени распространенности процесса выполнялась МСКТ с использованием программы искусственного интеллекта «маски плотности».
Статистический анализ. Обработка результатов исследования проводилась с использованием программы Statistica 10. Характеристики обследованных групп были проанализированы методами описательной статистики и представлены как среднее арифметическое выборки — М, ошибка среднего — m. Анализ взаимосвязей между показателями проводили с использованием коэффициента ранговой корреляции Спирмена (rs), при rs>0,7 связь оценивалась как сильная, при rs от 0,3 до 0,7 — средней силы и как слабая при rs<0,3.
Результаты исследования
У 19 пациентов, перенесших COVID-19 в легкой и среднетяжелой форме, при анализе результатов спирометрии на момент выполнения ОФЭКТ было выявлено только значительное снижение проходимости мелких бронхов. Максимальная объемная скорость при выдохе 75% ФЖЕЛ (МОС75) составила 39,2±4,5%Д, что коррелировало в высокой степени (rs>0,92) с изменениями МЦ в верхних отделах легких. Нарушения МЦ с накоплением радиофармпрепарата (РФП) <0,5 (50%) от нормы коррелировали в высокой степени с зонами мозаичной перфузии (rs>0,77), воздушными ловушками (rs>0,89). Нарушения МЦ с накоплением РФП <0,3 (30%) от нормы коррелировали в высокой степени с бронхиолоэктазами (rs>0,64), выявляемыми при выполнении МСКТ.
У 11 пациентов выявлены смешанные нарушения бронхиальной проходимости (снижение проходимости мелких бронхов МОС75 до 46,8±3,6%Д и DLCO до 62,4±3,1%Д). По данным ОФЭКТ легких определялось не только снижение МЦ в верхних отделах легких, но и локальные дефекты перфузии субсегментарного уровня. При сопоставлении результатов ОФЭКТ и МСКТ отмечена высокая корреляция изменений перфузии в верхних долях легких с наличием локальных участков вздутия (rs>0,84), утолщением стенок мелких бронхов (rs>0,87). Выявленные локальные участки гипоперфузии (<30% от нормы) соответствовали зонам локального пневмосклероза (rs>0,93).
Пациентам, перенесшим новую коронавирусную инфекцию в тяжелой форме, проводилось МСКТ-исследование в динамике. После выписки из стационара через 3–6 мес. у всех пациентов сохранялись изменения в паренхиме легких. Чаще всего определялись изменения по типу «матового стекла» (94%), уплотнение междолькового интерстиция по типу неспецифической интерстициальной пневмонии, обычной интерстициальной пневмонии (ОИП) небольшой протяженности (41%), зоны консолидации (32%), остаточные проявления поражения крупных и мелких бронхов (тракция, тракционные бронхоэктазы, бронхиолоэктазы, признаки облитерирующего бронхиолита) (29%), остаточные сосудистые изменения (мозаичная перфузия легочной ткани, формирование легочной гипертензии (ЛГ) (16%). При поступлении на лучевое обследование через 1 год и более после выздоровления у 5 (13%) пациентов по данным МСКТ отмечались только единичные участки «матового стекла», у 14 (34%) выявлена мозаичность вентиляции и воздушные ловушки, что сопровождалось снижением проходимости мелких бронхов МОС75 до 37,4±3,7%Д. У остальных 20 пациентов выявляли уплотнение междолькового интерстиция по типу ОИП небольшой протяженности (65%), зоны консолидации (34%), зоны пневмосклероза разной протяженности (54%), дисковидные ателектазы (31%), бронхоэктазы (26%), признаки облитерирующего бронхиолита (42%), формирование ЛГ (38%). У пациентов было отмечено значимое снижение DLCO до 52,4±2,2%Д. При проведении ОФЭКТ легких были выявлены значительные нарушения МЦ, причем эти изменения были количественно (в %) больше, чем при МСКТ (рис. 1). При КТ-обследовании пациентов в динамике через 1–1,5 года с использованием программы «маска плотности» прирост изменений в паренхиме легких составил 16,3±2,4%. Выявлена высокая корреляционная зависимость (rs>0,98) между изменениями перфузии с накоплением РФП <0,5 (50%) от нормы, с последующим развитием в этих участках необратимых изменений.
Представляем собственное клиническое наблюдение пациента Г., 57 лет, с диагнозом «Вирус-ассоциированное интерстициальное заболевание легких (ИЗЛ)». Показаны данные МСКТ в динамике (см. рис. 1), результаты оценки МЦ (рис. 2) и обработки МСКТ с помощью программы искусственного интеллекта (рис. 3). В этом клиническом наблюдении можно проследить влияние микроциркуляторных изменений на динамику изменений в паренхиме легких при сопоставлении данных ОФЭКТ и КТ органов грудной полости (ОГП).
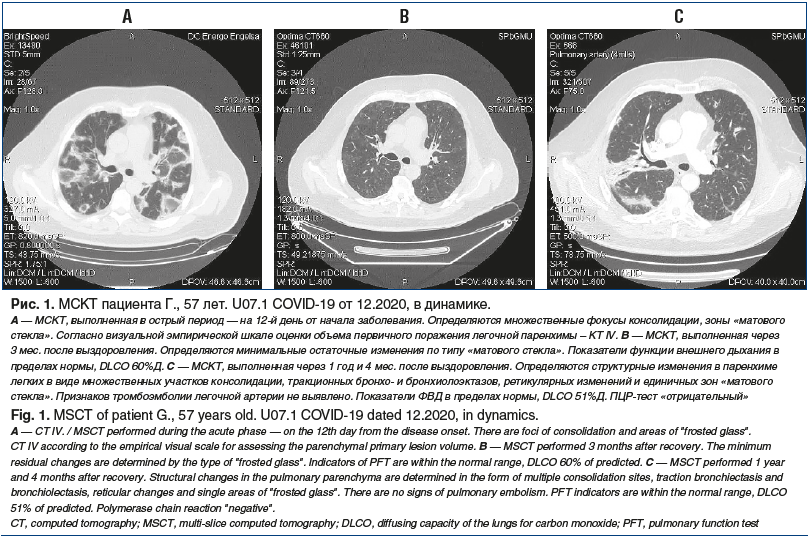
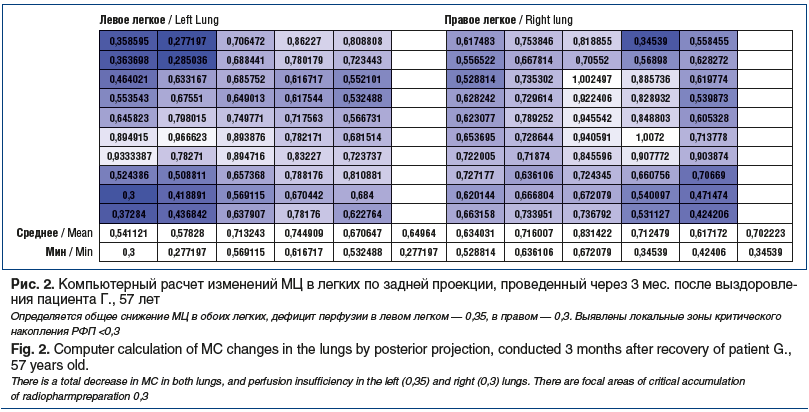
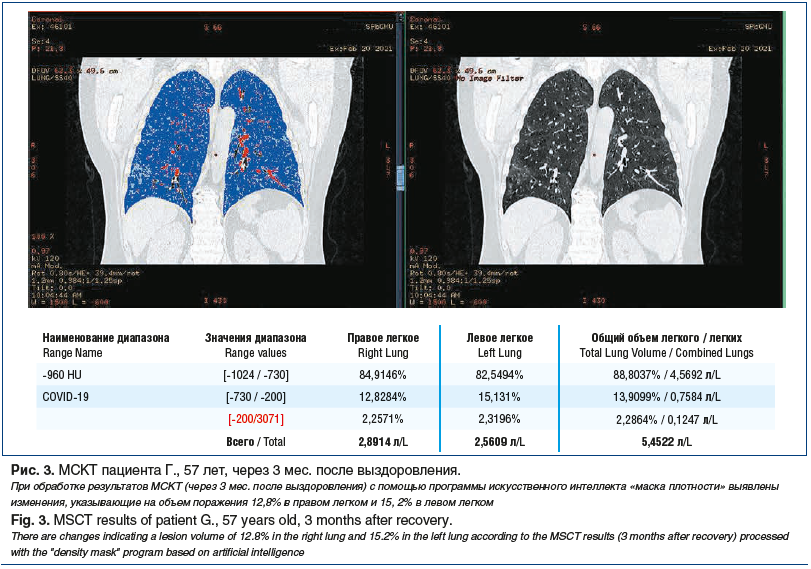
При анализе результатов ОФЭКТ получены данные, указывающие, что нарушения МЦ являются предиктором структурных изменений, возникающих в паренхиме легких.
Обсуждение
Исследование продемонстрировало, что у пациентов, перенесших пневмонию, вызванную вирусом SARS-CoV-2, с сохраняющимися более 1 года жалобами на одышку, снижение работоспособности и быструю утомляемость, определялось нарушение проходимости мелких бронхов на уровне малых дыхательных путей, что свидетельствовало о поражении респираторной зоны и развитии интерстициальной патологии легких (значительное снижение диффузионной способности). По данным комплексного лучевого исследования (ОФЭКТ и МСКТ) у всех пациентов в той или иной мере определялись структурные изменения в паренхиме легких и нарушения МЦ. К сожалению, на момент написания статьи нам не встретились работы по изучению изменений кровообращения в легких у пациентов через 1 год и более постковидного периода, а также сопоставление этих данных с результатами МСКТ, спирометрии и DLCO. В опубликованных работах [19–21] отмечено сохранение тяжелой дыхательной недостаточности более 6 мес. после выписки пациентов, госпитализированных в ОРИТ, а аномальные изменения на КТ ОГП продолжали обнаруживаться после острого периода инфекции у 76%.
Для сравнения можно привести опубликованные ранее данные о долгосрочных исходах у пациентов, перенесших пневмонию, вызванную вирусом SARS. Оказалось, что через 1 год после выписки нарушение DLCO наблюдалось у подавляющего большинства пациентов — в 80% случаев, при этом ухудшение было легким в 46% случаев и умеренным — в 23%. Рестриктивные и обструктивные нарушения функции внешнего дыхания (ФВД) обнаружили у 20% пациентов, обструктивный синдром чаще всего наблюдался у курильщиков [22]. Проспективное когортное исследование D.S. Hui et al. [23] показало, что среди 110 больных, выживших после острого повреждения легких (ОПЛ) / острого респираторного дистресс-синдрома (ОРДС), вызванного SARS, через 1 год после начала заболевания снижение DLCO сохранялось у 24% пациентов, а рентгенологические изменения — у 28%. По данным H. Shi et al. [24], КТ через 6 мес. показала фиброзные изменения в легких у более чем трети пациентов, перенесших тяжелую пневмонию, вызванную COVID-19. Эти изменения были связаны с пожилым возрастом, развитием ОРДС, длительным пребыванием в больнице, тахикардией, неинвазивной механической вентиляцией легких и высоким исходным баллом поражения на КТ ОГП. На основании анализа особенностей протекания других коронавирусных инфекций, в том числе атипичной пневмонии и ближневосточного респираторного синдрома (MERS), можно предположить развитие постинфекционного фиброза [25]. Исследования показывают развитие фиброза легких и сохранение аномальных результатов на КТ ОГП до 7 лет после появления симптомов [26].
Безусловно, у большинства пациентов с течением времени происходит полная регрессия изменений в паренхиме легких или развиваются минимальные пневмосклеротические изменения [5]. В работе V. D’Onofrio et al. [27] показано, что обширные изменения на КТ ОГП, которые первично могли быть трактованы как фиброз (ретикулярные аномалии, тракции бронхов, транссептальные уплотнения), по мере наблюдения либо полностью исчезали, либо существенно редуцировались, что не позволяло их отнести к процессу фиброзной трансформации. Однако мы продолжаем наблюдать пациентов, которые субъективно более 1 года после болезни отмечают ухудшение своего физического и функционального состояния, у них сохраняются нарушения МЦ, изменения в паренхиме легких и показатели ФВД. Таким пациентам в отдаленном периоде (через 1 год и более) после заболевания, по нашему мнению, необходимо проводить лучевой контроль (МСКТ, ОФЭКТ) и определение функционального состояния легких (спирометрия, диффузионная способность).
Особое значение при этом имеет возраст пациентов (старше 60 лет) и тяжелое течение вирусной пневмонии. В данной работе мы не рассматриваем результаты лучевого мониторинга у пациентов, имеющих хронические заболевания легких и перенесших ТЭЛА в период заболевания.
Выводы
Результаты комплексного функционально-лучевого исследования повышают эффективность диспансеризации пациентов в постковидном периоде.
В проведении комплексного лучевого мониторинга нуждаются пациенты старше 60 лет; переболевшие новой коронавирусной инфекцией в тяжелой форме; пациенты, у которых более 1 года сохраняются жалобы со стороны органов дыхания, независимо от тяжести течения COVID-19.
Нарушения МЦ >50%, выявляемые через 6 мес. после болезни, являются предиктором изменений в паренхиме легких и могут свидетельствовать о серьезных последствиях заболевания.
Сведения об авторах:
Золотницкая Валентина Петровна — д.б.н., старший научный сотрудник НИИ пульмонологии ПСПбГМУ им. И.П. Павлова; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-7982-3805.
Сперанская Александра Анатольевна — д.м.н., профессор кафедры рентгенологии и радиационной медицины с рентгенологическим и радиологическим отделениями ПСПбГМУ им. И.П. Павлова; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0001-8322-4509.
Кузубова Наталия Анатольевна — д.м.н., заведующая лабораторией ХОПЛ НИИ пульмонологии ПСПбГМУ им. И.П. Павлова; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-1166-9717.
Титова Ольга Николаевна — профессор, д.м.н., директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-4678-3904.
Амосова Ольга Викторовна — ординатор кафедры рентгенологии и радиационной медицины ПСПбГМУ им. И.П. Павлова; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-2482-7435.
Контактная информация: Золотницкая Валентина Петровна, e-mail: zolotnitskaja68@yandex.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.07.2022.
Поступила после рецензирования 02.08.2022.
Принята в печать 25.08.2022.
About the authors:
Valentina P. Zolotnitskaya — Dr. Sc. (Bio.), Senior Researcher at the I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-7982-3805.
Alexandra A. Speranskaya — Dr. Sc. (Med.), Professor of the Department of Radiology and Radiation Medicine with X-Ray and Radiological Departments, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-8322-4509.
Natalia A. Kuzubova — Dr. Sc. (Med.), Head of the Laboratory of the COPD Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Olga N. Titova — Dr. Sc. (Med.), Professor, Director of the Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Olga V. Amosova — Resident of the Department of Radiology and Radiation Medicine, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-2482-7435.
Contact information: Valentina P. Zolotnitskaya, e-mail: zolotnitskaja68@yandex.ru.
Financial Disclosure: the authors have no financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 09.07.2022.
Revised 02.08.2022.
Accepted 25.08.2022.
Информация с rmj.ru


