Введение
Гипофосфатазия (ГФФ) — редкое наследственное метаболическое заболевание, вызванное мутациями в гене ALPL, кодирующем активность фермента тканенеспецифической щелочной фосфатазы (ЩФ) [1, 2]. Наследование мутаций может происходить как по аутосомно-доминантному, так и по аутосомно-рецессивному типу [2]. Наличие патогенной мутации приводит к снижению активности тканенеспецифической ЩФ и внеклеточному накоплению ферментных субстратов: неорганического пирофосфата и пиридоксаль-5’-фосфата [1, 3], в результате чего нарушается минерализация костной ткани, обмен витамина В6 в ЦНС, что в последующем определяет клинику заболевания.
Для клинической картины ГФФ наиболее характерными проявлениями являются дефекты формирования и развития опорно-двигательного аппарата — укорочение и деформация конечностей, грудной клетки, черепа. У детей с возрастом может наблюдаться низкая масса тела и задержка роста. С возрастом растет риск возникновения патологических, плохо консолидирующихся переломов, часто требующих хирургического лечения. Боли в мышцах и костях приводят к нарушению походки, прогрессирующему ограничению подвижности [1, 3, 4]. Деформации грудной клетки способствуют нарушению акта дыхания, вторичной гипоплазии легких, что может быть причиной тяжелых дыхательных расстройств [4, 5]. Развивающаяся гиперкальциемия, обусловленная нарушением кальций-фосфорного обмена, нередко является причиной нефрокальциноза с развитием прогрессирующего повреждения почек. Следствием нарушения обмена витамина В6 являются неврологические симптомы заболевания: витамин-В6-зависимые судороги, внутричерепные кровоизлияния, мышечная гипотония, задержка психомоторного развития. Из-за нарушения процесса формирования костей черепа может формироваться краниосиностоз с повышением внутричерепного давления [4, 6]. Преждевременное выпадение молочных или постоянных зубов, причем чаще всего с неизмененным корнем, — один из характерных признаков ГФФ [4, 7].
Диагноз ГФФ основывается на характерных клинических симптомах, низкой активности ЩФ (с учетом возраста и пола пациентов), гиперкальциемии/гиперфосфатемии и характерной рентгенологической картины [3, 4, 10]. При рентгенографии длинных трубчатых костей выявляют деформации, остеопороз, участки гипоминерализации, а также расширение, «изъеденность» зон роста; типичны участки просветления в метафизах — так называемые «языки пламени». Подтверждается диагноз выявлением мутации в гене ALPL при молекулярно-генетическом исследовании.
До недавнего времени врачи не обладали достаточными знаниями о ГФФ, не знали о важности снижения показателя ЩФ. Следовательно, пациенты с ГФФ проходили под любыми другими диагнозами, клинически схожими с ГФФ. По этой причине лечение ГФФ было исключительно симптоматическим: диета с пониженным содержанием кальция, противосудорожные препараты, хирургическая помощь при возникновении переломов или развитии краниосиностоза, физиотерапия и лечебная гимнастика для укрепления опорно-двигательного аппарата. Предпринимались попытки лечения высокими дозами витамина D,
бисфосфонатами или терипаратидом, однако ни один из таких подходов не приводил к клиническому улучшению [13]. В 2019 г. в РФ зарегистрирован лекарственный препарат для ферментозаместительной терапии ГФФ асфотаза альфа — рекомбинантная человеческая ЩФ [3].
В ГБУЗ ДГКБ № 8 г. Челябинска под наблюдением находятся 3 пациента с ГФФ. Ранее нами коротко был представлен опыт диагностики детской формы ГФФ у 2 пациентов в семье [10]. Целью настоящей публикации стало более подробное описание этих клинических наблюдений, клинических симптомов, наиболее характерных для детской формы заболевания, и представление результатов ферментозаместительной терапии у детей по итогам первого года лечения.
Клиническое наблюдение
В июне 2019 г. к детскому эндокринологу обратилась мать с двумя детьми. Жалобы при обращении к специалисту были однотипные: раннее выпадение зубов с неизмененным корнем, быстрая утомляемость, деформации нижних конечностей.
При сборе анамнеза удалось установить, что ребенок Р. от 1-й беременности, протекавшей на фоне хронической фетоплацентарной недостаточности, хронической гипоксии плода, хронической инфекции (грибковый вагинит). Роды на сроке 40–41 нед. гестации, родоразрешение путем кесарева сечения (ягодичное предлежание плода). Масса при рождении — 3490 г, длина — 51 см, окружность головы — 36 см, оценка по шкале Апгар — 8/8 баллов. С возраста 1 мес. ребенок наблюдался ортопедом по поводу дисплазии тазобедренных суставов, у невролога — по поводу синдрома мышечной гипотонии. Педиатр назначал профилактику и лечение рахита. Мама регулярно выполняла рекомендации специалистов, но значимого эффекта от проводимых мероприятий получено не было. В течение первого года рос и развивался по возрасту, регулярно наблюдался в условиях поликлиники. С 1 года у ребенка стали выпадать молочные зубы, появились боли в конечностях и быстрая утомляемость.
Родители также отмечали, что ребенок часто падает. Первое обращение к стоматологам было в возрасте 1 год 1 мес. по поводу выпадения молочных зубов. Осмотрен стоматологом, дано заключение: Генерализованный пародонтит тяжелой степени. Повторное обращение к стоматологу в возрасте 2 лет было по поводу продолжающейся потери молочных зубов. Заключение стоматологов оставалось прежним: Генерализованный пародонтит тяжелой степени. Было предложено изготовление накладок для улучшения жевательной функции. В возрасте 4 лет консультирован ортопедом по месту жительства по поводу сохранЖ fющихся болей в конечностях, частых падений, нарушения осанки. По результатам осмотра было дано заключение: Плоско-вальгусная деформация левой стопы, нарушение осанки. В возрасте 6 лет после незначительного удара о косяк у мальчика был диагностирован перелом ключицы.
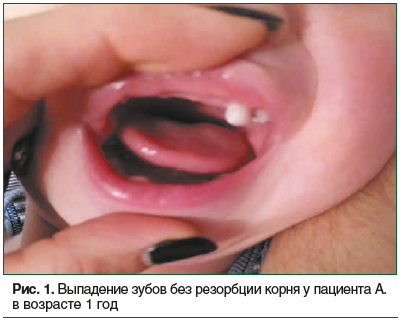
В 2018 г. в семье родился второй мальчик. Ребенок от 2-й беременности, протекавшей на фоне токсикоза I триместра, хронической внутриутробной гипоксии плода, на 20-й неделе беременности мать перенесла ОРВИ. Роды на сроке 40 нед., самостоятельные. Масса тела при рождении — 3240 г, длина — 52 см, окружность головы — 36 см, оценка по шкале Апгар — 7/8 баллов. Ребенок регулярно наблюдается специалистами в поликлинике, проводятся инструментальные обследования. С возраста 1 мес. мальчик наблюдается ЛОР-врачом по поводу врожденного стридора. В 3 мес. ребенок консультирован неврологом, установлен диагноз: Синдром мышечной дистонии. Рахит 1-й степени, начальные проявления, по поводу чего был рекомендован курс массажа и прием витамина D. В 11 мес. ребенок упал, и при ударе во время падения с высоты собственного роста у него выпали 2 нижних резца (рис. 1). С рождения у ребенка отсутствует самостоятельный стул.
Наблюдая однотипные жалобы и симптомы у детей, родители обратились к детскому эндокринологу для исключения наследственного заболевания. Пациентам проведено комплексное обследование в рамках дифференциальной диа e3ностики нарушений фосфорно-кальциевого обмена, основные результаты представлены в таблице 1. Для подтверждения диагноза ГФФ пациентам и их родителям выполнены молекулярно-генетические исследования в лаборатории ФГБНУ «МГНЦ», а окончательный диагноз установлен при обследовании в отделении клинической генетики Института педиатрии им. акад. Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
У матери пробандов уровень ЩФ составляет 28,4–36 Ед/л (норма 30–120 Ед/л), молекулярно-генетический анализ: методом прямого секвенирования определен вариант нуклеотидной последовательности c.662delG, p.Gly221Valf*56 в гене ALPL в гетерозиготном состоянии. У отца пробандов уровень ЩФ составляет 38 Ед/л (норма 53–128 Ед/л), молекулярно-генетический анализ: методом прямого секвенирования определен вариант нуклеотидной последовательности c.571G>A, p.Glu191Lys в гене ALPL в гетерозиготном состоянии. Родители пациентов Р. и А. не имеют клинических проявлений гипофосфатазии. Брак не родственный.
Обоим пациентам было рекомендовано проведение ферментозаместительной терапии. С мая 2020 г. по настоящее время дети получают заместительную терапию препаратом асфотаза альфа в дозе 2 мг/кг массы тела путем подкожной инъекции 3 р/нед. Коррекция дозы проводится с учетом антропометрических показателей пациентов. На фоне терапии у детей начала развиваться гипокальциЦ 5мия, которая потребовала заместительной терапии препаратами кальция. До начала ферментозаместительной терапии пациенту Р. было предложено провести тест с 6-минутной ходьбой для оценки толерантности к физической нагрузке. В ходе выполнения теста ребенок прошел 320 м, что соответствует 59% от нормального показателя у здоровых сверстников. На фоне терапии отмечается хорошая положительная динамика. С началом терапии у мальчиков прекратилось выпадение зубов. У старшего брата на месте выпавших молочных зубов растут постоянные зубы. Пациен 2 А. (младший брат) посещает детский сад, растет и развивается соответственно возрасту. У ребенка через 10 дней от начала терапии появился самостоятельный стул. Хорошо справляется с физической нагрузкой. У мальчика уменьшились проявления стридора. В Институте педиатрии им. акад. Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России через 5 мес. от начала терапии проведена эндоскопия полости носа, носоглотки, гортани. Надгортанник подковообразной формы, хрящи гортани сформированы правильно. Черпаловидные хрящи увеличены, слизистая их гипертрофирована, надгортанник при форсированном вдохе теперь не пролабирует в гортань. Голосовые связки бледные, смыкаются полностью. В грушевид edых синусах секрета нет. Дано заключение: Врожденный стридор. Гипертрофия черпаловидных хрящей. Ларингомаляция. По результатам проведенного обследования было рекомендовано динамическое наблюдение оториноларингологом и при сохранении стридорозного дыхания в дальнейшем решение вопроса об операт ивном лечении — аритеноидопластики.
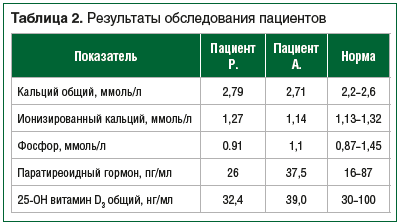
Пациент Р. (старший брат) очень активен. Катается на велосипеде. Забыл про утомляемость, боли в конечностях. При проведении 6-минутного теста через 3 мес. от начала терапии ребенок без труда прошел расстояние в 580 м — 96% от нормального показателя для детей в возрасте 7 лет. Через 1 год от начала терапии ребенок начал посещать спортивную секцию и в настоящее время активно занимается футболом. При последнем обследовании (декабрь 2021 г.) показатели ЩФ в крови у старшего и младшего братьев составили 6780 Ед/л и 5920 Ед/л соответственно. Результаты дополнительных методов исследования представлены в таблице 2.
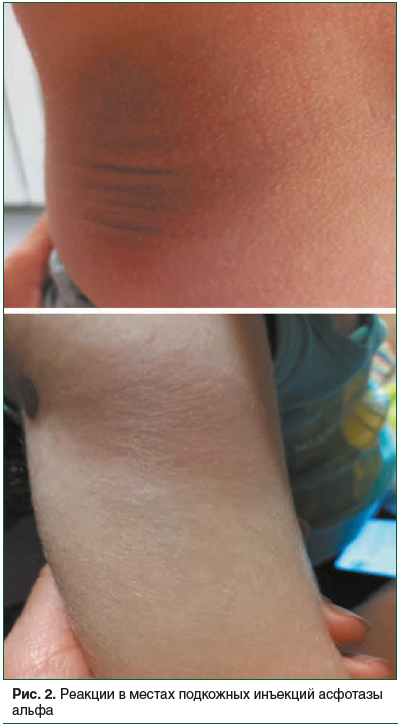
Единственным осложнением проводимой терапии является местная реакция в виде гиперемии в местах инъекций препарата (рис. 2). Данное осложнение является распространенным и, по данным литературы, встречается у пациентов, получающих лечение [11]. Применение асфотазы альфа может вызвать развитие реакций в месте инъекции (включая, но не ограничиваясь этим, эритему, сыпь, обесцвечивание, зуд, боль, папулу, узелок, атрофию), которые определены как связанные с терапией нежелательные явления, возникающие во время проведения инъекции или до конца дня, в который проведена инъекция.
Обсуждение
Анализ данного семейного случая заболевания демонстрирует, что клинические проявления ГФФ очень разнообразны, затрагивают многие органы и системы. В результате такой полиморфности клинических симптомов и недостаточной осведомленности врачей дети наблюдались у разных специалистов, получая только симптоматическую терапию. Клинические прояв ebения ГФФ у наших пациентов были типичны для данного заболевания и соответствовали их описанию в современной литературе. Братья имели рахитоподобные деформации конечностей, мышечную слабость, плохую переносимость физической нагрузки. У детей в анамнезе в ыявлялось раннее выпадение молочных зубов — важный диагностический критерий при постановке диагноза ГФФ. Однако данный симптом не был адекватно оценен, что отодвигало сроки постановки диагноза. У одного из братьев имели место проявления врожденного стридора и запора. В современной литературе не описаны эти состояния как проявления ГФФ. Однако на фоне терапии у ребенка нормализовался акт дефекации, отсутствует потребность в медикаментозных препаратах. Возможно, одной из причин развития запора могла быть гиперкальциемия, которая имеет место при ГФФ до назначения ферментозаместительной терапии. Так как стридор — это не заболевание, а симптом какой-либо патологии, а в данном случае у ребенка имеет место ларингомаляция, относящаяся к тканевым порокам развития гортани, в основе которых лежат процессы дисхронии — врожденного нарушения темпов развития тканей, возникает вопрос: не мог ли внутриутробный дефицит ЩФ способствовать формированию данного порока?
Несвоевременная диагностика заболевания приводит к отсроченному назначению ферментозаместительной терапии асфотазой альфа. Важной особенностью ГФФ является прогрессирующий характер течения, и если при манифестации определялся только один симптом (например, гипотония с момента рождения), то в условиях дефицита фермента клинические проявления нарастают и утяжеляют течение заболевания.
Наиболее простым и доступным методом дифференциальной диагностики заболевания является определение уровня активности ЩФ. Для постан eeвки диагноза у пациентов использовалось сочетание клинических симптомов заболевания, характерных изменений при проведении рентгенологического исследования и снижения активности ЩФ ниже нормы. Также была проведена генетическая верификация, позволившая выявить мутации в гене ALPL.
Ранняя диагностика ГФФ имеет существенное значение в связи с появлением ферментозаместительной терапии асфотазой альфа. С учетом прогрессирующего характера врожденного заболевания раннее начало лечения означает лучший прогноз с точки зрения развития осложнений и инвалидизации детей. Дети с ГФФ требуют динамического наблюдения, так как на фоне терапии восстанавливаются темпы их роста и развития, что требует своевременной коррекции дозы препарата асфотаза альфа.
В представленных клинических наблюдениях терапия асфотазой альфа подтвердила свою эффективность: по итогам первого года лечения пациенты продемонстрировали хорошие темпы роста с коррекцией деформаций, повышение мышечной силы и толерантности к физическим нагрузкам, купирование болевого синдрома, улучшение качества костей по данным контрольных рентгенограмм, прекращение выпадения зубов. У детей на фоне терапии улучшилось качество жизни. Эти результаты полностью согласуются с опубликованными в международной литературе данными — ферментозаместительная терапия обеспечивает минерализацию костной ткани и способствует нормализации роста и развития ребенка, формированию моторных навыков, улучшению качества жизни [12].
Заключение
Анализ семейного случая заболевания ГФФ позволяет рекомендовать практикующим специалистам при наличии у пациента любой костной патологии с рахитоподобными проявлениями, раннего выпадения зубов, мышечной гипотонии проводить обязательную оценку уровня ЩФ — стартового лабораторного теста и в дальнейшем основного лабораторного теста для подтверждения диагноза ГФФ. При интерпретации результатов измерения ЩФ крайне важно использовать референсные диапазоны с учетом пола и возраста пациента. Ранняя диагностика ГФФ, основанная на сочетании клинических признаков, низкого уровня ЩФ, и при наличии мутаций в гене ALPL позволяет эффективно использовать ферментозаместительную терапию асфотазой альфа, подобрать правильную тактику ведения, значительно менять прогноз для пациентов с ГФФ. Чередование областей проведения инъекций обеспечит эффективный контроль за возникновением реакций в местах введения препарата.
Гипофосфатазия — это мультисистемное заболевание, требующее от врачей разных специальностей знаний о клинике заболевания для ранней его диагностики и в дальнейшем активного динамического наблюдения на фоне ферментозаместительной терапии асфотазой альфа.
.
Информация с rmj.ru