Введение
Фенилкетонурия (ФКУ), МКБ 10: Е70.0, — это наследственное аутосомно-рецессивное заболевание, обусловленное снижением активности фермента фенилаланингидроксилазы, что приводит к нарушению обмена незаменимой аминокислоты фенилаланина (ФА). При этом происходит накопление ФА и его метаболитов, обладающих токсическим действием, в биологических тканях. Заболевание характеризуется прогрессированием неврологических симптомов с необратимым повреждением центральной нервной системы и развитием тяжелого неврологического дефицита [1]. Частота ФКУ разнообразна в различных популяциях. Так, в России среди новорожденных она составляет 1:7142 [2]. В связи с широкой распространенностью ФКУ и высокой эффективностью патогенетической терапии в Российской Федерации проводится неонатальный скрининг этого заболевания, при котором у всех новорожденных определяется уровень ФА в крови [3].
Ключевое значение в лечении ФКУ имеет диетотерапия, основной задачей которой является коррекция имеющихся метаболических нарушений. Согласно результатам проведенных ранее исследований терапия должна назначаться как можно раньше, до наступления необратимых повреждений, и проводиться пожизненно [4, 5]. Основной принцип диетотерапии заключается в ограничении поступления патогенетически значимых компонентов пищи с целью предупреждения накопления продуктов, предшествующих метаболическому блоку. При ФКУ из рациона больных исключаются высокобелковые продукты, уменьшается дотация естественного белка [4]. Восполнение дефицита белка и других незаменимых аминокислот у пациентов с ФКУ осуществляется с помощью специализированных продуктов диетического лечебного питания (СПДЛП), не содержащих фенилаланина.
В последние годы, несмотря на накопленный мировой опыт диагностики и лечения ФКУ, сохраняется интерес к новым терапевтическим подходам и возможностям совершенствования диетического лечения, поскольку остается актуальным вопрос низкой приверженности диете, особенно среди пациентов подросткового возраста и взрослых [5]. Обсуждаются вопросы потребности и обеспеченности пациентов различных возрастных групп основными нутриентами, изучается взаимосвязь между качественным составом белкового компонента пищи и показателями физического и психомоторного развития пациентов с ФКУ.
Огромное внимание уделяется изучению отдаленных результатов патогенетического лечения, исследованию качества жизни пациентов с ФКУ, возможностям его улучшения, в том числе за счет оптимизации состава и расширения ассортимента специализированных продуктов [6]. С этой целью разработаны новые СПДЛП для диетотерапии ФКУ: «Нонфеник®-13», «Нонфеник®-20», «Нонфеник®-40», «Нонфеник®-70» и «Нонфеник®-75». Продукты различаются содержанием белка на 100 г смеси в соответствии с возрастными потребностями. Макро- и микронутриентный состав исследуемых продуктов сбалансирован по аминокислотам, обогащен всеми необходимыми витаминами — А, В1, В2, В6, В12, С, D, Е, К, РР, пантотеновой и фолиевой кислотами, биотином, инозитом, L-карнитином, холином, минеральными веществами (натрий, калий, кальций, магний, фосфор, медь, йод, марганец, хлориды, железо, цинк) с учетом физиологических потребностей разного возраста.
Цель исследования: оценить эффективность СПДЛП для детей, взрослых и беременных женщин, больных ФКУ.
Материал и методы
В амбулаторных условиях проведена открытая, многоцентровая, проспективная апробация в период с 26.10.2021 по 14.01.2022 на базе ФГБНУ «МГНЦ» (Москва), ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России (Иваново) и ГБУЗ РМГЦ (Уфа).
Клиническая апробация проведена в соответствии с основополагающими этическими нормами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации, трехстороннем соглашении по надлежащей клинической практике (ICH GCP), Рекомендациях Комитета по этике, осуществляющего экспертизу биомедицинских исследований ВОЗ и EFGCP (2000 г.), письме Минздрава России от 01.09.2016 № 28–1/2406, а также в соответствии с действующим законодательством и международными нормативными актами.
Критерии включения: установленный на основе клинико-биохимических данных диагноз ФКУ; предоставление пациентом или его законным представителем информированного согласия; способность родителя пациента к адекватному сотрудничеству (способность понять предоставленную информацию о клинической апробации и готовность к соблюдению требований ее протокола).
Критерии исключения: индивидуальная непереносимость исследуемого продукта (ИП); отказ родителя пациента от участия в клинической апробации / отзыв информированного согласия; развитие нежелательных явлений (НЯ), препятствующих дальнейшему проведению терапии; возникновение острых сопутствующих соматических заболеваний / симптомов или обострение хронических заболеваний, не связанных с применением продукта (по усмотрению врача-исследователя).
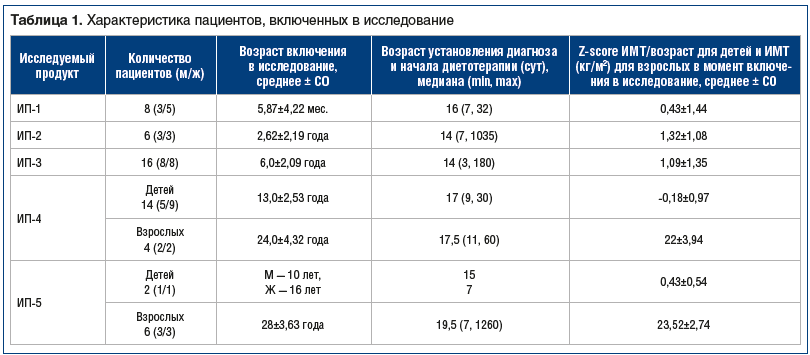
В исследование включили 60 пациентов. Исследуемый продукт «Нонфеник®-13» (ИП-1), разработанный для детей первого года жизни, получали 9 пациентов, «Нонфеник®-20» (ИП-2), разработанный для детей от 1 года до 3 лет, получали 6 пациентов, «Нонфеник®-40» (ИП-3), разработанный для детей от 3 до 7 лет, получали 19 пациентов; «Нонфеник®-70» (ИП-4), предназначенный для лечения детей старше 7 лет, получали 18 пациентов; «Нонфеник®-75» (ИП-5), предназначенный для лечения детей старше 7 лет и взрослых, в том числе беременных женщин, получали 8 пациентов.
Длительность приема ИП составила 30±2 дня. Протоколом было предусмотрено два визита к врачу-исследователю: визит включения (Визит 1) в День 0 и визит в конце апробации (Визит 2) в День 30±2. По показаниям могли быть назначены дополнительные визиты. Во время визитов проводили сбор анамнестических и клинических данных, а также определяли содержание аминокислот в крови, в том числе ФА, оценивали безопасность ИП.
Анамнестический метод включал в себя сбор и анализ жалоб, анамнеза жизни и болезни и осуществлялся путем непосредственного опроса пациентов или их родителей и анализа медицинской документации. Оценка соматического статуса предусматривала осмотр пациента с определением общего состояния, состояния кожи и слизистых, проводилась оценка функций отдельных органов и систем. Оценивались наличие/отсутствие аллергических реакций, диспепсических явлений, отказ от употребления ИП.
Анализ физического развития у детей с рождения до 18 лет проводили с использованием модулей программ WHO Anthro и WHO AnthroPlus по антропометрическим показателям — массы и длины тела. Измерение этих показателей проводилось с помощью электронных весов и ростомеров. Показатели Z-scores массы к возрасту, длины к возрасту, окружности головы к возрасту оценивали при рождении, перед началом лечения и на фоне применения ИП. Оценка физического развития основывалась на выявлении отклонений вычисленных показателей от медианы, рассчитанной для стандартной популяции (Z-scores). Согласно стандартам ВОЗ средневозрастными показателями Z-score массы и длины тела считали показатели в пределах ±2SD (SD — стандартное отклонение).
Всем детям на Визите 1 был назначен ИП, проведен расчет питания с постепенным переводом ребенка с применяемого СПДЛП на ИП в соответствии с Клиническими рекомендациями Минздрава России [3].
Уровень ФА определялся дважды: до начала лечения и при завершении исследования (при необходимости — чаще). Для анализа использовалась периферическая кровь, взятая на бланк-фильтр (форма № 903). Анализ осуществлялся флуориметрическим методом. Рекомендуемый безопасный показатель ФА крови у детей 0–12 лет и беременных женщин на фоне лечения СПДЛП должен составлять 2–6 мг/дл, у детей старше 12 лет — 2–10 мг/дл [3].
Определение уровня тирозина проводили методом тандемной масс-спектрометрии с использованием сертифицированного набора NeoBase MS/MSkit (Perkin Elmer, Финляндия). Анализ проводился на Визитах 1 и 2. Референсные значения уровня тирозина крови составляют: у детей от 8 дней до 6 мес. — 10–300 мкМ/л, старше 6 мес. — 15–235 мкМ/л. Референсные значения соотношения ФА и тирозина крови: у детей от 8 дней до 6 мес. — 0,15–6,1, старше 6 мес. — 0,15–6,5.
Во время Визита 2 оценивали степень удовлетворенности родителей пациентов и врача-исследователя диетотерапией при помощи шкалы Лайкерта: 1 — «Нет, не удовлетворен»; 2 — «По большей части нет»; 3 — «Удовлетворен, но только до некоторой степени»; 4 — «По большей части удовлетворен»; 5 — «Полностью удовлетворен».
Статистическая обработка: в клинической апробации использовались описательные статистические методы представления полученных данных и отражения динамики изменения параметров, а также методы статистического анализа данных для обоснования выводов по эффективности и безопасности исследуемого продукта. Интервальные (количественные) данные описаны с помощью среднего арифметического, стандартного отклонения (СО), медианы, минимума и максимума. Категориальные (качественные) данные описаны с помощью абсолютных и относительных частот. Сравнение частот между группами терапии выполнено с помощью точного критерия Фишера или критерия χ2 Пирсона с поправкой Йетса. Сравнение групп по непрерывным параметрам проводилось методом дисперсионного анализа (ANOVA, параметрический критерий) или непараметрического критерия Манна — Уитни. Выбор параметрических и непараметрических критериев проверки статистических гипотез основывался на результатах теста Шапиро — Уилка или теста Колмогорова — Смирнова (вывод о наличии/отсутствии статистически значимых различий распределения соответствующей переменной по закону нормального распределения). В данной клинической апробации уровень статистической значимости был принят равным 5% (р=0,05).
Результаты и обсуждение
Исследуемый продукт-1, разработанный для детей первого года жизни, был назначен 9 детям, однако один пациент в возрасте 11 мес. досрочно выбыл из клинической апробации по причине отказа от употребления смеси из-за ее густоты (ребенок привык к кормлению более жидкой смесью, и процесс кормления ИП занимал много времени). Завершили клиническое исследование 8 детей из группы ИП-1. Один ребенок включен в исследование на первом месяце жизни сразу после установления диагноза. Все дети родились доношенными, с нормальными показателями физического развития: Z-score массы к возрасту составила 0,75±0,7SD, Z-score длины к возрасту — 1,94±0,47SD; Z-score окружности головы к возрасту — 0,47±0,74SD. Перинатальный период у всех детей был благополучным. Всем детям диагноз был установлен своевременно, на первом месяце жизни, назначена диетотерапия.
В группу детей, которые получали ИП-2, разработанный для детей от 1 года до 3 лет, было включено 6 пациентов. Все дети родились доношенными, с нормальными показателями физического развития: при рождении Z-score массы к возрасту составила -0,16±1,59SD, Z-score длины к возрасту — 1,04±2,00SD; Z-score окружности головы к возрасту — -0,39±0,83SD. Перинатальный период у всех детей был благополучным. Всем детям диагноз установлен в первые 2 нед. жизни с последующим началом диетотерапии. У одного ребенка отмечалась мягкая форма ФКУ, не требовавшая назначения специализированного питания до 2 лет 10 мес.
В группу детей, получавших ИП-3, разработанный для детей в возрасте от 3 до 7 лет, вошло 19 пациентов, из них 3 пациента досрочно выбыли из клинической апробации (один ребенок был исключен в связи с развитием острого инфекционного заболевания — ветряной оспы, второй — по причине отказа принимать другую смесь, третий — по личным соображениям родителей). Данные выбывших пациентов не включали в анализ. Оставшиеся 16 пациентов полностью прошли все процедуры клинической апробации, предусмотренные протоколом, до ее завершения. Все дети родились доношенными, с нормальными показателями физического развития: при рождении Z-score массы к возрасту составила 0,27±0,89SD; Z-score длины к возрасту — 1,10±1,36SD; Z-score окружности головы к возрасту — -0,69±0,94SD. Перинатальный период у всех детей был благополучным. Всем детям диагноз установлен в первые 2 нед. жизни с последующим началом диетотерапии. У одного ребенка отмечалась мягкая форма ФКУ, не требовавшая назначения специализированного питания до 6 мес. На фоне введения прикорма уровень ФА крови превысил допустимое значение, и ребенку была начата диетотерапия.
В группу пациентов, получавших ИП-4, предназначенный для лечения детей старше 7 лет, взрослых и беременных женщин, включено 18 человек. Из них 14 детей старше 7 лет и 4 взрослых. Все пациенты из группы ИП-4 родились в срок с нормальными показателями физического развития: при рождении Z-score массы к возрасту составила -0,07±0,65SD; Z-score длины к возрасту — 0,78±0,81SD; Z-score окружности головы к возрасту — -0,56±-0,95SD. Перинатальный период у всех детей был благополучным. Почти всем пациентам диагноз был установлен своевременно, за исключением одного ребенка, которому диагноз был установлен в возрасте 3 лет, уровень ФА составил 22 мг/дл.
В группу пациентов, получавших ИП-5, предназначенный для лечения детей старше 7 лет, взрослых и беременных женщин, вошло 8 человек. Из них 2 ребенка (мальчик 10 лет и девочка 16 лет) и 6 взрослых, в том числе одна беременная женщина 29 лет. Все пациенты родились в срок с нормальными показателями физического развития. Перинатальный период у всех пациентов был благополучным. У двоих пациентов отмечалась поздняя диагностика основного заболевания, у одного — в 3 года 4 мес., что привело к развитию тяжелого неврологического дефицита и эпилепсии, у другого — в 2 мес., у него отмечена легкая задержка развития.
Демографические данные пациентов представлены в таблице 1.
Полностью прошли все процедуры апробации, предусмотренные протоколом, и успешно ее завершили 56 пациентов.
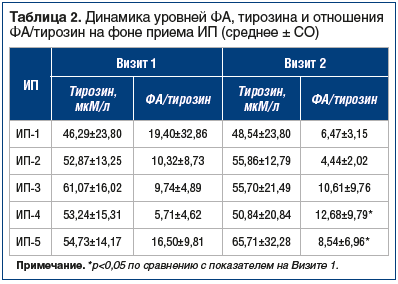
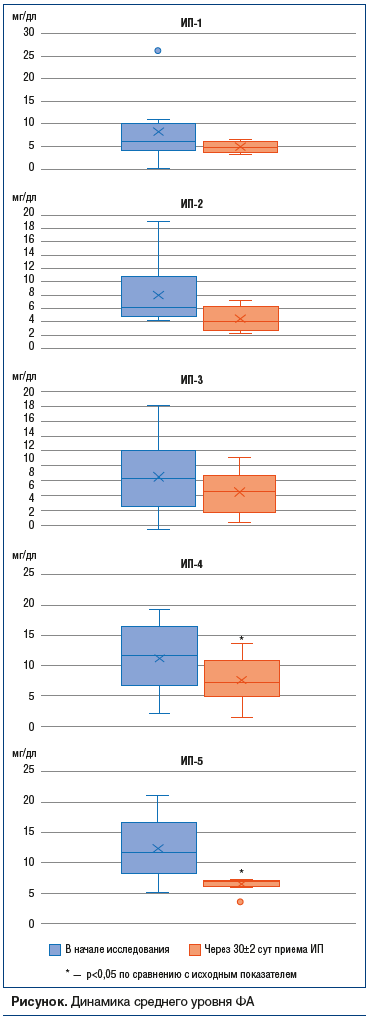
В результате применения ИП средний уровень ФА крови снизился, для ИП-4 и ИП-5 статистически значимо, и находился в пределах безопасных значений. Лучшие результаты в отношении контроля уровня ФА крови у пациентов получены в группах ИП-1, ИП-4 и ИП-5. Это, вероятно, обусловлено большей возможностью контроля за строгим соблюдением диеты и приверженностью пациентов диетотерапии в целом в соответствующих возрастных категориях (дети до года и взрослые пациенты). Динамика показателей ФА представлена на рисунке, динамика уровней тирозина и отношения ФА/тирозина отражена в таблице 2.
Темпы физического развития к концу исследования соответствовали средневозрастным значениям. Отмечалась физиологическая прибавка массы и длины у детей первого года жизни.
У одного ребенка 6 лет на фоне приема ИП-3 родители отметили уменьшение гиперактивности (ребенок стал спокойнее), спазмы в икроножных мышцах, наблюдавшиеся на момент начала апробации, исчезли.
Согласно патогенезу ФКУ нарушение метаболизма ФА приводит к дефициту синтеза тирозина. Тирозин играет важную роль в биосинтезе нейромедиаторов головного мозга (эпинефрин, норэпинефрин и допамин), тироксина и меланина в коже [7]. Важной задачей диетотерапии пациентов с ФКУ является поддержание уровня тирозина крови в пределах нормальных значений, не допуская его снижения. Уровень тирозина на Визитах 1 и 2 у пациентов статистически не отличался и находился в пределах нормальных значений, что говорит о сбалансированности ИП по аминокислотному составу.
Беременная женщина 29 лет была включена в исследование на сроке 29–30 нед. гестации, получала ИП-5. До 8 нед. беременности диетотерапию не получала, затем диетотерапия была возобновлена. Показатель ФА крови в сравнении с исходным уровнем (7,9 мг/дл) снизился (5,4 мг/дл) и оставался в пределах допустимых значений в III триместре беременности.
В ходе исследования оценивали удовлетворенность врача-исследователя и родителя пациента проводимой диетотерапией по шкале Лайкерта: средний уровень удовлетворенности пациентов или их родителей составил 3,94±1,13 (медиана 4, мин. 1; макс. 5; n=56); средний уровень удовлетворенности врача — 4,64±0,48 (медиана 5; мин. 4; макс. 5; n=56), что говорит о высокой степени удовлетворенности лечением как пациентов, так и врача.
На протяжении клинической апробации все пациенты успешно принимали ИП, что указывает на хорошие вкусовые качества данного лечебного питания. Пациенты и их родители отметили быструю адаптацию к новому продукту. Нарушений стула, аллергических реакций в ходе всего исследования не зарегистрировано. В ходе клинической апробации не было зарегистрировано серьезных НЯ, связанных с исследуемым продуктом и потребовавших отмены терапии. Зарегистрировано 4 НЯ, которые имели легкую степень тяжести при приеме ИП-3. Было зарегистрировано 2 случая тошноты, 1 случай однократной рвоты после приема ИП натощак и 1 случай вздутия живота. Все НЯ разрешились самостоятельно, никаких действий не проводилось, пациенты продолжили прием ИП.
Заключение
Специализированные продукты для лечебного питания на основе аминокислот без ФА — главный источник белка для больных ФКУ. Благодаря развитию современных технологий создаются новые продукты с оптимизированным аминокислотным, макро- и микронутриентным составом, с повышенной биологической ценностью. Продукты обогащены тирозином, что позволяет поддерживать уровень тирозина в пределах физиологических значений. Проведенная клиническая апробация показала высокую эффективность и переносимость ИП, что выражалось в снижении уровня ФА после потребления продукта уже в течение 30±2 дня. Таким образом, ИП полностью соответствует требованиям, предъявляемым к СПДЛП для пациентов, страдающих наследственными нарушениями обмена ФА.
Исследование проведено при поддержке ООО «Космофарм».
Конфликт интересов отсутствует.
.
Информация с rmj.ru






