Содержание статьи
Введение
Глаукома является одной из основных причин слабовидения и необратимой слепоты в мире. По данным на 2020 г., среди лиц старше 50 лет из-за глаукомы ослепло около 3,6 млн человек, а снижение зрения до 0,33 или ниже было зафиксировано у 4,1 млн человек [1]. К 2040 г. общее число больных глаукомой может достичь 111,8 млн человек [2].
В силу особенностей возникновения и развития глаукому относят к хроническим неизлечимым заболеваниям, однако ее прогрессирование возможно остановить путем снижения внутриглазного давления (ВГД) до целевых показателей. Хотя медикаментозное и лазерное лечение в большинстве случаев позволяет достичь безопасного уровня ВГД, хирургическое вмешательство остается наиболее надежным способом достижения продолжительной компенсации офтальмотонуса.
Гипотоническая макулопатия (ГМ) ассоциирована с крайне низким уровнем ВГД, которое развивается при определенных состояниях: травме, дисфункции цилиарного тела, отслойке сетчатки и в ряде других случаев, а также при избыточной фильтрации внутриглазной
жидкости после антиглаукомных вмешательств. Критерии гипотонии неоднородны: так называемая «статистическая» гипотония описывается как значение ВГД, которое ниже нормального на 2 мм рт. ст. или 2 стандартных отклонения — 10,1 мм рт. ст. [3] и 6,5 мм рт. ст. [4] соответственно. Описана также хроническая гипотония, определяемая как уровень ВГД менее 6 мм рт. ст. на протяжении не менее 3 мес. [5]. Однако для клинической практики более значимо наличие структурных изменений, которые влияют на зрительные функции. По данным разных авторов, у пациентов с послеоперационной гипотонией ГМ развивается в 10–33% случаев [6–8], при этом применение антиметаболитов в хирургии глаукомы увеличивает частоту развития этой патологии [6, 9–11].
На сегодняшний день имеется небольшое количество исследований, посвященных изучению состояния макулярной области в условиях избыточной офтальмогипотензии, индуцированной хирургическим вмешательством, с помощью оптической когерентной томографии (ОКТ) [12, 13]. K. Azuma et al. [14] выявили ГМ в 17 (15,2%) глазах из 112 после успешной трабекулэктомии с шунтом Ex-PRESS со снижением ВГД более чем на 30% либо ниже 14 мм рт. ст. В большинстве случаев ГМ, наблюдаемая на ОКТ, не визуализировалась на фундус-фотографиях, при этом признаки ГМ на ОКТ могли определяться уже при снижении ВГД ниже 10 мм рт. ст. Большинство же более ранних публикаций посвящено описанию картины ГМ на ОКТ на малых выборках (до 14 глаз) [15–18]. Авторы вышеупомянутых работ указывают на высокую чувствительность и большую клиническую значимость ОКТ для раннего выявления ГМ. Однако ни в одной из имеющихся работ не использованы возможности ОКТ-ангиографии (ОКТ-А) для оценки изменений сосудистого русла сетчатки при ГМ. С учетом того, что классическая клиническая картина ГМ (интра- или субретинальная жидкость при наличии хориоретинальных складок и утолщении макулярной области) предполагает участие сосудистого русла сетчатки, обследование таких пациентов с помощью ОКТ-А позволит расширить знания о патогенезе ГМ.
Цель исследования: изучить изменения микрососудистого русла сетчатки в условиях ГМ после НГСЭ.
Материал и методы
В отделе глаукомы ФГБНУ «НИИГБ» нами проведено нерандомизированное проспективное обследование 35 пациентов (35 глаз) с диагнозом «первичная открытоугольная глаукома» (ПОУГ) II и III стадии, которым по медицинским показаниям было проведено хирургическое лечение. Клинические данные пациентов представлены в таблице 1.
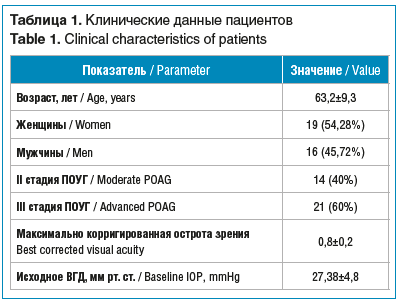
В исследование включали пациентов с ВГД менее 10 мм рт. ст. на следующий день после антиглаукомной операции, соответствовавших основным критериям включения: наличие развитой и далекозашедшей стадии ПОУГ, достаточная прозрачность оптических сред глаза, позволяющая получить качество ОКТ-сигнала не менее 7 баллов из 10, отсутствие в анамнезе других глазных заболеваний и интраокулярной хирургии (не считая неосложненной факоэмульсификации), нормальный уровень артериального давления на момент проведения исследования.
Показанием к операции было наличие прогрессирующей оптиконейропатии на фоне субкомпенсированного и декомпенсированного ВГД на максимально переносимом гипотензивном режиме. Во всех случаях была выполнена непроникающая глубокая склерэктомия (НГСЭ) по стандартной методике.
Всем пациентам до включения в исследование было проведено комплексное офтальмологическое обследование. Остроту зрения оценивали с помощью визометрии стандартным методом с использованием проектора оптотипов и набора корригирующих стекол. Уровень ВГД определяли с помощью бесконтактного тонометра (Reichert 7, США).
Наряду с проведением стандартного ОКТ-исследования перипапиллярной и макулярной областей (оценка структурных параметров — толщина комплекса ганглиозных клеток сетчатки в макуле и слоя нервных волокон сетчатки в перипапиллярной области) также проводили ОКТ в режиме ангиографии (Optopol, OPTOPOL Technology Sp., Польша). При этом оценивали плотность сосудов (vessel density, VD) на уровне радиальной перипапиллярной сети (РПС) на сканах диска зрительного нерва (зона сканирования 4×4 мм) и на уровне поверхностного сосудистого сплетения (ПСС) на снимках макулярной области (зона сканирования 6×6 мм). Также измеряли площадь фовеолярной аваскулярной зоны (ФАЗ) на сканах 3×3 мм. Исследование проводили до НГСЭ и на следующий день после операции.
Статистическая обработка выполнена в программном комплексе IBM SPSS. Проверка нормальности распределения проведена с помощью критерия Шапиро — Уилка и оценки асимметрии и эксцесса. Сравнение исследуемых критериев выполнено с помощью критерия ранговых знаков Вилкоксона. Корреляции показателей рассчитывали с помощью коэффициента Спирмана.
Результаты исследования
На момент послеоперационного осмотра в результате НГСЭ гипотензивный эффект был достигнут у всех пациентов. Ни у одного пациента не наблюдали интраоперационных и ранних послеоперационных осложнений. В среднем ВГД было снижено на 17,7±8,3 мм рт. ст. Анализ полученных данных всех пациентов показал выраженную дисперсию исследуемых показателей микроциркуляции (табл. 2).
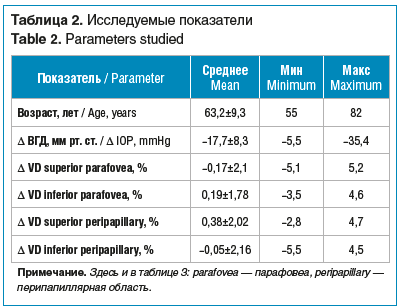
Сравнительная оценка послеоперационных изменений кровотока сетчатки позволила разделить пациентов на 2 группы. В 1-ю группу вошли 15 глаз (42,9%) с отрицательной динамикой показателей ОКТ-А, во 2-ю группу — 17 глаз (48,5%) с положительной динамикой. У 3 (8,6%) пациентов не было выявлено изменений исследуемых показателей.
Степень снижения ВГД была сопоставима в обеих группах (-15,5 мм рт. ст. и -15,4 мм рт. ст.). Не было выявлено статистически значимой корреляции между степенью снижения ВГД или его послеоперационными значениями с динамикой показателей ОКТ-А.
Наиболее выраженная отрицательная динамика у пациентов 1-й группы наблюдалась как в верхней, так и в нижней половине ПСС в парафовеолярной области (табл. 3), в слое РПС наблюдались меньшие изменения VD. Во 2-й группе отрицательная динамика в равной степени присутствовала в РПС и ПСС.
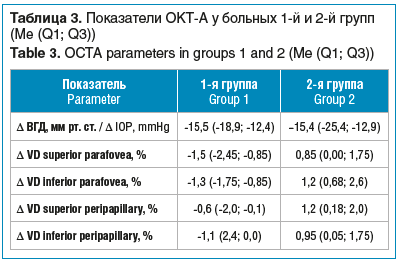
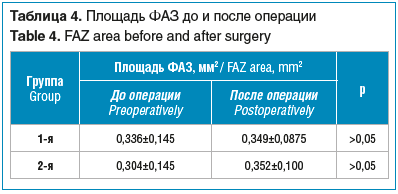
В обеих группах не было выявлено статистически значимого изменения площади ФАЗ после хирургического вмешательства (табл. 4).
Приводим клинические наблюдения.
Клиническое наблюдение 1
Пациентка, 62 года, диагноз OD — ПОУГ II cт. Из анамнеза: в течение последних 6 мес. принимает аналог простагландинов и фиксированную комбинацию бета-блокатора и ингибитора карбоангидразы. Страдает ишемической болезнью сердца, гипертонической болезнью I ст. При осмотре: МКОЗ 1,0, роговично-компенсированное ВГД 31,7 мм рт. ст., передняя камера средней глубины, угол передней камеры (УПК) открыт, экзогенная пигментация, пигментная кайма радужки разрушена, псевдоэксфолиации, начальные помутнения хрусталика, диск зрительного нерва бледный, отношение экскавации к диску 0,7.
Пациентке выполнена НГСЭ, операция и ранний послеоперационный период — без осложнений, ВГД после операции — 7,4 мм рт. ст. На ОКТ-А после операции визуализируется уменьшение плотности сосудов перипапиллярного и парафовеолярного русла (рис. 1, 2).
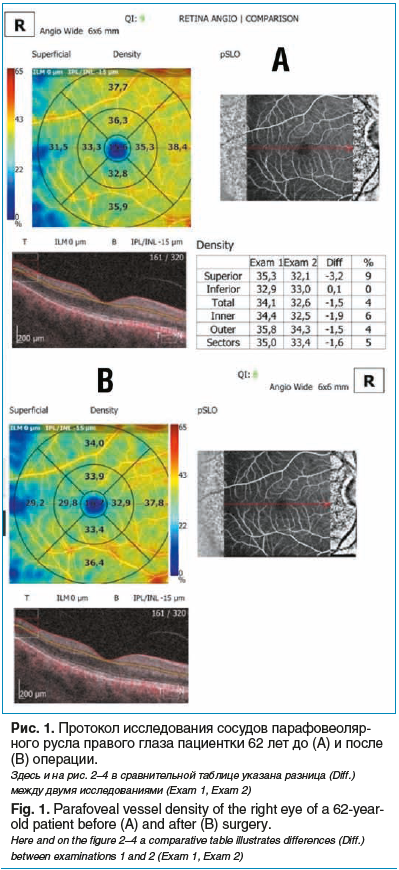
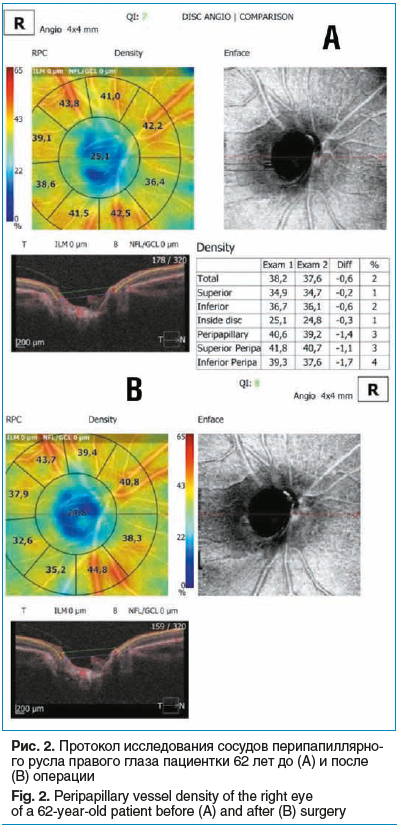
Клиническое наблюдение 2
Пациентка, 67 лет, диагноз OS — ПОУГ III cт. Из анамнеза: в течение последних 4 мес. принимает аналог простагландинов и фиксированную комбинацию бета-блокатора и ингибитора карбоангидразы. Страдает ишемической болезнью сердца, гипертонической болезнью II ст., бронхиальной астмой I ст. При осмотре: МКОЗ 0,8, роговично-компенсированное ВГД 31,2 мм рт. ст., передняя камера средней глубины, УПК открыт, экзогенная пигментация, пигментная кайма радужки частично разрушена, начальные помутнения хрусталика, диск зрительного нерва бледный, отношение экскавации к диску 0,8 с отсутствием нейроретинального пояска в височном сегменте.
Пациентке выполнена НГСЭ, операция и ранний послеоперационный период — без осложнений, ВГД после операции — 8,5 мм рт. ст. По данным ОКТ-А визуализируется увеличение плотности сосудов перипапиллярного и парафовеолярного русла после операции (рис. 3, 4).
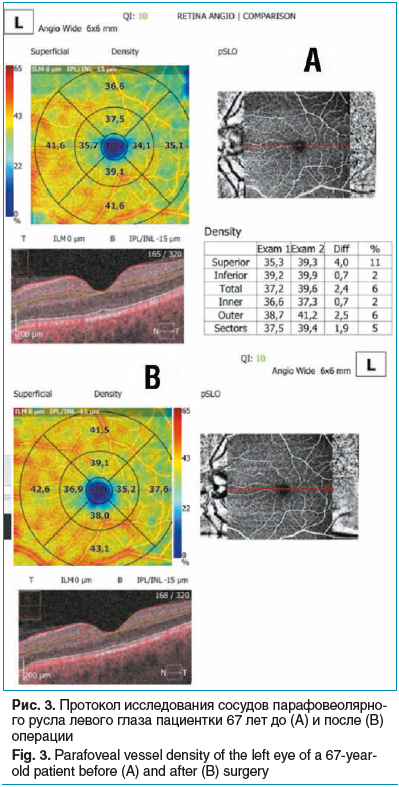
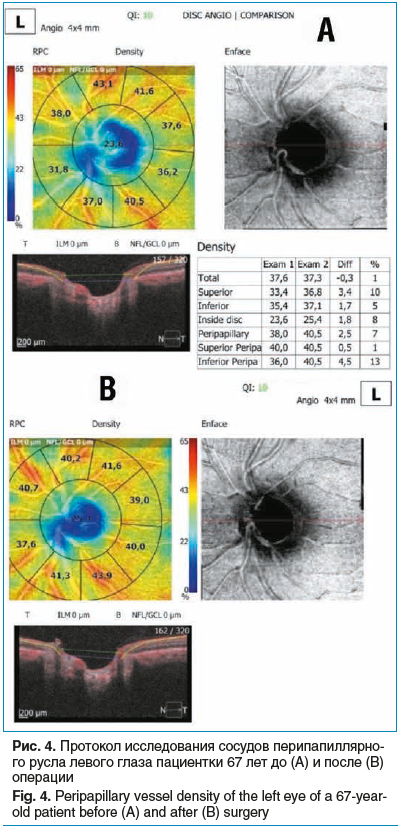
Обсуждение
Влияние ВГД на кровообращение в сетчатке в настоящее время изучено недостаточно, а имеющиеся данные противоречивы. Ранее подобные исследования проводили с изучением ретробульбарного кровотока [19]. С появлением ОКТ-А стало возможным неинвазивное (в отличие от флюоресцентной ангиографии) изучение микроциркуляторного русла сетчатки, которое, как отмечено ранее, обладает высокой диагностической значимостью, особенно у пациентов с ПОУГ.
В ряде исследований [20–22] не была выявлена зависимость между уровнем ВГД и параметрами ОКТ-А. Другие авторы [23, 24] при изучении влияния снижения ВГД (вследствие медикаментозной терапии) на параметры ОКТ-А отмечали положительную динамику показателей гемоперфузии. Так, E. Chihara et al. [25] сравнивали использование ингибиторов Rho-киназы и агониста α2-адренорецепторов бримонидина, описывая более выраженное улучшение параметров ОКТ-А при применении первого в сравнении с бримонидином. Однако недостатком данных работ является невозможность исключения прямого действия препаратов на кровоток глаза.
Число исследований влияния послеоперационной гипотонии на кровоток глаза ограничено: в зарубежной литературе представлены единичные данные исследований по этой тематике, при этом во всех работах выполняемым хирургическим вмешательством была трабекулэктомия. Так, C. Lommatzsch et al. [26] не обнаружили значимой разницы параметра VD до трабекулэктомии и через 6 мес. Отсутствие выраженных изменений параметров ОКТ-А также было отмечено в исследовании P. Zéboulon et al. [27]. Единственное статистически значимое изменение было зафиксировано в нижневисочной области макулярной зоны, в которой после операции наблюдали снижение параметра VD. Как известно, при развитии глаукомы этот сегмент наиболее уязвим. T.W. Ch’ng et al. [28] провели исследование микроциркуляции сетчатки с помощью ОКТ-А с самым большим сроком наблюдения, составившим 12 мес. В макулярной зоне через 1 мес. после операции было выявлено снижение плотности сосудов. При дальнейшем наблюдении к 6-му месяцу показатель возвращался к нормальным значениям, но к 12-му месяцу параметр VD уменьшался вновь. Авторы предполагают наличие нарушений механизма ауторегуляции кровотока у пациентов с ПОУГ. В исследовании J.W. Shin et al. [29] на 31 пациенте с ПОУГ изучили VD до и после трабекулэктомии одновременно с изменениями глубины решетчатой пластинки (РП). Улучшение микроциркуляции крови в перипапиллярной сетчатке наблюдалась у 19 (61,3%) пациентов, при этом была выявлена достоверная корреляция увеличения плотности сосудов с максимальным уменьшением глубины расположения РП (отношение шансов 1,062 при p=0,026). В связи с этим авторы делают предположение о большем влиянии на кровоток перипапиллярной области биомеханических параметров, чем уровня снижения ВГД. Подобные выводы о значимости биомеханических изменений были сделаны в исследовании J.A. Kim et al. [30], однако авторы не обнаружили послеоперационного изменения ангиографических показателей в преламинарной ткани, перипапиллярной сетчатке и хориоидее. Показатель VD значимо достоверно увеличился (с 10,21% до 11,88%; p=0,006) только в зоне РП, причем отмечалась положительная корреляция со степенью уменьшения индекса кривизны РП.
Т.Н. Юрьева и соавт. [31] оценивали хориоретинальный кровоток после НГСЭ. Как и в нашем исследовании, авторы отмечали как положительную, так и отрицательную динамику параметра VD. При этом отрицательная динамика отмечена в глазах с выраженной послеоперационной гипотонией (2,8–4,3 мм рт. ст.), в остальных случаях динамика была положительная. В нашем исследовании корреляции с уровнем ВГД обнаружено не было. Различие результатов в вышеуказанных исследованиях можно объяснить небольшой величиной выборки, различным средним уровнем ВГД до операции, а соответственно, и различной степенью его снижения в результате хирургического вмешательства; использованием разных томографов, а также отсутствием учета эффекта возможного влияния других факторов (например, антиглаукомных препаратов).
Область сетчатки в пределах макулы, в которой отсутствуют капилляры, называют ФАЗ. Именно эта область ответственна за центральную остроту зрения [32]. Площадь ФАЗ у здоровых людей молодого возраста составляет в среднем 0,32±0,11 мм2 у женщин и 0,23±0,09 мм2 у мужчин (при измерении площади ФАЗ на уровне ПСС) [33]. Данный параметр зависит от пола, возраста, переднезадней оси глаза и толщины макулярной области [34, 35]. У пациентов с глаукомой площадь ФАЗ по сравнению с таковой у здоровых лиц увеличена [36]. Было показано, что площадь ФАЗ у больных глаукомой больше в глазах с центральным дефектом полей зрения [37]. В нашем исследовании площадь ФАЗ у большинства пациентов до операции находилась в пределах нормальных значений. В отличие от описанной выше работы T.W. Ch’ng et al. [28], в нашем исследовании не происходило статистически значимого изменения площади ФАЗ после операции. Однако при этом стоит учитывать разный объем хирургического вмешательства в сравниваемых исследованиях.
Нашему исследованию свойственны некоторые ограничения. Малое число пациентов, включенных в исследование, объясняется сложностью выполнения исследования ОКТ-А у пациентов с ПОУГ (проведение исследования без расширения зрачка, сложность неподвижной фиксации взора у пациентов с выраженными изменениями полей зрения). В исследуемую группу мы включали пациентов с компенсированным уровнем артериального давления, но не оценивали наличие и объемы применяемых системных препаратов, которые могли искажать результаты исследования, а также наличие сопутствующих заболеваний, таких как сахарный диабет. Также сложно оценить потенциальное влияние применения антиглаукомных препаратов на микроциркуляцию глаза. Вследствие этических и медицинских причин невозможно отменить гипотензивный режим для исключения влияния данного фактора. Факторы, непосредственно связанные с хирургическим вмешательством (нанесение разрезов на склеру, воспалительная реакция, применение цитостатиков и послеоперационных противовоспалительных лекарственных средств), вероятнее всего, также в некоторой мере связаны с изменением микроциркуляции сетчатки. Наконец, следует учитывать ограничения, связанные непосредственно с ОКТ-А и техническими возможностями прибора. На сегодняшний день рассчитываемые прибором количественные показатели (VD, ФАЗ и др.) остаются очень изменчивыми. Плавающие помутнения в стекловидном теле, анатомические послеоперационные изменения (репозиция перипапиллярной склеры [38], изменение экскавации диска зрительного нерва [39], изменение структуры сетчатки в условиях гипотонии) не учитываются современной версией томографа при сравнении в режиме follow-up. Кроме того, согласно данным H.B. Lim et al. [40], для качественного сравнения двух снимков сила сигнала должна быть абсолютно идентичной и составлять как минимум 9 баллов из 10 согласно встроенной в прибор системе оценки.
Заключение
В статье представлены наши первые результаты в рамках исследования изменений ретинального кровотока после НГСЭ у пациентов с диагнозом ПОУГ методом ОКТ-А. Выявлено снижение показателей ОКТ-А в 42,9% случаев и положительная динамика в 48,5%. Результаты ОКТ-А после НГСЭ не коррелировали с уровнем ВГД. Наиболее выраженная отрицательная динамика плотности сосудов наблюдалась как в верхней, так и в нижней половине в парафовеолярной области, в слое РПС наблюдались меньшие изменения VD. Положительная динамика в равной степени присутствовала в РПС и ПСС. Поскольку снижение ВГД в результате антиглаукомной операции может оказывать как положительное, так и отрицательное влияние на микрососудистое русло сетчатки, не зависящее от уровня ВГД, получаемые данные позволяют выбрать адекватную стратегию пред- и послеоперационного ведения индивидуально для каждого пациента. Актуальным представляется дальнейшее исследование возможных прогностических факторов изменений ретинального кровотока, а также их непосредственное влияние на течение глаукомы.
Сведения об авторах:
Еричев Валерий Петрович — д.м.н., профессор, заведующий отделом глаукомы; ORCID iD 0000-0001-6842-7164.
Антонов Алексей Анатольевич — к.м.н., ведущий научный сотрудник отдела глаукомы; ORCID iD 0000-0002-5171-8261.
Витков Александр Александрович — младший научный сотрудник отдела глаукомы; ORCID iD 0000-0001-7735-9650.
Рагозина Екатерина Александровна — младший научный сотрудник отдела глаукомы; ORCID iD 0000-0002-6980-4563.
Волжанин Андрей Вячеславович — к.м.н., младший научный сотрудник отдела глаукомы; ORCID iD 0000-0002-1421-8882.
ФГБНУ «НИИГБ». 119021, Россия, г. Москва, ул. Россолимо, д. 11а, б.
Контактная информация: Витков Александр Александрович, e-mail: avitkov.niigb@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.08.2021.
About the authors:
Valeriy P. Erichev — Dr. Sc. (Med.), Professor, Head of the Division of Glaucoma; ORCID iD 0000-0001-6842-7164.
Aleksey A. Antonov — C. Sc. (Med.), leading researcher of the Division of Glaucoma; ORCID iD 0000-0002-5171-8261.
Aleksandr A. Vitkov — junior researcher of the Division of Glaucoma; ORCID iD 0000-0001-7735-9650.
Ekaterina A. Ragozina — junior researcher of the Division of Glaucoma; ORCID iD 0000-0002-6980-4563.
Andrey A. Volzhanin — C. Sc. (Med.), junior researcher of the Division of Glaucoma; ORCID iD 0000-0002-1421-8882.
Scientific Research Institute of Eye Diseases, 11A, B, Rossolimo str., Moscow, 119021, Russian Federation
Contact information: Aleksandr A. Vitkov, e-mail: avitkov.niigb@gmail.com.
Financial Disclosure: no author has a financial or property interest in any material or methodmentioned.
There is no conflict of interests.
Received 30.08.2021.
.
материал rmj.ru
