Введение
Муковисцидоз (МВ) — это частое моногенное заболевание, обусловленное мутациями гена CFTR (МВТР). МВ характеризуется мультисистемной патологией, при которой микрофлора дыхательных путей является главной причиной развития осложнений и летальности. Микрофлора, вызывающая воспалительный процесс в легких при МВ, уникальна и практически не встречается при других заболеваниях [1]. Профиль микробиома также является важным фактором прогрессирования патологического процесса.
За последние 20 лет эпидемиология бактерий, участвующих в острых инфекциях при МВ, становится все более сложной. Pseudomonas aeruginosa, Staphilococcus aureus и Haemophilus influenzae были и остаются достаточно распространенными возбудителями инфекционного воспаления нижних дыхательных путей пациентов с МВ. Вместе с тем новые опасные патогены, такие как Burkholderia cepacia complex (ВCC), Achromobacter xylosoxidans, грибы рода Aspergillus ѕрр., приобретают все большее значение в последние годы [2].
Часть возбудителей — это условно-патогенные микроорганизмы, которые приобрели наибольшую актуальность в последние 10 лет, именно к этой группе относятся
A. xylosoxidans и ВСС. Их появление требует соблюдения мер профилактики не только в медицинских учреждениях, но и в амбулаторных условиях. Заражение ВCC, A. xylosoxidans., P. aeruginosa и метициллин-резистентным золотистым стафилококком (Methicillin Resistant S. aureus, MRSA) происходит преимущественно воздушно-капельным путем, источником при этом являются другие больные МВ. Возможна также передача возбудителя между пациентами через загрязненные при кашле руки. Пациенты, выделяющие бактерии ВСС, Achromobacter spp., P. aeruginosa и MRSA, могут также обсеменять ими больничные помещения и оборудование для респираторной терапии.
Первое упоминание о выделении Achromobacter spp. у пациента с МВ относится к 1985 г. [3]. Представители рода Achromobacter — грамотрицательные неферментирующие микроорганизмы, способные вызывать оппортунистические инфекции (оксидазо- и каталазоположительные) и, что наиболее важно, обладающие природной устойчивостью ко многим антибиотикам.
До 2011 г., когда начал действовать проект ежегодного регистра МВ, в Российской Федерации не контролировались структура и динамика распространения респираторной микрофлоры. Меры профилактики были недостаточными и не предупреждали перекрестного инфицирования больных МВ такими бактериями, как ВСС и Achromobacter spp., о чем свидетельствовали многочисленные вспышки заболевания у пациентов в различных стационарах на территории Российской Федерации. Эпидемиологический контроль за неферментирующей грамотрицательной флорой позволил зафиксировать внутрибольничные вспышки инфекции, вызванные данными микроорганизмами. Важно отметить в контексте диагностирования хронической инфекции дыхательных путей, что у пациентов с МВ очень часто A. xylosoxidans ложно диагностируют как BCC из-за фенотипического сходства при культивировании на 5% кровяном агаре и роста на cелективном для ВСС агаре [4]. Для подтверждения принадлежности бактерии к роду Achromobacter необходимо использовать тест-системы MALDI-TOFF. Методика масс-спектрометрического анализа для проведения MALDI-TOFF прямого белкового профилирования неспорообразующих микроорганизмов имеет решающее значение. Значимость корректной микробиологической диагностики при МВ в регионах Российской Федерации отдельно отмечено и в Национальном консенсусе «Муковисцидоз: определение, диагностические критерии, терапия» [5].
В отличие от терапии синегнойной инфекции, пока не разработано эффективных, с высокой степенью доказательности схем антибактериальной терапии для других неферментирующих грамотрицательных микроорганизмов. Для Российской Федерации, в отличие от других стран, характерна высокая частота данной инфекции, что обусловливает актуальность и необходимость организации идентификации ВСС и A. xylosoxidans и мониторинга их антибиотикорезистентности [6].
Обращает на себя внимание рост высева Achromobacter spp. у пациентов после пересадки легких [7], а также увеличение случаев инфицирования в последние годы у пациентов с бронхоэктатической болезнью и болезнью Картагенера [8, 9]. Антибиотикотерапия не всегда приводит к эрадикации бактерий, в связи с чем формируется хроническая инфекция легких, обусловленная персистенцией мультирезистентных клонов бактерий, и больные МВ, являясь источником таких бактерий, находятся в группе риска по тяжелому течению заболевания, а также представляют опасность для контактных лиц. Таким образом, мониторинг локальной эпидемиологической ситуации и изучение динамики чувствительности современных патогенных микроорганизмов при МВ являются критически важными.
Цель исследования — оценить частоту инфицирования и резистентность выделенного A. xylosoxidans к карбапенемам у взрослых пациентов с МВ за период в 5 лет (2016–2020 гг.).
Материал и методы
Был проведен ретроспективный анализ микробиологических образцов, полученных от 58 пациентов старше 18 лет (32 (55,2%) мужчины и 26 (44,8%) женщин; средний возраст — 27,21 года; диапазон 18–62 года), проживающих в Санкт-Петербурге и Ленинградской области, с установленным диагнозом МВ согласно стандартным критериям Европейского общества муковисцидоза, регулярно посещающих центр МВ в СПб ГБУЗ «ГМПБ № 2».
Образцы мокроты были собраны в период с января 2016 г. по декабрь 2020 г. Диагноз МВ был поставлен на основе стандартных методов (результаты теста на хлориды пота выше 60 ммоль/л с пилокарпином и две соответствующие мутации трансмембранного регулятора гена МВ). Частота микробиологического исследования образцов мокроты у пациентов с МВ составляла 1 раз в 3 мес. Исследовалась свободно отделяемая мокрота как оптимальный биоматериал для микробиологического исследования респираторных инфекций [10]. Сбор и транспортировка образцов биоматериала проводились согласно методическим указаниям [11].
Основным методом диагностики хронической респираторной инфекции являлся культуральный метод с посевом респираторных образцов на неселективные, селективные и хромогенные питательные среды (рекомендуемые питательные среды для основных этиологически значимых микроорганизмов респираторных инфекций при МВ [12]). Грамотрицательные бактерии, выявление которых могло вызывать трудности (A. xylosoxidans, BCC), были идентифицированы методами молекулярной идентификации (времяпролетная масс-спектрометрия MALDI-TOF MS) согласно рекомендациям [13]. Определение чувствительности микроорганизмов, выделенных от пациентов с МВ, к антибактериальным препаратам и интерпретацию результатов проводили в соответствии с Клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам» [14]. Для оценки чувствительности к имипенему и меропенему использовали метод градиентной диффузии в агар и дискодиффузионный метод.
Статистическая обработка данных проводилась с использованием программы Statistica 6.0 for Windows 7.0 от 30.11.2018. Статистическое распределение в группах отличалось от нормального во всех группах сравнения, расчет межгруппового сравнения проводился с помощью критерия Манна – Уитни. Cтатистически значимым считали уровень р<0,05.
Результаты и обсуждение
За период исследования с января 2016 г. по декабрь 2020 г. от 58 взрослых пациентов с МВ в возрасте от 18 до 61 года (медиана возраста — 27 лет (20; 33;)) было получено в общей сложности 685 проб мокроты.
На рисунке 1 приведено графическое изображение динамики респираторной флоры за период наблюдения 5 лет у единой группы пациентов (n=24) в возрасте 19–29 лет. Проводимый в течение 5 лет учет динамики микрофлоры показал закономерную ведущую роль хронической синегнойной инфекции P. aeruginosa, которая была выявлена у 50,0–54,1% пациентов. Синегнойная инфекция считается хронической, если P. aeruginosa идентифицировалась более чем в 50% образцов мокроты в течение 1 года. Высев считается интермиттирующим, если в течение предшествующего года возбудитель обнаруживался менее чем в 50% образцов мокроты. При анализе интермиттирующего высева синегнойной инфекции наблюдалось постепенное снижение выявляемости с 16,6% до 8,3%, что является характерной динамикой для взрослых пациентов с МВ. Как показано на рисунке 1, с 2018 г. отмечен тревожный экспоненциальный рост A. xylosoxidans более чем в 2 раза — от 4 (16,6%) до 9 (37,5%) пациентов в данной выборке, а также сохранение аналогичной высокой доли возбудителя в общей структуре в последующем 2019 г. Не выявлено значимой разницы (р>0,05) по возрасту пациентов в группах с хронической синегнойной инфекцией и Achromobacter spp., медиана возраста составила 26 и 28 лет соответственно.
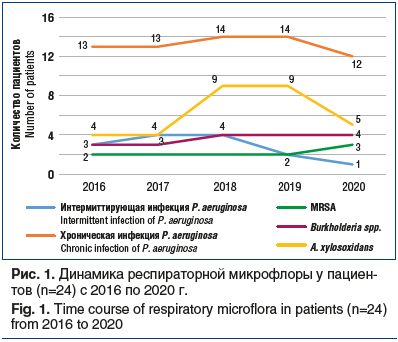
В отношении Burkhalderia spp. наблюдался меньший рост встречаемости возбудителя, максимально составивший до 16,6% в общей доле, в то время как показатель MRSA был одинаков на протяжении всего времени наблюдения, возбудитель стабильно высевался у 2 пациентов с частотой 8,3% за все 5 лет наблюдения.
Следует отметить симметричное снижение количества пациентов к концу периода наблюдения в группах больных, инфицированных синегнойной инфекцией и Achromobacter spp., что мы объясняем смертью пациентов именно в этих двух микробиологических группах: 3 больных из группы Achromobacter spp. умерли в 2020 г., так же как и 1 пациент из группы хронической синегнойной инфекции. Все погибли от прогрессирования основного заболевания. В контексте обсуждения смертельных исходов в период пандемии COVID-19 в 2020 г. необходимо уточнить, что клиническая картина у 4 умерших пациентов была характерна для тяжелого обострения МВ, вызванного тяжелой бактериальной инфекцией, и не соответствовала клинико-рентгенологическим признакам коронавирусной инфекции COVID-19. Также все 4 пациента проходили неоднократное лабораторное исследование назофарингеальных мазков методом полимеразной цепной реакции на SARS-CoV-2 в период обострения, приведшего к летальному исходу, и результаты тестов были отрицательными во всех случаях. Таким образом, самая высокая летальность наблюдалась в группе больных с Achromobacter spp. — 12,5% к пятому году наблюдения, в группе хронической синегнойной инфекции она была меньше, чем в первой, и составила 4,1% к пятому году наблюдения.
На рисунке 2 представлена видовая структура респираторной микрофлоры всех 58 взрослых пациентов с МВ, наблюдавшихся в центре СПб ГБУЗ «ГМПБ № 2» за период 2016–2020 гг., с учетом ежегодного роста количества пациентов. Часть из них (18 (70,8%) человек от всех новых пациентов за период 2016–2020 гг.) перешли из детской сети, часть — поступили на учет в центр при первичном выявлении заболевания во взрослом возрасте (в 2018 г.1 пациент в возрасте 35 лет, в 2019 г. 3 пациента в возрасте 21, 30 и 41 год соответственно) или по причине переезда пациентов с МВ из других регионов РФ с уже установленным диагнозом в возрасте младше 18 лет, наблюдавшихся до этого в других центрах МВ (по 1 пациенту в 2016, 2017 и 2019 гг. соответственно).
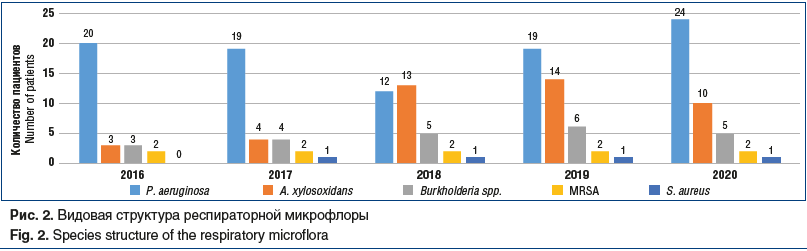
Полученные данные, представленные на рисунке 2, согласуются по структуре распределения флоры и ее динамики с данными рисунка 1 и не противоречат общемировой тенденции микробиологического спектра взрослых пациентов с МВ, у которых доминирует хроническая синегнойная инфекция, далее A. xylosoxidans и BCC. Интересно отметить единственного пациента 20 лет (генотип F508del/394delTT), у которого на протяжении периода наблюдения микрофлора была представлена изолированно S. aureus, что коррелировало со стабильным течением среднетяжелой формы МВ, редкими обострениями (менее 1 раза в год) и нормальным функциональным статусом. С 2016 по 2020 г. (рис. 2) частота выделения P. aeruginosa остается примерно одинаковой, колеблется от 63,3% до 46,5%, сохраняя численный перевес во всех периодах наблюдения, а распространенность A. xylosoxidans — в пределах от 13,7% до 39,3%.
Обращает на себя внимание смена соотношения высеваемых микроорганизмов в сторону увеличения доли A. xylosoxidans с сохранением видового состава при анализе как динамики единой выборки на протяжении 5 лет, так и общего пула наблюдающихся пациентов с МВ.
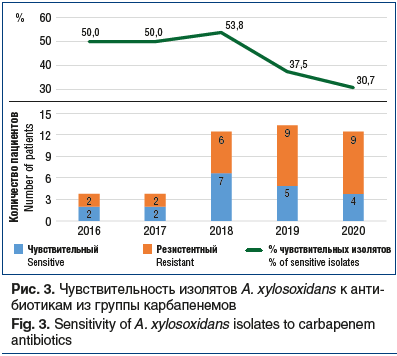
Результаты оценки динамики резистентности A. xylosoxidans к карбапенемам (рис. 3) являются неутешительными. При сравнительном анализе активности карбапенемов (имипенем, меропенем) в отношении A. xylosoxidans в период 2016–2017 гг. выявлены следующие закономерности. Карбапенемы были активны в отношении 50% штаммов A. xylosoxidans. В 2018 г. карбапенемы также демонстрировали достаточно высокую чувствительность к исследуемому микроорганизму, но в 2019–2020 гг. активность снизилась до 37,5% и 30,7% соответственно, что значительно ниже, чем в предыдущие годы.
Доля взрослых пациентов с МВ в Санкт-Петербурге в 2019 г., согласно Регистру больных муковисцидозом РФ [15], составила 27,6%, а общая доля всех таких пациентов в Санкт-Петербурге в общероссийском регистре составляет 5,1%, что является вторым по численности значением после г. Москвы.
При оценке динамики показателей национального регистра по муковисцидозу 2011–2019 гг. c 2014 г. учитывается частота инфицирования больных МВ Achromobacter spp. Отмечается тенденция к росту ее распространенности с 3,2% в 2014 г. до 4,6% к 2017 г. и 6,6% в 2019 г. Распространенность других патогенов остается приблизительно одинаковой [16]. Согласно данным регистра с 2011 г. по 2016 г. частота выделения S. aureus, P. aeruginosa, ВСС у больных МВ в динамике была практически на одинаковом уровне [15].
Следует подчеркнуть, что у пациентов с МВ в последние годы во всем мире увеличивается распространенность A. xylosoxidans [17]. Согласно результатам нашего исследования, несмотря на максимальную летальность именно в группе A. xylosoxidans, убедительно не доказана зависимость между данной хронической инфекцией и летальными исходами в изучаемой выборке.
За последнее десятилетие в мире возросла выживаемость пациентов с МВ (средний возраст — более 30 лет), и, соответственно, появились новые возбудители инфекционного процесса в респираторной микрофлоре у больных МВ. Доля больных МВ, инфицированных A. xylosoxidans, по стране на 2019 г. составила 6,6% [15], что занимает третье место по численности после S. aureus и P. aeruginosa и доказывает значение этого возбудителя с учетом его патогенности для больных МВ. На долю
A. xylosoxidans приходилось 52% инфекций среди инфекций, вызванных Achromobacter spp. [18], в то время как, согласно нашим данным, все выявленные изоляты соответствовали виду A. xylosoxidans.
Как подчеркивается в современных исследованиях [19, 20], интенсивное применение антибиотиков может быть одним из факторов, повышающих вероятность оппортунистических инфекций резистентными микроорганизмами.
Мы обнаружили в нашей когорте исследуемых высокую распространенность инфекции A. xylosoxidans (15,5% из всех 58 пациентов), что выше, чем в европейских исследованиях (8,8% [21]. Причина высокой распространенности A. xylosoxidans в нашей популяции, вероятно, связана с более высоким средним возрастом пациентов нашей выборки. Около 12% больных (7/58) умерли в исследуемый период, 4 пациента были хронически инфицированы A. xylosoxidans, 3 пациента — P. aeruginosa. Минимальная доля пациентов с чувствительными изолятами A. xylosoxidans к карбапенемам составила 30,7%.
Таким образом, появление и распространение данного патогена можно связать с совершенствованием методов идентификации микроорганизмов в мокроте пациентов с МВ, кроме того, существенное влияние оказало как увеличение продолжительности жизни пациентов, так и широкое применение ингаляционной антибактериальной терапии у них. Численность пациентов, инфицированных
A. xylosoxidans, в нашей выборке выше, чем в целом по России. При сопоставлении с европейскими данными наши показатели также демонстрируют более высокое значение частоты встречаемости A. xylosoxidans [18].
В заключение можно резюмировать, что за 15-летний период мирового наблюдения (с 2000 г. до 2015 г.) видовой состав микрофлоры дыхательного тракта у больных МВ не изменился, однако значительно поменялось соотношение высеваемых микроорганизмов. Установленная нами изменчивость чувствительности к карбапенемам (имипенем, меропенем) является клинически и эпидемиологически значимой и указывает на необходимость мониторинга антибиотикорезистентности в динамике для эффективного лечения пациентов с МВ в условиях смены ведущей микрофлоры.
Заключение
Частота инфицирования взрослых пациентов с МВ A. xylosoxidans в динамике за 2016–2020 гг. при мониторировании единой выборки пациентов (n=24) составила от 16,6% в 2016–2017 гг. с нарастанием до 37,5% в 2018–2019 гг. и дальнейшим снижением до 20,8%, связанным с летальным исходом заболевания у 3 из 9 инфицированных пациентов. Нами не было получено статистически доказанной зависимости летального исхода от инфицирования A. xylosoxidans.
При анализе структуры общего пула пациентов за период наблюдения в 5 лет в центре СПб ГБУЗ «ГМПБ № 2», несмотря на разноплановую динамику показателей и численность выборки, сохранялась общегрупповая пропорция видов микробиома с доминированием в первую очередь синегнойной инфекции и Achromobacter соответственно.
При сравнительном анализе активности карбапенемов в отношении Achromobacter spp., а именно A. xylosoxidans, были выявлены следующие закономерности: в 2016–2018 гг. чувствительны к карбапенемам были 50% изолятов A. xylosoxidans, в 2018 г. — 53,8% изолятов, в 2019 и 2020 гг. — 37,5% и 30,7% соответственно.
В 2018 г. карбапенемы демонстрировали достаточно высокую чувствительность к исследуемому микроорганизму. В 2019–2020 гг. чувствительность снизилась до 37,5% и 30,7% соответственно, отмечен более низкий показатель, чем в предыдущие годы, активность снизилась почти вдвое (на 43%) за 5 лет.
Учитывая тенденцию к росту антибиотикорезистентности респираторной микрофлоры при МВ, отсутствие новых классов антимикробных препаратов, критично важной остается необходимость эффективной ежедневной муколитической терапии. Из-за дефектов эпителия при переносе ионов воды происходят нарушения клиренса и адгезии слизи к поверхности дыхательных путей. Увеличение секреции и вязкости мокроты приводит к формированию порочного круга поражения легких при МВ: обструкция, воспаление и инфекция, а также раннее поражение мелких дыхательных путей с последующим развитием бронхоэктазов. Аэрозольный раствор дорназа альфа в сочетании с кинезитерапией обладает потенциальными преимуществами за счет улучшения мукоцилиарного клиренса, уменьшения обструкции, снижения частоты обострения хронического инфекционного процесса.
Структура и динамика респираторной микрофлоры взрослых пациентов с МВ, ее чувствительность к антибактериальным препаратам претерпевают изменения ввиду увеличения продолжительности жизни больных МВ и требуют дальнейшего мониторинга и изучения.
Сведения об авторах:
Махмутова Виктория Ринатовна — врач-пульмонолог пульмонологического отделения № 2 СПб ГБУЗ «ГМПБ
№ 2»; 194354, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-1105-1204.
Гембицкая Татьяна Евгеньевна — д.м.н., профессор, руководитель отдела терапевтической пульмонологии НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-2293-3739.
Черменский Алексей Георгиевич — к.м.н., старший научный сотрудник НИИ пульмонологии ФГБОУ ВО ПСПбГМУ
им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-1487-4182.
Титова Ольга Николаевна — д.м.н., профессор, директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-4678-3904.
Кузубова Наталия Анатольевна — д.м.н., заместитель директора НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-1166-9717.
Контактная информация: Махмутова Виктория Ринатовна, e-mail: eladaspb@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 05.07.2021.
Поступила после рецензирования 28.07.2021.
Принята в печать 20.08.2021.
About the authors:
Victoria R. Makhmutova — pulmonologist of the Department of Pulmonology No. 2, Multidisciplinary Сity Hospital No. 2; 5, Ucheblyi Lane, St. Petersburg, 194354; Russian Federation; ORCID iD 0000-0002-1105-1204.
Tatiana Y. Gembitskaya — Dr. Sc. (Med.), Professor, Head of the Department of Therapeutic Pulmonology of the Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-2293-3739.
Alexey G. Chermensky — C. Sc. (Med.), Senior Researcher at the Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-1487-4182.
Olga N. Titova — Dr. Sc. (Med.), Professor, Director of the Research Institute of Pulmonology, I.P. Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Natalia A. Kuzubova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Pulmonology, I.P. Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Contact information: Victoria R. Makhmutova, e-mail: eladaspb@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 05.07.2021.
Revised 28.07.2021.
Accepted 20.08.2021.
.
материал rmj.ru
