Содержание статьи
Введение
Результаты клинических исследований по оценке эффективности сахароснижающих препаратов не рассматривают отдельно пациентов с сахарным диабетом 2 типа (СД2) и морбидным ожирением (МО), которые имеют свои характерные особенности и отличия от общей группы. Таким образом, использование в клинической практике усредненных рекомендаций и алгоритмов для конкретных пациентов с МО представляется сложным и недостаточно эффективным. В реальной клинической практике в большинстве случаев встречаются пациенты с СД2 и МО, у которых не удается достичь компенсации углеводного обмена и снизить массу тела, несмотря на массивное и агрессивное назначение сахароснижающих средств, а также препаратов для снижения массы тела [1]. Выбор методов лечения пациентов с СД2 требует учета многочисленных сосуществующих факторов риска, модифицирующих друг друга. Высокий уровень коморбидности меняет картину заболевания и затрудняет диагностику, увеличивает тяжесть течения и ухудшает прогноз [2]. Очевидно, что выбор варианта сахароснижающей терапии (ССТ) у пациентов с СД2 и МО требует индивидуального подхода (вероятно, отличного от такового у пациентов с умеренным ожирением или его отсутствием): выбор как самого препарата, так и индивидуальных целевых значений гликемии с учетом коморбидных состояний, возраста, пожеланий пациента, типа нарушения пищевого поведения, доступных ресурсов и степени обеспечения медикаментами. При этом гликемия зачастую оказывается не самым важным фактором индивидуального прогноза. Понимание характерных особенностей пациентов с СД2 и МО сможет помочь в достижении целей лечения.
Цель исследования: изучить факторы, предопределяющие эффективность инсулинотерапии у пациентов с СД2 и МО.
Материал и методы
Исследуемые группы
Проведено исследование, состоявшее из двух частей: одномоментного поперечного исследования (скрининга) и открытого проспективного рандомизированного исследования. Критерии включения: возраст старше 18 лет, наличие СД2, по поводу которого пациенты получали ССТ, включавшую базальный инсулин (БИ), индекс массы тела (ИМТ) ≥35 кг/м2. По классификации Национального института здравоохранения, к числу пациентов с МО были отнесены пациенты с ИМТ ≥35 кг/м2
при наличии серьезных осложнений, связанных с ожирением (включая СД2), или при ИМТ >40 кг/м2 вне зависимости от наличия осложнений [3, 4]. Критерии исключения: сахарный диабет 1 типа, острый панкреатит в анамнезе (в течение последних 5 лет), беременность, кормление грудью, снижение скорости клубочковой фильтрации (СКФ) менее 45 мл/мин/1,73 м2.
В исследование был включен 141 пациент, находившийся на стационарном лечении в клинике эндокринологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава
России (Сеченовский Университет) с 2015 по 2018 г. Анализ данных проведен в 2019 г. Включенные в исследование пациенты при помощи открытой блоковой рандомизации с использованием таблицы случайных чисел были разделены на 3 группы: 1-я группа (n=61) получала агонист рецептора глюкагоноподобного пептида-1 (АР ГПП-1) в сочетании с метформином и БИ; 2-я группа (n=40) — препарат из группы производных сульфонилмочевины (ПСМ) в сочетании с метформином и БИ; 3-я группа (n=40) — базис-болюсную инсулинотерапию (ББИТ) в сочетании с метформином.
Методы обследования
Всем пациентам проводилось клиническое и лабораторное обследование, а также оценка когнитивных функций, качества жизни, пищевого поведения и особенностей сна.
Для оценки когнитивных функций применялась русскоязычная версия опросника MMSE (Mini-Mental State Examination — краткая шкала оценки психического статуса), с помощью которого оценивались ориентированность во времени и пространстве, восприятие, концентрация внимания, память, речь. Итоговый балл выводился путем суммирования результатов по каждому из пунктов: 28–30 баллов — нет нарушений когнитивных функций, 24–27 баллов — преддементные когнитивные нарушения, 20–23 балла — деменция легкой степени выраженности, 11–19 баллов — деменция умеренной степени выраженности, 0–10 баллов — тяжелая деменция [5].
Оценка пищевого поведения проводилась с использованием опросника DEBQ (Dutch Eating Behavior Questionnaire — Голландский опросник пищевого поведения), который включает 33 вопроса для оценки 3 факторов пищевого поведения: экстернального, ограничительного и эмоциогенного [6].
Оценка особенностей сна проводилась на основании результатов заполнения опросников (анкета сна; анкета скрининга синдрома апноэ во сне) и полисомнографии. По результатам полисомнографии выделялись степени тяжести синдрома обструктивного апноэ сна (СОАС): тяжелая: более 30 эпизодов апноэ/гипопноэ, средняя — 15–29 эпизодов апноэ/гипопноэ, легкая — от 5 до 14 эпизодов апноэ/гипопноэ, отсутствует — нет признаков обструктивного апноэ.
Оценка качества жизни проводилась при помощи опросника ADDQoL (Audit of Diabetes Dependent Quality of Life — Аудит диабет-зависимого качества жизни), разработанного C. Bradley и прошедшего процедуру лингвистической и психометрической валидизации для российской популяции. Опросник содержит 2 общих вопроса, 1 вопрос, подразумевающий открытый ответ, и 18 блоков вопросов о влиянии СД2 на ключевые показатели качества жизни. Показатели в каждом блоке распределены от -3 баллов (максимально негативное влияние) до +3 баллов (максимально позитивное влияние); 0 баллов свидетельствует об отсутствии влияния.
С целью оценки удовлетворенности лечением использовалась русскоязычная версия опросника DTSQ 9.6.06 (The Diabetes Treatment Satisfaction Questionnaire — Опросник
удовлетворенности лечением диабета), включающего 8 вопросов, которые позволяют оценить показатели удовлетворенности лечением по шкале от 0 до 6 баллов (чем выше балл, тем выше удовлетворенность лечением).
В качестве основных конечных точек были приняты когнитивные нарушения и нарушения пищевого поведения, особенности сна, качество жизни и удовлетворенность лечением.
Протокол исследования одобрен локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет). В исследование включены только пациенты, добровольно подписавшие форму информированного согласия на участие в исследовании.
Статистический анализ
Обработка данных проводилась с использованием описательной статистики и для количественных переменных представлена в виде медианы [1-й квартиль; 3-й квартиль], для категориальных переменных — в процентах. В качестве интервальных оценок для медиан использовались 95% доверительные интервалы (95% ДИ). Для определения различий между связанными выборками (динамики изучаемых показателей) использовался тест Вилкоксона. Для определения статистической значимости различий между группами использовался тест Краскела — Уоллиса (нулевая гипотеза об отсутствии различий отклонялась при p<0,05) с последующим применением post-hoc теста Данна (с использованием пошаговой коррекции p-значений по методу Холма).
Все этапы предобработки и анализа полученных данных выполнялись с использованием программы IBM SPSS Statistics v. 23.0 и среды для статистических вычислений R v.3.5.3 (R Foundation for Statistical Computing).
Результаты исследования
В группе 1 завершили исследование 56 пациентов, в группе 2 — 40 пациентов, в группе 3 — 40 пациентов. Характеристика участников исследования представлена в таблице 1.
![Таблица 1. Характеристика участников исследования (Me [Q25; Q75]) Таблица 1. Характеристика участников исследования (Me [Q25; Q75])](https://medblog.su/wp-content/uploads/2020/10/insulinoterapiya-pri-saharnom-diabete-2-tipa-u-patsientov-s-morbidnym-ozhireniem-faktory-effektivnoj-kompensatsii-narushenij-uglevodnogo-obmena-amosova-m-v-gurova-o-yu-glinkina-i-v-maloletkina-e-s.png)
Когнитивные нарушения различной степени были выявлены у 56,1% (95% ДИ: 47,5–64,5) пациентов с СД2 и МО. Чаще всего встречались преддементные когнитивные нарушения (44,6%), деменция была диагностирована у 11,5% пациентов.
Характеристика пищевого поведения пациентов с СД2 и МО. У подавляющего большинства пациентов — 84,4% (95% ДИ 77,3–89,9) выявлены нарушения пищевого поведения по данным опросника DEBQ.
При оценке структуры расстройств пищевого поведения обращает на себя внимание преобладание так называемой комбинированной формы расстройства (67,2% случаев), которая сочетает в себе признаки экстернального, ограничительного и эмоциогенного нарушения, что, в свою очередь, может приводить к неудачам поведенческой терапии ожирения, направленной на борьбу с определенными формами. В 13,4% случаев выявлено изолированное экстернальное нарушение пищевого поведения, в 11,8% — эмоциогенное, в 7,5% — ограничительное. Таким образом, пациенты с СД2 и МО склонны как к спонтанным приемам пищи, без ощущения физического чувства голода, так и к «срывам» из-за постоянной необходимости оценки питания.
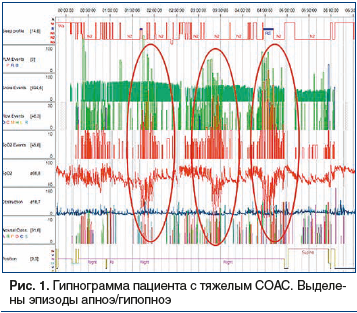
Характеристика сна пациентов с СД2 и МО. При полисомнографии у 86,9% (95% ДИ: 75,8–94,2) участников исследования диагностирован СОАС. У большинства пациентов было тяжелое течение СОАС (60,7%): более 40 эпизодов апноэ/гипопноэ за 1 ч ночного сна. На рисунке 1 — гипнограмма пациента с тяжелым течением СОАС, которая отражает типичную картину нарушений сна при МО. Время засыпания составило 40,0 мин. Общее время сна составило 5 ч 24 мин. Снижена представленность фазы быстрого сна (5,5%). Увеличено число пробуждений (63) и время бодрствования (2 ч 50 мин) в период сна. На фоне громкого храпа регистрируются множественные эпизоды расстройств дыхания во сне в форме апноэ и гипопноэ обструктивного характера (индекс апноэ/гипопноэ — 57,5 эпиз./ч при норме до 5 эпиз./ч), сопровождающиеся эпизодами десатурации (индекс десатурации — 63,0 при норме до 5 эпиз./ч).
Факторы, влияющие на эффективность компенсации углеводного обмена у пациентов с СД2 и МО, получающих инсулинотерапию
Исходный уровень HbA1c статистически значимо не отличался в группах с различным когнитивным статусом (p=0,268) (табл. 2). Через 24 нед. исследования уровень HbA1c во всех 3 группах снизился и достиг 8,0% [7,2; 8,7], 8,9% [8,1;10,0] и 9,0% [7,7; 10,0] соответственно (табл. 2).
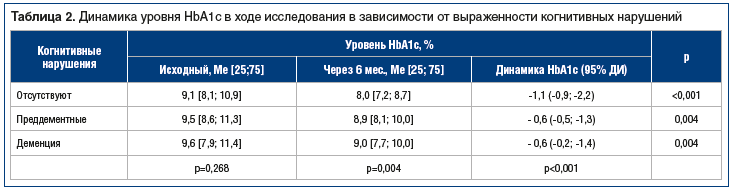
Однако динамика HbA1c различалась в зависимости от наличия и степени выраженности когнитивных нарушений. Пациенты без когнитивных нарушений имели статистически значимо более выраженное снижение уровня HbA1c — -1,1% (95% ДИ: -0,9; -2,2) на фоне проводимой терапии по сравнению с пациентами с когнитивными нарушениями (р<0,001). Пациенты с когнитивными нарушениями имели более высокие показатели HbA1c через 6 мес. терапии (р=0,004). Таким образом, наличие когнитивных нарушений является фактором, затрудняющим достижение компенсации нарушения углеводного обмена у пациентов, получающих различные схемы инсулинотерапии.
Мы не выявили влияния типов пищевого поведения на эффективность инсулинотерапии у всех пациентов с СД2 и МО. Вместе с тем следует отметить, что терапия АР ГПП-1 в сочетании с БИ независимо от типа нарушения пищевого поведения приводила к статистически значимому выраженному снижению уровня HbA1c, при этом среди пациентов с ограничительным типом нарушения пищевого поведения было выявлено статистически значимо большее снижение уровня HbA1c по сравнению с пациентами с другими типами нарушений пищевого поведения: динамика уровня HbA1c через 24 нед. — -2,1%
(95% ДИ -1,1; -2,0).
В нашем исследовании были изучены субъективные показатели удовлетворенности лечением в 3 группах (рис. 2).
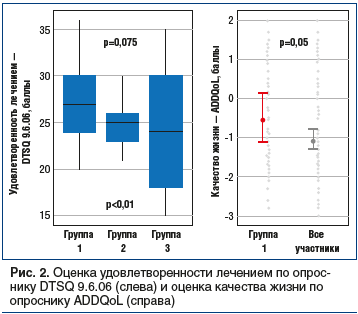
Применение БИ в сочетании с АР ГПП-1 (группа 1) было ассоциировано с более высокой удовлетворенностью пациентов лечением, составлявшей 27 баллов [24; 30] (p<0,001 при сравнении с другими группами). При этом статистически значимых отличий между пациентами, получавшими БИ в сочетании с ПСМ (группа 2) или ББИТ (группа 3), не обнаружено: оценка удовлетворенности составляла 25 баллов [23; 26] и 24 балла [18; 30] соответственно (p=0,752).
При оценке качества жизни ADDQoL медианное значение баллов среди всех участников исследования через 6 мес. терапии составило -1,1 [-1,3; -0,76], в то время как в группе 1 в среднем оценка была несколько выше — -0,55 [-1,1; 0,15]. Таким образом, все пациенты с СД2 и МО исходно имели низкие показатели качества жизни, тем не менее на фоне лечения АР ГПП-1 была выявлена тенденция к его улучшению (p=0,05).
Обсуждение
У большинства пациентов с СД2 и МО были выявлены различной степени выраженности когнитивные нарушения, что может быть следствием как СД2, так и МО: высокие уровни ИМТ ассоциированы с более высокой распространенностью когнитивных нарушений [7–9]. Даже умеренное когнитивное снижение негативно влияет как на эффективность и приверженность проводимой терапии (трудности в расчете дозы инсулина, контроля рациона питания, пропуск приема препарата и т. д.), так и на качество жизни пациентов [10]. Таким образом, у пациентов с когнитивными нарушениями предпочтение следует отдавать упрощенным схемам терапии, что повысит вероятность достижения целей лечения, и применять препараты без риска гипогликемии, ухудшающей когнитивные функции. Ряд исследований показал влияние АР ГПП-1 на функции нейронов и нейродегенеративные изменения, обусловленные диабетом и ожирением, у животных: продемонстрировано улучшение обучения и памяти. В настоящее время проводятся исследования влияния АР ГПП-1 на когнитивные функции у людей, в т. ч. с СД [11–14].
При оценке пищевого поведения у 71,7% пациентов с СД2 и МО, получающих инсулинотерапию, выявлены нарушения пищевого поведения, в большинстве случаев представленные комбинированной формой. Это сопоставимо с результатами ряда исследований [15, 16]. Нарушения пищевого поведения потенциально снижают эффективность любого варианта структурированной ССТ, тем не менее терапия АР ГПП-1 в комбинации с БИ привела к выраженному улучшению углеводного обмена у пациентов со всеми типами нарушений пищевого поведения, что является потенциально перспективным вариантом ССТ у пациентов с СД2 и МО.
В нашем исследовании у 86,9% пациентов с СД2 и МО выявлен СОАС, что сопоставимо с данными литературы [17]. У 2/3 пациентов выявлена тяжелая степень СОАС, ассоциированная с высоким риском внезапной сердечной смерти и дополнительным набором массы тела. Предполагают, что нарушение структуры сна с дефицитом его глубоких стадий приводит к снижению синтеза соматотропного гормона и тестостерона, нарушению регуляции секреции лептина, грелина и орексина, что способствует увеличению и дальнейшему усугублению абдоминального ожирения и утяжелению дыхательных нарушений, что создает «порочный» круг и может существенно затруднять лечение ожирения у пациентов с СОАС [18]. С учетом высокой распространенности нарушений сна при сочетании СД2 и МО требуется активное выявление этих нарушений у данной категории пациентов.
Пациенты с СД2 и МО характеризуются крайне низким качеством жизни и неудовлетворенностью лечением, что связано с большим количеством коморбидных патологий, низкой степенью компенсации нарушений углеводного обмена и выраженностью ожирения. Мы выявили тенденцию к повышению качества жизни и удовлетворенности лечением на фоне терапии АР ГПП-1 по сравнению с исходным уровнем, что, вероятно, ассоциировано с благоприятным влиянием АР ГПП-1 на массу тела и меньшим числом эпизодов гипогликемии.
Заключение
Пациент с СД2 и МО — это индивидуум с несколькими коморбидными состояниями, ухудшающими течение друг друга и снижающими качество жизни. Своевременное выявление и понимание проблем пациента дает возможность персонализировать ССТ. У пациентов с СД2 и МО целесообразна оценка когнитивного статуса, особенностей пищевого поведения, нарушений сна и других состояний, которые могут существенным образом отразиться на эффективности ССТ. С этой целью помимо традиционных клинических методов могут использоваться специализированные опросники (DEBQ, MMSE и др.) и специальные методики (полисомнография). Высокая распространенность когнитивных нарушений среди пациентов с СД2 и МО предопределяет приоритет назначения наиболее простых схем инсулинотерапии. Примером приоритетной схемы ССТ может являться сочетание АР ГПП-1 с метформином и БИ как более рациональное, эффективное и безопасное для пациентов указанной группы.
.
Информация с rmj.ru


