Венозные тромбоэмболические осложнения: случай из практики
Содержание статьи
Введение
Под термином «венозный тромбоэмболизм» (ВТЭ) в настоящее время понимают полиэтиологическое заболевание, характеризующееся высоким уровнем летальности, в основе которого лежит образование тромбов в венозной системе и риск последующего отрыва части тромба и эмболизации сосудов малого круга кровообращения [1]. В клинической практике ВТЭ проявляется тромбозами глубоких вен (ТГВ) и/или тромбоэмболией легочной артерии (ТЭЛА). Заболеваемость ВТЭ в мире составляет 1–2%. Почти у 25% населения мира в тот или иной период жизни возникают венозные тромбоэмболические осложнения (ВТЭО). В России венозный тромбоз ежегодно возникает у 240 000 человек, у 100 000 из них развивается ТЭЛА. У 50–100 больных на 100 000 населения в год ТЭЛА становится фатальной. При этом и ТГВ, и ТЭЛА протекают зачастую бессимптомно. В 75% случаев при венозных тромбозах нижних конечностей обнаруживают скрытую ТЭЛА, а в 80% случаев легочной эмболии находят бессимптомные венозные тромбозы [2].
Задача превентивной медицины — предупреждение сердечно-сосудистых событий и тромбозов различной локализации. Профилактическую направленность имеет термин «тромботическая готовность», предложенный в 2011 г. исследователями под руководством А.П. Момота. Под этим понятием подразумевается готовность крови к развитию тромбоза в результате взаимодействия генетических и дополнительных факторов (сахарный диабет, злокачественные новообразования, травма, оперативное вмешательство, сердечная недостаточность и др.). Перспективным направлением развития медицинской науки является распознавание состояния тромботической готовности и предупреждение вероятного тромбоза [3].
Среди факторов риска ВТЭ особое значение придается тромбофилии. Тромбофилия — это состояние повышенной склонности организма к тромбообразованию, которое связано с нарушением баланса между свертывающей и противосвертывающей системами гемостаза, предрасположенности к раннему развитию и рецидивированию сосудистых венозных и артериальных тромбозов с различной локализацией и облитерацией сосудов. Тромбофилия может быть как генетической, так и приобретенной [1–3].
Открытие молекулярных основ наследственной (первичной) тромбофилии в 1990-х гг. позволило изучить причины и механизмы патологического тромбообразования — от мутации генов факторов свертывания до индивидуальных клинических проявлений тромбозов сосудов различной локализации. В основе патогенеза генетической тромбофилии лежит генетический полиморфизм генов системы гемостаза — как плазменного, так и тромбоцитарного его звеньев, а также генов эндотелиальной дисфункции. Несмотря на то, что изучению генетических основ тромбофилии посвящены многочисленные отечественные и зарубежные исследования, на сегодняшний день нет единого мнения относительно значимости отдельных видов полиморфизмов в развитии ВТЭ. По данным современной литературы, частота генетических форм склонности к тромбообразованию у больных ВТЭ варьирует от 8 до 96,3% [4, 5].
Продолжаются активные поиски генетических предикторов ТЭЛА, ее профилактики и своевременной, адекватной антикоагулянтной терапии. Проводятся исследования полиморфизмов генов системы гемостаза, позволяющие у больных с верифицированным диагнозом ТЭЛА в сравнении со здоровыми лицами определить риск развития ТЭЛА. Так, при полиморфизме в гене ингибитора активатора плазминогена PAI-1, полиморфизме в гене метилентетрагидрофолатредуктазы (МТГФР) С677—>Т, мутации ITGA2, мутации Лейдена, мутации протромбина риск развития ТЭЛА возрастает. При сочетании 1–3 и более мутантных гомозигот исследуемых полиморфизмов генов системы гемостаза риск развития ТЭЛА у пациента возрастает в еще более значительной степени [6, 7].
Высокая частота выявления протромботических генотипов у больных с ТЭЛА подтверждает значимость наследственных форм тромбофилии в генезе ВТЭ. Больные с разными клиническими вариантами ТЭЛА имеют отличия в структуре генетических факторов риска тромбообразования. Окклюзия вен сетчатки (ОВС) тоже связана с наследственными и приобретенными формами тромбофилии. По данным зарубежных исследователей, у пациентов с тромбозом вен сетчатки мутация Лейдена отмечается в 17–19% случаев [7, 8]. Результаты исследований на тромбофилию пациентов с ОВС, по данным некоторых офтальмологов, свидетельствуют о наличии полиморфизма -6754G→5G в гене PAI-1 только в 7% случаев. Наиболее частой наследственной причиной гипергомоцистеинемии являются точечные мутации в гене фермента МТГФР, локализованной в первой хромосоме. Частота гомозиготной формы мутации у европейцев составляет до 15%. При гомозиготном дефекте МТГФР отмечается поражение сосудистой стенки, развитие тромбозов различной локализации в молодом возрасте и 3-кратное увеличение риска развития сердечно-сосудистых заболеваний [7–9].
В данной статье нами представлено клиническое наблюдение окклюзии центральной вены сетчатки (ЦВС) у пациентки после рецидива ТЭЛА на фоне многофакторной наследственной и приобретенной тромбофилии.
Клиническое наблюдение
Пациентка П., 74 года, обратилась с жалобами на снижение зрения левого глаза.
Из анамнеза известно, что пациентка более 20 лет страдает гипертонической болезнью 2-й стадии, ишемической болезнью сердца. Артериальное давление на фоне гипотензивной терапии: систолическое — 130–140 мм рт. ст., диастолическое — 80 мм рт. ст. У пациентки c 2004 г. имеется первичная закрытоугольная 2 а глаукома OS, компенсированная благодаря проведенной лазерной иридэктомии и инстилляциям тимолола 0,5% по 1 капле 2 р./сут.
Исследования системы гемостаза проводились скрининговыми и специальными методами автоматизированной коагулометрии: определение активности фактора Виллебранда (фВ), антитромбина III, активированного протеина С (АПС), VIIIф; количественное определение растворимых фибринмономерных комплексов (РФМК); количественное содержание фибриногена по Клаусу. Выявление волчаночного антигена (ВА) проводилось с использованием ядовых тестов, а также подтверждающими тестами с плазмой донора и корригирующими фосфолипидами, повторное исследование ВА — через 12 нед. Выявление антифосфолипидных антител (АФА) к β-2 гликопротеину-1 проводилось методом ИФА, молекулярно-генетическое тестирование — методом полимеразной цепной реакции в реальном времени (Real-time PCR) генов: F2: 20210G>A; F5: 1691 G>A; FGB: -455 G>A; ITGB3: 1565Т>С; PAI-1: -675 5G>4G; МТГФР С677Т, ACE, (С) ID; P2Y12 ins801A (AP) MN.
Офтальмологические исследования: стандартные методы исследования: визометрия, рефрактометрия, прямая офтальмоскопия. Специальные методы исследования: осмотр глазного дна с линзой Гольдмана, асферичной линзой +78 дптр, ОКТ, ФАГ.
Результаты исследования показали, что пациентка является носителем антител волчаночноподобного типа (ВА) с 2004 г., а антитела к β-2 гликопротеину-1 обнаружены только в 2014 г.
В 2014 г. в генетическом анализе крови обнаружен полиморфизм в гене протромбина F2 (G20210AG>A) G/A в гетерозиготной форме, FV Leiden (R506QG->A) G/A в гетерозиготной форме, МТГФР (1298 A>C) A/C в гетерозиготной форме, редуктаза метионинсинтазы — MTRR (66 A>G) G/G в гомозиготной форме. Весной 2014 г. — многооскольчатый перелом лучевой кости в проксимальном отделе с отрывом локтевого отростка без смещения. Через несколько месяцев после травмы развился флебит подкожной вены на левом предплечье. 24 июня 2014 г. перенесла субмассивную ТЭЛА, тромбоз глубоких и поверхностных вен левой голени. Диагноз ТЭЛА подтвержден методом мультиспиральной компьютерной томографии легких, эхокардиографии, УЗИ сосудов нижних конечностей и анализа крови на расширенную коагулограмму, на генетический полиморфизм гемостаза (табл. 1).
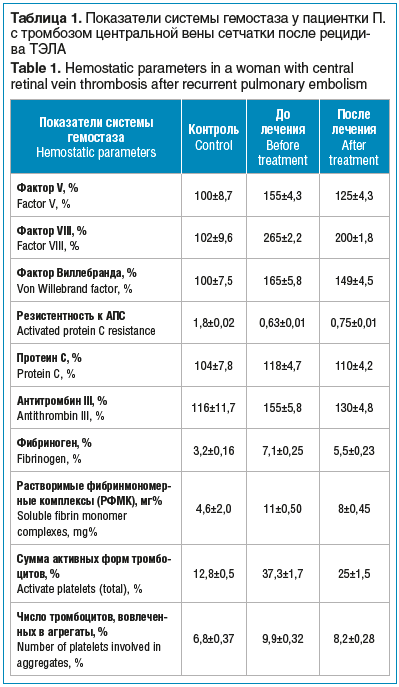
Комплексное лечение проводилось запатентованным
методом (патент RU № 2614105-C1–2015) [10].
Проведен тромболизис препаратом алтеплаза в стандартном режиме: 10 мг внутривенно (в/в) струйно в течение 2 мин, затем 90 мг в/в капельно в течение 2 ч. После тромболизиса пациентка получала надропарин кальция по 0,4 мл подкожно (п/к) 2 р./сут под контролем международного нормализованного отношения (МНО) в течение 5 дней, затем переведена на ривароксабан 15 мг/сут в течение 3 нед., затем 20 мг/сут постоянно.
В июле 2014 г., по данным УЗИ нижних конечностей выявлена удовлетворительная реканализация вен нижних конечностей. В октябре 2014 г. пациентка отметила ухудшение общего состояния: усилилась одышка при физической нагрузке, появилась боль по ходу вен в левой голени, увеличились отеки ног. С 20.10.2014 г. пациентка переведена на надропарин кальция 0,8 мл п/к 2 р./сут, а с 01.11.2014 г. — на дабигатрана этексилат 150 мг/сут 1 р./сут. На 11-й день приема дабигатрана этексилата у пациентки повысилось АД до 170/100 мм рт. ст., появились перебои в области сердца и давящая боль, по ЭКГ отмечено появление наджелудочковых и желудочковых экстрасистол, которые не регистрировались на предыдущих ЭКГ; по данным сцинтиграфии легких — нарушение перфузии легких справа в верхней доле. Пациентка госпитализирована в кардиологическое отделение, где получала надропарин кальция по 0,8 мл п/к 2 р./сут, гипотензивную и антиаритмическую терапию этацизином. Выписана в удовлетворительном состоянии, ритм сердечных сокращений восстановился, АД снизилось до 125/80 мм рт. ст., исчезли отеки ног. С ноября 2014 г. более 5 мес. получала прямые антикоагулянты п/к, затем по рекомендации флеболога стала принимать варфарин 7,5 мг 5 дней с последующим переходом на 5 мг 1 р./сут под контролем активированного частичного тромбопластинового времени, которое в динамике не превышало 30 с; тромбиновое время в динамике не превышало 17 с, МНО не превышало в динамике 1,17; протромбиновое время — в динамике не более 15,4 с, фибриноген в динамике колебался от 5,8 до 7,0 г/л. Помимо варфарина пациентка получала сулодексид 250 ЛЕ 2 р./сут постоянно.
В октябре 2015 г. обратилась к офтальмологу в связи с утратой зрения на левый глаз. Диагностирован частичный тромбоз ЦВС по клинической, офтальмоскопической картине по типу ретинопатии венозного стаза с диффузным высоким кистозным макулярным отеком. По ОКТ OS толщина сетчатки в области фовеа — 576 мкм, пара-перифовеа — 404–428 мкм, имеется высокий крупнокистозный макулярный отек (рис. 1). Пациентка переведена на надропарин кальция по 0,8 мл п/к 2 р./сут.
К лечению местно в OS добавлены: даларгин в инъекциях, в инстилляциях — метилэтилпиридинол, непафенак, тимолол и дорзоламид. В ноябре 2015 г. проведена панретинальная лазерная коагуляция сетчатки OS. Максимально корригированная острота зрения после курса лечения — 0,1. По ОКТ макулярной области OS наблюдалась положительная динамика, уменьшилась толщина сетчатки, но сохранился плоский диффузный макулярный отек, высота сетчатки в фовеа — 254 мкм; пара-перифовеа — 324 мкм. С учетом сохранения макулярного отека и проведенной лазерной коагуляции сетчатки пациентке назначили Ретиналамин® внутримышечно 5 мг/сут в течение 10 дней. Как известно, Ретиналамин®
является биогенным пептидом. Препарат обладает ретинопротекторными свойствами, а также уменьшает воспалительную реакцию, стимулирует репаративные процессы, улучшает функциональное взаимодействие пигментного эпителия и наружных фоторецепторов, регулирует метаболизм клеточных элементов сетчатки и восстановление ее фоточувствительности, оказывает нормализующее действие на проницаемость сосудов сетчатки, выраженное протекторное действие в отношении сосудистого эндотелия, усиливает активность ретинальных макрофагов, активирует антиоксидантную защиту сетчатки. Все перечисленные свойства актуальны для пациентов с описываемой патологией.
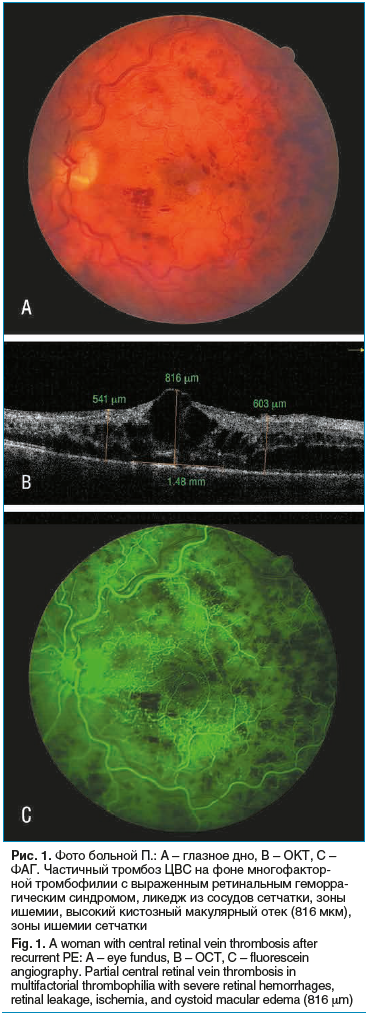
В коагулограмме, несмотря на длительное применение низкомолекулярных гепаринов (НМГ) и сулодексида, в динамике сохранялся повышенный фибриноген — 6–7,11 г/л; АЧТВ — 30 с, протромбиновое время — 15 с, тромбиновое время — 33,5 с, МНО — 1,04, Д-димер — 437,00 нг/мл. По данным тромбоэластографии — гиперкоагуляция за счет плотности сгустка (фибриноген, тромбоциты). В июле 2016 г. на фоне постепенного снижения дозы эноксапарина натрия с 0,8 до 0,6 п/к 1 р./сут и постоянного приема капсул сулодексида в суточной дозе 500 ЛЕ рецидивировал тромбоз ЦВС слева с множественными интраретинальными кровоизлияниями (глазное дно по типу «раздавленного помидора») и высоким диффузным кистозным макулярным отеком (толщина сетчатки фовеа 852 мкм), что явилось основанием для увеличения дозы НМГ.
В исследовании коагулограммы: фибриноген в крови увеличился до 9 г/л при нормальных временных показателях коагулограммы и МНО. Рецидивирующий тромбоз ЦВС, высокий тромбогенный риск на фоне пролонгированной антикоагулянтной терапии явился основанием для дополнительного исследования генетического полиморфизма плазменного, сосудисто-тромбоцитарного звеньев гемостаза и эндотелиальной дисфункции. Обнаружены следующие изменения: F1 (Fibrinogen) G/A 455 (I), полиморфизм в гомозиготной форме, мутация сопровождается повышенной производительностью (экспрессией) гена, что приводит к повышенному уровню фибриногена в крови и увеличивает вероятность образования тромбов. GpIIIaT1565 (A1/A2) A1A2. Этот полиморфизм в гетерозиготной форме может сопровождаться повышенной склонностью тромбоцитов к агрегации; гетерозиготный полиморфизм в гене PAI-1 (PA) 4G5GС/Т может приводить к неэффективному фибринолизу. ACE (C) ID. Полиморфизм в гетерозиготной форме предрасполагает к развитию гипертонической болезни, эндотелиальной дисфункции, риску возникновения венозных тромбозов и неэффективному фибринолизу.
Полиморфизм в гене рецептора тромбоцитов к индуктору АДФ P2Y12 ins801A (AP) MN повышает способность тромбоцитов к агрегации, вызывает нечувствительность к клопидогрелу при его применении, что повышает риск посттравматических и послеоперационных кровотечений.
У пациентки П. сахарный диабет 2 типа выявили в декабре 2016 г. Гликемия в момент постановки диагноза — 26 ммль/л. На фоне приема амарила гликемия натощак — 5,0–6,4 ммоль/л.
Выводы
Проведенные дополнительные генетические исследования и исследование на вторичную тромбофилию АФА позволяют объяснить рецидивы венозных тромбозов любой локализации, а также ОВС.
Многофакторная наследственная тромбофилия и АФА участвуют в патогенезе ТЭЛА и ОВС.
Наличие у пациентов сочетания двух и более генетических маркеров тромбофилии с АФА требует более строгого подхода к выбору и назначению современных оральных антикоагулянтов и обоснованности пролонгированной антикоагулянтной терапии НМГ и дискретного плазмафереза.
Комплексное лечение пациентов с ВТЭ и тромбозом ЦВС целесообразно проводить с применением нейропротекторных препаратов (например, Ретиналамина) для стабилизации зрительных функций и профилактики слепоты.
Сведения об авторах:
1Шелковникова Татьяна Васильевна — к.м.н., врач-
офтальмолог высшей категории лазерного отделения, ORCID iD 0000-0002-8857-3190;
2Тахчиди Христо Периклович — д.м.н., профессор, член-корр. РАН, проректор по лечебной работе, ORCID iD 0000-0002-0621-5905;
3Вавин Григорий Валерьевич — к.м.н., доцент кафедры, ORCID iD 0000-0002-5171-8261;
3Шишлянникова Нина Юрьевна — к.х.н., доцент кафедры, ORCID iD 0000-0002-8612-2310.
1ГАУЗ КОКБ. 650066, Россия, г. Кемерово, пр-т Октябрьский, д. 22.
2ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
3ФГБОУ ВО КемГМУ Минздрава России. 650056, Россия, г. Кемерово, ул. Ворошилова, д. 22а.
Контактная информация: Шелковникова Татьяна Васильевна, e-mail: t.shelkovnikova@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов: отсутствует. Статья поступила 11.03.2019.
About the authors:
1Tat’yana V. Shelkovnikova — MD, PhD, ophthalmologist of Laser Department, ORCID iD 0000-0002-8857-3190;
2Christo P. Takhchidi — MD, PhD, Professor, Corresponding Member of RAS, Vice-chancellor for medical work, ORCID iD 0000-0002-0621-5905;
3Grigoriy V. Vavin — MD, PhD, Associate Professor, ORCID iD 0000-0002-5171-8261;
3Nina Yu. Shishlyannikova — PhD, Associate Professor, ORCID iD 0000-0002-8612-2310.
1Kemerovo Regional Clinical Hospital. 22, Oktyabrskiy av., Kemerovo, 650066, Russian Federation.
2Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117997, Russian Federation.
3Kemerovo State Medical University. 22a, Voroshilov str., Kemerovo, 650056, Russian Federation.
Contact information: Tat’yana V. Shelkovnikova, e-mail: t.shelkovnikova@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 11.03.2019.
материал rmj.ru
