Введение
Внутриутробное развитие мочевыделительной системы плода представляет собой сложный процесс, который может быть связан со значительным риском врожденных пороков [1, 2]. Среди всех антенатально выявленных пороков развития аномалии органов мочевыделительной системы составляют от 20 до 50% [3, 4]. Доля обструктивных уропатий — от 40 до 87% [5]. В 65% случаев данная патология является причиной формирования хронической почечной недостаточности [6].
Применение ультразвукового исследования (УЗИ) плода позволяет уточнить диагноз и выявить показания для проведения внутриутробной коррекции порока мочевыделительной системы у плода. Магнитно-резонансная томография (МРТ) может помочь в диагностике сложных комбинированных пороков [7, 8].
На данный момент в литературе описаны различные способы внутриутробного лечения обструктивных пороков мочевыделительной системы у плода: везикоамниальное шунтирование, цистоскопия и перспективный метод нефроамниального шунтирования. Первые два варианта внутриутробной коррекции имеют множество осложнений и применяются только при наличии обструкции в области нижних отделов мочевыводящих путей у плода [8–10].
Цель исследования: оценить эффективность применения внутриутробного нефроамниального шунтирования у плода для коррекции обструктивных уропатий, обсуждение акушерской тактики.
Содержание статьи
Материал и методы
С 2018 по 2022 г. в ФГБУ «НИИ ОММ» Минздрава России наблюдалось 57 пациенток с обструктивными уропатиями у плодов.
Пациентки были разделены на 2 группы. В основную группу вошло 37 женщин, беременность которых протекала на фоне обструктивных уропатий у плода, с формированием гидронефроза III–IV степени тяжести и ультразвуковыми признаками сохранности функции почек, которым проводилось нефроамниальное шунтирование. Группу сравнения составили 20 пациенток с ультразвуковыми признаками декомпенсированного состояния мочевыделительной системы у плода (уринома, кистозная дисплазия, почка-киста), которым не проводилось нефроамниального шунтирования.
Ультразвуковое исследование выполняли на аппарате Voluson E8 (GE, США) с применением конвексного датчика C1-8-D xdclear Convex Array Probe (2–5 МГц) и полостного — RIC5-9-D Volume Endocavitary Probe (4–9 МГц). При проведении УЗИ для оценки мочевыделительной системы плода использованы следующие параметры: объем амниотической жидкости, продольный и поперечный размер почек, размер чашечно-лоханочной системы, толщина паренхимы и наличие кровотока в почечной артерии.
С целью дополнительной диагностики был использован метод МРТ (МР-томограф General Electric Signa HD с индукцией магнитного поля 1,5 Т, США). Для определения степени гидронефроза нами была использована классификация A. Grignon et al. [11]:
-
гидронефроз I степени: переднезадний размер лоханки более 10 мм, чашечки не изменены;
-
гидронефроз II степени: переднезадний размер лоханки до 15 мм, чашечки не изменены;
-
гидронефроз III степени: дополнительно незначительное расширение чашечек;
-
гидронефроз IV степени: дополнительно истончение паренхимы почек;
-
гидронефроз V степени: почка-киста.
Всем беременным с выявленными врожденными пороками мочевыводящих путей у плода был проведен пренатальный консилиум с участием детского уролога и информированием о возможных способах внутриутробной, послеродовой коррекции, осложнениях и исходах. Согласно приказу Минздрава России от 20 октября 2020 г. № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» при тяжелых обструктивных уропатиях с неблагоприятным прогнозом для жизни и здоровья семья имеет право на проведение искусственного прерывания беременности по медицинским показаниям.
Всем пациенткам основной группы было проведено внутриутробное нефроамниальное шунтирование стентом «СДЕ-МЕД» с оригинальной формой пигтейлов [12].
Техника нефроамниального шунтирования. С целью обездвижения плода в вену пуповины вводили пипекурония бромид 0,1 мг на 1 кг массы тела. С целью обезболивания внутримышечно или в вену пуповины вводили фентанила цитрат 10 мкг на 1 кг массы тела плода. Иглу с мандреном G16 под контролем УЗИ устанавливали в чашечно-лоханочную систему почки плода. Через иглу в полостную систему почки вводили стент на проводнике. Толкателем стент выталкивался в полостную систему почки до закручивания проксимального пигтейла. Далее иглу выводили из полостной системы почки и толкателем проталкивали оставшуюся часть стента. При ультразвуковом контроле после установки дистальный пигтейл должен был визуализироваться в амниотической полости.
После установки нефроамниального шунта еженедельно проводили оценку состояния полостной системы почек, корректности положения стента до родоразрешения. В раннем неонатальном периоде выполняли лабораторное и инструментальное обследование ребенка на базе хирургического отделения ГАУЗ СО «СОКБ № 1» для определения сохранения функций мочевыделительной системы.
Статистическую обработку данных проводили при помощи пакета программ IBM SPSS 26, Microsoft Excel (2010). Проверку нормальности распределения признака осуществляли с использованием критерия Шапиро — Уилка. В зависимости от характера распределения показателя данные представлены в виде средней и стандартного отклонения (M±SD) или медианы и квартилей (Ме [Q1; Q3]). При анализе количественных показателей, распределение которых отличалось от нормального, использовали непараметрические методы — критерий Манна — Уитни. Для сравнения показателей с нормальным распределением использовали критерий Стьюдента для независимых наблюдений. Различия считались статистически значимыми при p<0,05.
Результаты исследования
В основной группе средний возраст пациенток составил 29,6 [24,7; 34,5] года, в группе сравнения — 30,0 [24,9; 35,1]. При анализе соматического, акушерско-гинекологического анамнеза пациенток исследуемых групп достоверных отличий не выявлено. При анализе течения беременности в группе сравнения чаще выявлялась угроза преждевременных родов во втором триместре (p>0,05).
Срок выявления врожденного порока развития мочевыделительной системы у плода в основной группе составил 21,0 [19,1; 22,9] нед. беременности, в группе сравнения — 20,3 [18,2; 22,4] нед. Однако, несмотря на то что большинство пороков было выявлено в сроки второго ультразвукового скрининга, обращает на себя внимание позднее (26–28 нед.) направление пациенток в акушерский стационар третьего уровня и, соответственно, более поздние сроки проведения нефроамниального шунтирования (чаще в 28–32 нед.).
В основной группе по данным УЗИ инфравезикальная обструкция наблюдалась в 10,8%, двусторонний гидронефроз — в 48,6%, односторонний гидронефроз — в 40,6% случаев. В группе сравнения большее количество патологии почек приходилось на инфравезикальную обструкцию (35,0%), что и обусловливает тяжесть поражения мочевыделительной системы плодов в данной группе (p<0,05). В основной группе и группе сравнения левостороннее поражение почек встречалось чаще, чем правостороннее: 55,8% по сравнению с 44,2% и 63,1% по сравнению с 36,9% соответственно, что анатомически обусловлено строением мочевыделительной системы у плода. При сравнении исследуемых групп по показателю объема амниотической жидкости отмечены статистически значимые различия (p<0,001), в основной группе — 15 [14; 16] см, в группе сравнения — 11,5 [9,5; 13,5] см.
При оценке таких ультразвуковых критериев, как продольный и поперечный размеры почек, максимальный размер лоханки, максимальный размер чашечек, толщина паренхимы, в основной группе и группе сравнения статистически значимых отличительных особенностей не выявлено (p>0,05). Кровоток в почечной артерии визуализировался во всех случаях у беременных основной группы и только у 3 (15%) плодов в группе сравнения (p<0,05).
Всем пациенткам основной группы проводилось внутриутробное нефроамниальное шунтирование стентом «СДЕ-МЕД» с оригинальной формой пигтейлов [12]. У 37 пациенток проведено 43 операции. Одностороннее правостороннее нефроамниальное шунтирование выполнено у 15 (45,4%) пациенток, левостороннее — у 18 (54,5%). Двустороннее шунтирование почек сделано у 4 пациенток, повторное нефроамниальное шунтирование в связи с миграцией стента — у 2 (4,9%). Сроки проведения первичного нефроамниального шунтирования: у 15 (40,6%) пациенток в 22–28 нед., у 16 (43,2%) — в 29–32 нед., у 6 (16,2%) — после 32 нед.
С целью оценки эффективности проведенного нефроамниального шунтирования проведен контроль состояния мочевыделительной системы плодов в динамике по данным УЗИ. В основной группе до проведения нефроамниального шунтирования продольный размер составил 49,3±5,6 мм, поперечный размер — 27,2±2,1 мм, лоханка — 30,4±2,7 мм, чашечки — 10,0±1,9 мм и толщина паренхимы — 3,2±1,4 мм. После проведения внутриутробного нефроамниального шунтирования в основной группе выявлены достоверные ультразвуковые признаки эффективности данного оперативного вмешательства (p<0,05): продольный размер составил 46,5±2,6 мм, поперечный — 23,5±1,5 мм. Чашечно-лоханочная система опорожнилась полностью во всех случаях. Выявлено статистически значимое увеличение толщины паренхимы почек до 8,1±1,4 мм (p<0,05).
Среди осложнений нефроамниального шунтирования зарегистрированы: миграция стента у 6 (16,2%) пациенток, преждевременные роды у 8 (21,6%), преждевременное излитие околоплодных вод у 5 (13,5%). При миграции стента у 2 пациенток он был установлен вновь, в остальных случаях показаний к повторному шунтированию не было.
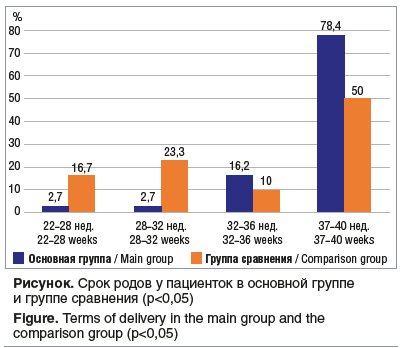
В основной группе из 8 преждевременных родов только в 2 случаях зафиксированы очень ранние и ранние преждевременные роды. Большинство пациенток в этой группе родоразрешились после 32 нед. В 2021 г. преждевременных родов было больше, причем чаще данное осложнение возникало на фоне выявленной новой коронавирусной инфекции (2 (25%) случая из 8). В группе сравнения преждевременные роды случались чаще — в 10 (50%) случаях из 20. В 4 случаях — это очень ранние и ранние преждевременные роды (p<0,05) (см. рисунок).
Дополнительно, с целью оценки результатов после проведенного внутриутробного нефроамниального шунтирования, был выполнен анализ функциональной сохранности почек в течение раннего неонатального периода и периода младенчества (до 1 года жизни) у детей, родившихся у матерей основной группы и группы сравнения. Частота развития почечной недостаточности и вторично-сморщенной почки была выше в группе сравнения: у 12 (60%) детей против 4 (10,8%) детей в основной группе (p<0,05). Если не происходила экспульсия стента во время родоразрешения, то стент удаляли в профильной больнице детские хирурги, которые вели данных пациентов в дальнейшем.
Обсуждение
Хирургическая коррекция порока мочевыводящих путей у плода впервые была проведена 26 апреля 1981 г. Профессором Калифорнийского университета Майклом Харрисоном и бригадой хирургов, урологов и гинекологов внутриутробно открытым доступом была восстановлена проходимость мочеиспускательного канала у плода на 36-й неделе беременности. Ребенок родился без почечной недостаточности [13].
Признаками тяжести поражения мочевыделительной системы у плода с выявленной антенатальной обструктивной уропатией являются: признаки инфравезикальной обструкции, резкое двустороннее истончение паренхимы, наличие признаков кистозной дисплазии паренхимы, уриномы, кистозной дисплазии почек, резкое снижение диуреза, отсутствие продукции мочи, абсолютное маловодие [10]. Основной причиной смертности при обструктивных уропатиях у плода является легочная гипоплазия. Ведущей целью внутриутробного оперативного вмешательства является профилактика данного осложнения путем коррекции маловодия [14]. В настоящее время существует несколько методов фетальной хирургии обструктивных уропатий у плода. Один из них — внутриутробная цистоскопия. Данное оперативное вмешательство может быть использовано с целью уточнения пренатального диагноза и для специфического лечения клапанов уретры. Цистоскопия способствует нормальному развитию мочевого пузыря. Однако применение данного оперативного вмешательства сопряжено со множеством технических осложнений и не снижает перинатальную смертность и заболеваемость по сравнению с везикоамниальным шунтированием [15, 16].
Наиболее часто используемым оперативным вмешательством при клапане задней уретры является везикоамниальное шунтирование. Цель данного подхода в первую очередь — дренирование мочевого пузыря, опорожнение чашечно-лоханочной системы со снижением компрессии паренхимы почек и нормализацией количества околоплодных вод, что соответственно снижает риск развития хронической почечной недостаточности и гипоплазии легких у ребенка постнатально [17, 18]. В метаанализе 2020 г., проведенном G. Saccone et al. [19], показана оценка перинатальной выживаемости плодов с инфравезикальной обструкцией после везикоамниального шунтирования. Критериями включения отобранных исследований была одноплодная беременность с тяжелой формой обструкции, подтвержденная при детальном УЗИ плода. В группе с проведенным везикоамниальным шунтированием выжило 64 (57,1%) из 112 плодов по сравнению с 52 (38,8%) из 134 в контрольной группе с консервативным ведением. B. Strizek et al. в 2020 г. [20] выявили, что проведение везикоамниального шунтирования в первом триместре значительно увеличивает выживаемость новорожденных и потенциально может сохранить функцию почек. У живорожденных детей наблюдается низкий уровень частоты выявления почечной недостаточности при рождении, но долгосрочное наблюдение за этими детьми в отношении почечной и общей заболеваемости не проводилось. При применении везикоамниального шунтирования наиболее частым осложнением является миграция стента из места установки, которая происходит в 40–80% случаев [20, 21].
Внутриутробное нефроамниальное шунтирование — это перспективный метод внутриутробного лечения обструктивных уропатий. Данное оперативное вмешательство может применяться при обструкции верхних и нижних мочевыводящих путей. Данный вид фетальной терапии в мире не практикуется. С 2015 г. в условиях ФГБУ «НИИ ОММ» Минздрава России проводится нефроамниальное шунтирование стентом с оригинальной формой пигтейлов [8–10]. При применении нефроамниального шунтирования миграция стента из места установки отмечалась в 16,2%.
В литературе описано использование для проведения фетальной хирургии таких шунтов, как Harrison, Rocket, Somatex, Vortex. Шунт Harrison 5Fr, 150 мм имеет большую толщину, что затрудняет его фиксацию в месте установки, Rocket 3Fr, 120 мм в своем составе имеет кольца из нержавеющей стали, в результате чего окружающие ткани подвержены большой травматизации, поэтому его не используют в течение последних двух лет [22]. Шунт Somatex, изготовленный в Германии, используется в настоящее время. Он имеет длину 22 мм, диаметр 1,2 мм, самораскрывающиеся зонтики на концах и может быть введен через внутривенный катетер с инъекционным портом G18 [21]. Шунт Vortex на данный момент прошел апробацию только на животных [23]. Изготовленный из силиконовой ренттеноконтрастной резины стент «СДЕ-МЕД» 3Fr, 49 мм вышеуказанных недостатков не имеет и позволяет под контролем УЗИ проводить внутриутробную коррекцию с последующим контролем установки. Диаметр рабочей части — 15G, что снижает травматизацию в месте установки. Кроме того, данный стент имеет оригинальную форму пигтейлов, что позволяет автоматически включаться механизмам фиксации при установке и, следовательно, уменьшить частоту экспульсии стента. В 87% данный стент устанавливается однократно и удаляется постнатально [2, 12, 24, 25]. Установка стента «СДЕ-МЕД» не оказывает отрицательного влияния на течение и исход беременности. Данный стент также применяется при плевроамниальном, перитонеоамниальном шунтировании [26, 27]. Не применяется при вентрикулоперитонеальном шунтировании.
Заключение
Ранняя пренатальная диагностика обструктивных уропатий у плода, своевременно начатое внутриутробное и постнатальное хирургическое лечение, по нашему мнению, могут способствовать предотвращению развития осложнений и сохранению нормальной функциональной активности мочевыделительной системы у новорожденного, что является приоритетным фактором.
При пренатальном выявлении гидронефроза III–IV степени необходимо в ближайшее время после установки диагноза направить пациентку в учреждение третьего уровня с возможностью проведения фетальной коррекции порока мочевыделительной системы у плода.
Применение внутриутробного нефроамниального шунтирования у плода с обструктивными уропатиями является эффективным методом лечения. Улучшение почечной функции в неонатальном периоде выше при применении нефроамниального шунтирования, чем без него. Своевременное проведение операции позволяет улучшить перинатальные исходы.
СВЕДЕНИЯ ОБ АВТОРАХ:
Косовцова Наталья Владимировна — д.м.н., руководитель отдела биофизических методов исследования ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4670-798Х
Федорова Наталья Анатольевна — врач акушер-гинеколог, аспирант ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0003-1474-4978
Контактная информация: Федорова Наталья Анатольевна, e-mail: fedotova.natasha95@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Статья поступила 12.03.2025.
Поступила после рецензирования 04.04.2025.
Принята в печать 29.04.2025.
ABOUT THE AUTHORS:
Natalia V. Kosovtsova — D. Sc. (Med.), Head of the Department of Biophysical Research Methods, Ural Research Institute for Maternal and Infant Health; 1, Repina str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-4670-798X
Natalia A. Fedorova — obstetrician-gynecologist, postgra-duate student, Ural Research Institute for Maternal and Infant Health; 1, Repina str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0003-1474-4978
Contact information: Natalya A. Fedorova, e-mail: fedotova.natasha95@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 12.03.2025.
Revised 04.04.2025.
Accepted 29.04.2025.
Информация с rmj.ru