Глаукома является одной из основных причин необратимой утраты зрения и слепоты у населения во всех странах. Распространенность первичной открытоугольной глаукомы (ПОУГ) крайне высока во всем мире. В России официально зарегистрировано 1 281 566 пациентов с глаукомой, при этом еще не менее 500 тысяч человек не подозревают о наличии у них этого заболевания [1].
Крайне важно установить диагноз глаукомы на ранней стадии и назначить пациенту лечение, позволяющее стабилизировать процесс и не допустить снижения зрительных функций [2]. При осуществлении контроля за течением ПОУГ необходимо учитывать факоры риска прогрессирования заболевания:
суточные колебания офтальмотонуса таковы, что максимальное повышение уровня внутриглазного давления (ВГД) происходит в ночные или ранние утренние часы и, следовательно, может не быть выявлено у пациентов на приеме у офтальмолога, создавая впечатление о хорошем контроле ВГД; по некоторым данным, уровень ВГД может повышаться до 4,9 мм рт. ст. вне часов посещения лечащего врача [3, 4];
повышение уровня ВГД на 1 мм рт. ст. увеличивает риск прогрессирования глаукомы на 19% [5], а одновременное увеличение среднесуточных колебаний ВГД на 1 мм рт. ст. и возраста (на каждые 5 лет) повышает риск потери полей зрения на 30% [6];
нежелательные эффекты способствуют увеличению риска прогрессирования глаукомы в 3,3 раза [7].
Для стабилизации заболевания и нормализации ВГД офтальмологами применяются местные гипотензивные лекарственные средства, причем от 60 до 80% пациентов с глаукомой получают именно медикаментозное лечение в виде ежедневных инстилляций лекарственных препаратов [2]. Влияние различных препаратов на параметры ВГД активно изучается. Используемый для стабилизации глаукомного процесса препарат должен максимально обеспечивать контроль среднесуточных колебаний ВГД, максимально эффективно снижать ВГД, а также обладать минимальным количеством побочных эффектов. К настоящему времени накоплена достаточная доказательная база, подтверждающая эффективность местных аналогов простагландинов как в плане снижения ВГД, так и в отношении замедления прогрессирования потери зрительных функций у пациентов с глаукомой [8].
Однако в основе действия аналогов простагландинов лежит провоспалительный механизм — активация циклооксигеназного пути метаболизма арахидоновой кислоты с выбросом медиаторов воспаления, что приводит к появлению такого побочного явления, как гиперемия конъюнктивы [9]. Гиперемия конъюнктивы на фоне инстилляции консервантсодержащих препаратов простагландинового ряда развивается крайне часто [10]: при использовании биматопроста — в 75% случаев [11], травопроста — в 50% [12] и 47% [11]. При инстилляции латанопроста с консервантом частота развития данного симптома меньше, чем при применении травопроста и биматопроста [13] и составляет 40% [11], однако в целом проявляется у достаточно большого числа пациентов.
Длительность гиперемии конъюнктивы может составлять несколько месяцев [11] и вызывать характерные жалобы пациентов на «красные глаза», что может стать причиной самостоятельного прекращения терапии [14]. Самостоятельные попытки отмены препарата описаны в 36–38% случаев использования консервантсодержащих аналогов простагландинов в течение 6 мес. лечения [15]. Таким образом, приверженность лечению существенно снижается [16], что, в свою очередь, ведет к дальнейшему прогрессированию глаукомной атрофии и постепенной необратимой утрате зрительных функций [2].
Кроме гиперемии конъюнктивы длительное лечение препаратами простагландинового ряда, содержащими консерванты, ассоциировано с развитием синдрома «сухого глаза» (CCГ) и проявлением связанного с ним вызывающего дискомфорт симптомокомплекса [17]. Токсичность консервантов офтальмологических капельных лекарственных средств, преимущественно бензалкония хлорида (БАХ) [18], в отношении глазной поверхности проявляется в следующем: 1) БАХ обладает свойствами детергента, вступающего в реакцию с липидами слезной пленки; 2) непосредственно повреждает эпителий роговицы и конъюнктивы [19]; 3) вызывает иммуноаллергические реакции [20]. Указанные механизмы, по данным разных авторов, ведут к формированию ССГ, проявляющегося у пациентов при инстилляции антиглаукомных капель простагландинового ряда с БАХ,
в 13,9–16,5% случаев [21, 22].
Таким образом, несмотря на достаточную гипотензивную эффективность консервантсодержащих аналогов простагландинов, частота формирования непереносимости препаратов высока, что значительно снижает приверженность пациентов терапии лекарственными средствами данной группы и в некоторых случаях провоцирует самостоятельную отмену пациентами антиглаукомных препаратов. Это подталкивает офтальмологов к поискам хорошо переносимого, лишенного характерных побочных эффектов препарата для лечения глаукомы, обладающего высокой способностью к компенсации уровня ВГД при контроле его среднесуточных колебаний.
В этом обзоре систематизированы данные, позволяющие оценить гипотензивный эффект и переносимость 0,0015% тафлупроста без консерванта при переводе пациентов с ПОУГ и офтальмогипертензией с предшествующей консервантсодержащей терапии и обосновать выбор данного препарата у пациентов при формировании непереносимости антиглаукомного лечения.
Содержание статьи
- 1 Анализ исследования гипотензивной эффективности и переносимости тафлупроста без консерванта
- 2 Гипотензивный эффект при переводе пациентов с лечения консервантсодержащими препаратами простагландинового ряда на 0,0015% тафлупрост без консерванта
- 3 Переносимость 0,0015% тафлупроста без консерванта при переводе пациентов с консервантсодержащих препаратов простагландинового ряда
- 4 Заключение
Анализ исследования гипотензивной эффективности и переносимости тафлупроста без консерванта
Гипотензивный эффект при переводе пациентов с лечения консервантсодержащими препаратами простагландинового ряда на 0,0015% тафлупрост без консерванта
Исследования гипотензивной эффективности тафлупроста демонстрируют способность препарата не только компенсировать ВГД, но и положительно влиять на такие параметры офтальмотонуса, как максимальные и минимальные регистрируемые цифры ВГД, амплитуда флуктуаций в течение суток.
Так, S.Y. Cho et al. проведено исследование суточных колебаний офтальмотонуса с участием 22 пациентов с ПОУГ. Уровень ВГД измеряли каждые 4 ч с использованием тонометра Icare One. До начала медикаментозной терапии суточные колебания составляли около 8,6 мм рт. ст., после 2-недельной терапии тафлупростом без консерванта было достигнуто значительное снижение амплитуды суточных флуктуаций до среднего значения 4,6 мм рт. ст. (p
В проспективном рандомизированном слепом исследовании 43 пациентов с ПОУГ была продемонстрирована достоверно большая эффективность тафлупроста по сравнению с латанопростом в снижении как среднего суточного значения ВГД, так и 24-часовых колебаний офтальмотонуса. Среднесуточные колебания ВГД в группе с тафлупростом были на 0,7 мм рт. ст. меньше, чем в группе с латанопростом,- 3,9±1,3 и 4,6±1,6 мм рт. ст. [26].
Исследования, в которых проводилась оценка тонометрических данных при переводе с консервантсодержащих аналогов простагландинов на бесконсервантный 0,0015% тафлупрост, подтверждают сохранение достаточного уровня компенсации ВГД у пациентов с ПОУГ как в течение 4 нед. после смены терапии [27–29], так и в течение последующих 12 нед. лечения [28–35]. Анализ уровня ВГД при подобном изменении терапии представлен в таблице 1. В ряде исследований [28, 29, 36–38] назначение пациентам 0,0015% тафлупроста без консерванта сопровождалось дополнительным гипотензивным эффектом по сравнению с данными на фоне лечения испытуемых латанопростом, содержащим БАХ.
Результаты оценки ВГД при переводе пациентов с консервантсодержащих 0,004% травопроста и 0,03% биматопроста на бесконсервантный 0,0015% тафлупрост также представлены в таблице 1. Статистически незначимое увеличение ВГД при смене терапии было описано лишь в единственном исследовании S. Ranno et al. (2012) [32].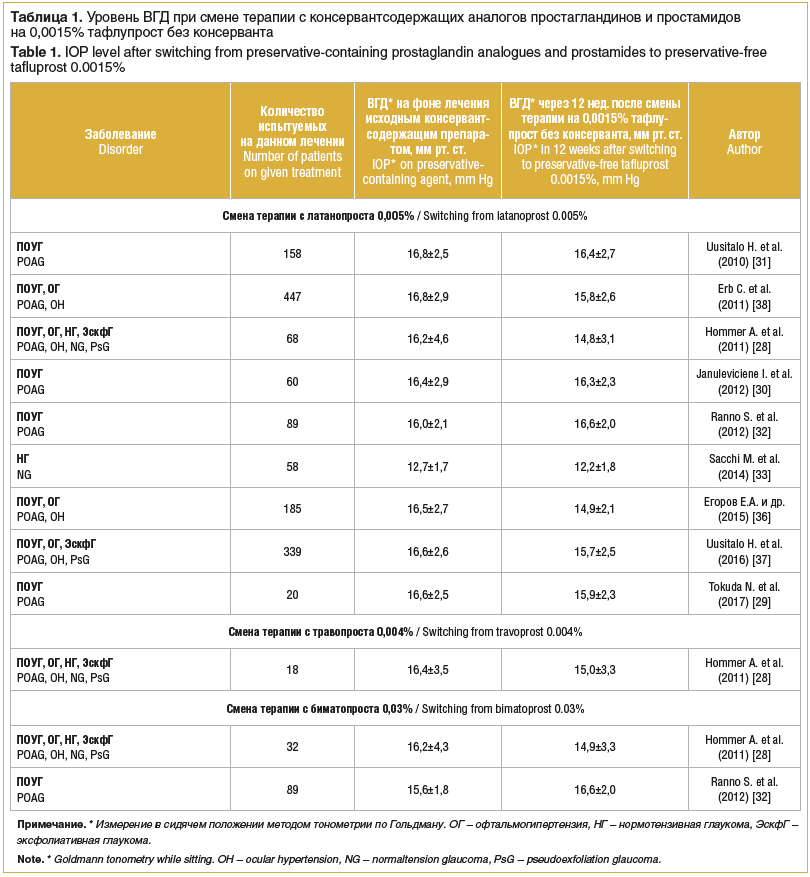
Таким образом, замена консервантсодержащих препаратов простагландинового ряда на тафлупрост без консерванта позволяет сохранить стойкий уровень компенсации ВГД у пациентов с глаукомой и офтальмогипертензией, что подтверждает высокую гипотензивную эффективность препарата Тафлотан при использовании в клинической офтальмологической практике. Кроме этого, способность препарата контролировать среднесуточные колебания офтальмотонуса заслуживает особого внимания, поскольку показано увеличение риска прогрессирования ПОУГ на 19% при повышении ВГД на 1 мм рт. ст. и увеличение риска потери полей зрения на 30% при одновременном увеличении среднесуточных колебаний ВГД на 1 мм рт. ст. и возраста на 5 лет [5, 6, 39].
Переносимость 0,0015% тафлупроста без консерванта при переводе пациентов с консервантсодержащих препаратов простагландинового ряда
По данным Н.А. Шульгиной (2017), в 94,1% случаев назначение пациентам тафлупроста без консерванта не сопровождается появлением каких-либо жалоб со стороны органа зрения. Местные побочные явления были зарегистрированы автором в 5,9% случаев: незначительная гиперемия глаз и чувство «засоренности» полностью исчезали к 3-м сут лечения и не влекли за собой отмену препарата [40].
При переводе пациентов с консервантсодержащих препаратов на 0,0015% тафлупрост без консерванта в подавляющем большинстве случаев были отмечены значительное уменьшение местных побочных реакций, связанных с предыдущим лечением, а также наличие положительной динамики симптомов заболевания поверхности глаза [28, 30, 31, 41]. Так, в Германии после переключения на тафлупрост без консерванта 85,7% больных отметили свои ощущения как «очень хорошие» и «хорошие» [38]. После анализа субъективных опросников при использовании антиглаукомных препаратов 100% больных, получавших латанопрост с консервантом БАХ, отмечали выраженный дискомфорт, характерный для ССГ и уменьшающийся после замены лечения на тафлупрост без консерванта и полностью исчезающий к 12-й нед. у 63,4% пациентов [30]. В работе S. Ranno et al. (2012) 75% больных отметили значительное уменьшение дискомфортных ощущений со стороны глаз после аналогичной смены местной терапии [32]. По результатам работы Н. Uusitalo et al. (2016), количество пациентов с жалобами на плохую переносимость глазных капель уменьшилось с 75% до 24% на фоне подобной замены препаратов [37]. А в исследовании С.Ю. Астахова и Н.В. Ткаченко (2016) было показано значительное уменьшение признаков токсического повреждения эпителиальных клеток роговицы и отека стромы [2].
В исследовании Н. Uusitalo et al. (2010) при изменении лечения на тафлупрост без консерванта у пациентов отмечалось уменьшение жалоб на раздражение/жжение глаз (с 56,3% до 28,4%), зуд (с 46,8% до 26,5%), ощущение инородного тела (с 49,4% до 27,1%), слезотечение (с 55,1% до 27,1%) и чувство сухости глаза (с 64,6% до 39,4%) [31]. Кроме субъективных показателей в данном исследовании были отмечены объективные критерии улучшения состояния глазной поверхности. Уменьшилась частота патологического прокрашивания флюоресцеином роговицы (с 81,6% до 40,6%) и конъюнктивы (с 84,2% до 43,2%), снизилась частота развития блефаритов (с 60,1% до 40,6%), конъюнктивальной гиперемии (с 84,2% до 60%), показателей слезопродукции по тесту Ширмера (с 71,5%
до 59,4%) [31]. В других исследованиях было выявлено аналогичное уменьшение числа пациентов, страдающих от выраженной конъюнктивальной гиперемии после перевода их на тафлупрост без консерванта, — с 43,2% до 1,9%, по данным А. Hommer et al. (2011) [28], с 17% до 8%, по данным М. Sacchi et al. (2014) [33].
Результаты увеличения времени разрыва слезной пленки на фоне смены местной гипотензивной терапии приведены в таблице 2. Перевод пациентов на бесконсервантный тафлупрост во всех случаях приводил к достоверному улучшению показателей слезопродукции.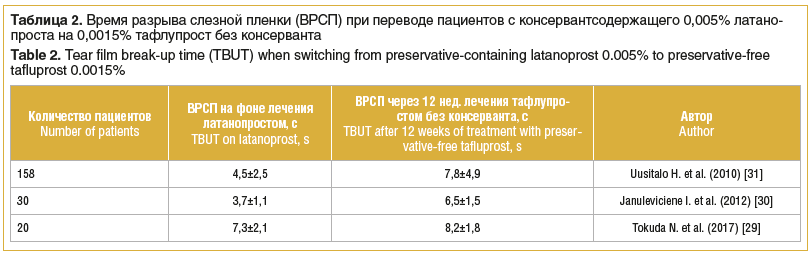
Барьерная функция роговичного эпителия при аналогичной смене терапии была оценена в исследовании N. Tokuda et al. (2017) [29]. Авторы описали статистически значимое уменьшение поглощения флюоресцеина с 107,5±47,3 нг/мл до 93,9±47,6 нг/мл уже через 4 нед. лечения тафлупростом и до 91,5±37,9 нг/мл через 8 нед. инстилляций препарата без консерванта.
I. Januleviciene et al. (2012) в своей работе проанализировали изменение осмолярности слезы при назначении тафлупроста без консерванта пациентам, длительно получающим терапию консервантсодержащим латанопростом [30]. Результат был следующим — гиперосмолярность слезной жидкости на фоне лечения латанопростом уменьшилась после перевода пациентов на тафлупрост с 315,7±15,1 мОсм/л до 302,0±9,9 мОсм/л. Так как гиперосмолярность слезы является одним из факторов, влияющих на апоптоз эпителиальных клеток роговицы человека [42],
изменения данного показателя учитываются в оценке степени выраженности проявления симптомов ССГ [43].
Приведенные исследования демонстрируют результаты удовлетворительной переносимости пациентами тафлупроста без консерванта, а также значительного улучшения состояния глазной поверхности у больных со сформированной непереносимостью других аналогов простагландинов, что позволяет рекомендовать Тафлотан в качестве препарата выбора для назначения пациентам с проявлениями побочных эффектов консервантсодержащих антиглаукомных капель.
Заключение
Рекомендации, сформулированные для лечения
ПОУГ [44], указывают на целесообразность назначения аналогов простагландинов, эффективность которых для ПОУГ многократно подтверждена [45]. Однако использование консервантсодержащих препаратов данной группы ведет к ухудшению приверженности лечению, связанному с возникновением непереносимости пациентами препаратов и развитием ССГ. Замена содержащих консерванты препаратов простагландинового ряда на 0,0015% тафлупрост без консерванта является эффективной мерой с позиции сохранения, а в ряде случаев — усиления гипотензивного эффекта, позволяет добиваться компенсации уровня ВГД у больных глаукомой, а также поддерживать минимальный уровень среднесуточных колебаний офтальмотонуса. Кроме этого, перевод больных на тафлупрост без консерванта сопровождается объективным улучшением состояния глазной поверхности и минимизацией, а зачастую и полным исчезновением жалоб, связанных с дискомфортом от закапывания капель.
Снижение суточных колебаний ВГД при использовании тафлупроста по сравнению с латанопростом, усиление гипотензивного эффекта данного препарата, хорошая переносимость, способствующая высокой приверженности лечению, позволяют значительно снизить прогрессирование глаукомы.
Сведения об авторах:
1Белогурова Алена Вячеславовна — к.м.н., врач-офтальмолог;
1Эскина Эрика Наумовна — д.м.н., профессор, главный врач;
2Оганезова Жанна Григорьевна — к.м.н., доцент кафедры офтальмологии.
1ООО «Клиника «Сфера». 117628, Россия, г. Москва, ул. Старокачаловская, д. 10.
2ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Белогурова Алена Вячеславовна, e-mail: alyona.belogurova@sfe.ru. Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 19.12.2018.
About the authors:
1Alyona V. Belogurova — MD, PhD, ophthalmologist;
1Erika N. Eskina — MD, PhD, Professor, medical director;
2Janna G. Oganezova — MD, PhD, Assistant Professor of the Ophthalmological Department.
1LLC “Clinic “Sphere”. 10, Starokachalovskaya str., Moscow, 117628, Russian Federation.
2Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation.
Contact information: Alyona V. Belogurova, e-mail: alyona.belogurova@sfe.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 19.12.2018.
материал rmj.ru
