Одной из частых и важных жалоб пациентов, особенно пожилого возраста, нередко страдающих от нескольких заболеваний и получающих по этому поводу несколько лекарственных препаратов, является нарушение ходьбы. Функцию ходьбы справедливо считают основополагающей для сохранения высокого качества жизни населения. Неврологи широко обсуждают важность и возможность раннего выявления и коррекции нарушения походки и связанного с ходьбой нарушения равновесия как основного фактора риска развития падений и ассоциированных с ними травм, тревоги и депрессии, что с высокой вероятностью может привести к ограничению самостоятельности пациентов.
Не менее важной является оценка изменения скорости ходьбы и других ее характеристик: количества шагов в минуту, длины и высоты шага, ритма походки. Известно, что в силу возрастных изменений нервной системы, скелетной мускулатуры, костных структур, суставов и связок, постепенного снижения мышечной массы, особенно в условиях вынужденной гиподинамии, у пожилого человека могут развиваться статические и динамические моторные расстройства. Нарушение динамического и статического двигательного контроля способствует формированию ощущения неустойчивости и дополнительно увеличивает риск падений. Травмы позвоночника и суставов нижних конечностей усугубляют двигательный дефицит, формируется порочный круг, что приводит к зависимости пациентов от помощи других лиц.
Поэтому так важно своевременно диагностировать патологические изменения, которые могут стать причиной нарушения функции ходьбы, особенно если известно, что их своевременное устранение может способствовать восстановлению привычного для человека образа жизни. Причинами нарушения ходьбы могут выступать поражения центральной нервной системы (нарушение функции мозжечка, вестибулярная и слуховая дисфункция, патология экстрапирамидной системы, центральные парезы, расстройства корковых функций и др.), периферических нервов или корешков спинного мозга. Изменение ходьбы может возникать при сенситивной атаксии и в связи с болью, ограничивающей передвижение, на фоне снижения зрения или опосредованно, вследствие ортостатической гипотензии, воздействия лекарственных средств, алкоголя и наркотических веществ, при инфекционных заболеваниях и нарушении функции внутренних органов [1, 2].
Отдельного внимания заслуживает перемежающаяся хромота — нарушение ходьбы, наиболее частой причиной которого является облитерирующий атеросклероз артерий нижних конечностей (АНК).
Очевидно, что нарушение ходьбы как одно из проявлений двигательных расстройств наиболее опасно для лиц старше 60 лет, у которых оно нередко сочетается с расстройством других функций, как то: зрение, слух, умственные способности, чувствительность, репродукция, иммунитет, барьерная функция кожи.
Эксперты ВОЗ прогнозируют, что число пожилых людей к 2050 г. достигнет двух миллиардов, или около пятой части населения нашей планеты. Основной постулат современной гериатрии заключается в том, что старение может быть физиологическим («здоровым») и не ограничивать повседневную активность человека. Активную старость определяют как «процесс оптимизации возможностей для обеспечения здоровья, участия в жизни общества и защищенности человека в целях улучшения качества его жизни в ходе старения». Политика в области здравоохранения, направленная на «здоровое» старение нации, должна учитывать, что пожилым людям присуще увеличение риска развития заболеваний, многие из которых могут отрицательно сказаться на качестве и продолжительности жизни. В документах ВОЗ основными причинами наступления инвалидности у пожилых людей называют расстройства чувствительности, боль, деменцию, падения, депрессию, сахарный диабет (СД), хроническую обструктивную болезнь легких и остеоартрит. Необходимо устранять те факторы, которые связаны с увеличением риска заболеваний, и усиливать влияние факторов, способствующих сохранению здоровья на протяжении всей жизни. Темп снижения когнитивной и физической активности, будучи детерминирован генетически, во многом подвержен влиянию эпигенетических механизмов, физических и социальных факторов окружающей среды. Геронтологи справедливо полагают, что для снижения бремени болезней в пожилом возрасте необходимо формирование здорового образа жизни в сочетании с мониторингом факторов риска заболеваний. Регулярная рациональная физическая активность играет важнейшую роль в поддержании привычного (высокого) качества жизни и снижает смертность в популяциях примерно на 30%2. Сохраненная физическая активность (прежде всего ходьба) не только важна сама по себе, но и способна улучшить ментальные функции, уменьшить выраженность тревоги и депрессии, снизить риск развития таких заболеваний, как СД, инфаркт миокарда и церебральный инфаркт. Сохранение социализации и физической активности людей имеет двустороннюю положительную связь между собой и способствует сохранению ментального и эмоционального здоровья2 [2].
Возвращаясь к проблеме коморбидности, следует отметить, что причиной нарушения функции ходьбы, даже если эта жалоба длительное время остается единственной, крайне редко выступают заболевания, находящиеся в исключительной компетенции одного специалиста. Например, выявление дистального тетрапареза при некоторых формах невропатий вовсе не исключает как вторую причину нарушения походки перемежающуюся хромоту при атеросклерозе АНК. Наиболее часто при перемежающейся хромоте мы сталкиваемся с наличием двух или более заболеваний, что требует обсуждения и проведения дифференциальной диагностики с участием не только невролога и сердечно-сосудистого хирурга, но и терапевта, эндокринолога, ревматолога, дерматолога, инфекциониста и других специалистов с использованием алгоритмов принятия решений.
Накапливается опыт изучения коморбидной связи между заболеваниями артерий, периферических нервов и онкологической патологией. В частности, B. Villemur et al. [3] обнаружили, что частота возникновения рака у пациентов с заболеваниями периферических артерий (ЗПА) выше, чем в общей популяции, и варьирует в широких пределах — от 3,8 до 30,4%. Это указывает на необходимость онкологического скрининга среди пациентов с острой или критической ишемией конечностей, особенно при злоупотреблении табаком, анемии, ампутации и повторяющихся тромбозах.
Важно помнить, что имеет значение не только взаимо-связь этиологии и патогенеза коморбидных заболеваний (причинная, осложненная), но и совпадение их по времени, причем вне зависимости от их активности (ятрогенная, неуточненная, случайная коморбидность) [4]. По данным [5], периферическая невропатия является основной причиной боли, связанной с раком. В этих случаях может иметь место осложненная (невропатия как прямое или косвенное осложнение рака), ятрогенная (на фоне лечения онкологического заболевания) или случайная (ранее существовавшая невропатия) коморбидность. Возможно возникновение паранеопластических неврологических расстройств в рамках причинной коморбидности.
Важно учитывать возрастные аспекты коморбидности. Известно, что у пожилых людей количество хронических болезней может достигать в среднем 6,4, при этом почти у всех (98%) таких пациентов выявляют два или более заболеваний (для сравнения: у молодых (от 18 до 44 лет) пациентов эти показатели составляют 2,8 и 69% соответственно) [6].
В практике невролога наиболее часто у одного и того же пациента встречаются цереброваскулярные заболевания (ЦВЗ) и болезни периферической нервной системы. Обычно при таком сочетании речь идет о неуточненной или случайной коморбидности. В других случаях поражение церебральных сосудов и периферических нервов может быть обусловлено проявлениями и осложнениями основного заболевания, например СД (осложненная коморбидность) [4].
Нарушение церебрального и/или спинального кровообращения может быть этиологически и патогенетически связано с атеросклерозом, другими клиническими проявлениями которого могут стать и ишемическая болезнь сердца (ИБС), и атеросклеротическое поражение АНК (причинная коморбидность). Возможность ятрогенной коморбидности должна быть учтена при выявлении признаков поражения периферических нервов на фоне лечения перечисленных выше заболеваний (ассоциированных с атеросклерозом) статинами, амиодароном и некоторыми другими лекарственными средствами [7, 8].
Говоря о поражении периферических артерий в практике невролога, необходимо рассматривать, во-первых, сочетание атеросклероза АНК и церебральных артерий, что клинически может проявиться перемежающейся хромотой у пациентов с бессимптомным инфарктом мозга, и/или легкими когнитивными расстройствами, или бессимптомным нарушением периферического кровообращения у пациентов, перенесших ишемический инсульт, и/или страдающих сосудистыми когнитивными нарушениями. Возможно сочетание явных (остро проявившихся или хронических) клинических признаков поражения АНК и церебральных артерий, а также случайное одновременное выявление стенозирующего атеросклероза АНК и церебральных артерий при плановом обследовании — дуплексном сканировании сосудов.
В качестве альтернативных причин развития перемежающейся хромоты эксперты Американской кардиологической ассоциации AHA/ACC предлагают рассматривать кисту Бейкера, нарушение венозного кровообращения, хронический компартмент-синдром, стеноз позвоночного канала, компрессию корешков, артрит тазобедренного сустава и суставов стопы [9]. Особые затруднения при дифференциальной диагностике причин перемежающейся хромоты могут возникать при нарушении спинального кровообращения.
По оценкам экспертов, на нашей планете более 200 млн человек страдают заболеваниями артерий нижних конечностей (ЗАНК), в период с 2000 по 2010 г. распространенность ЗАНК увеличилась в среднем на 25%. Важно, что почти у двух третей пациентов заболевание протекает асимптомно, но в то же время ЗАНК являются важной причиной инвалидизации и смертности. Этим объясняется интерес к разработке доступных подходов к своевременной диагностике, например измерение лодыжечно-плечевого индекса при дуплексном сканировании [10].
Представляет интерес работа C.W. Hicks et al. [11], целью которой было оценить информативность биомаркеров, указывающих на патологию миокарда при ЗПА и заболеваниях периферических нервов. Авторами выявлена связь более высоких показателей NT-proBNP с ЗПА. Повышение уровня hs-тропонина Т и hs-тропонина I было тесно связано с невропатией. Наблюдение в течение 21 года позволило обнаружить связь повышения уровня NT-proBNP, hs-тропонина T и hs-тропонина I с сердечно-сосудистой смертностью, при этом более высокий риск наблюдался при сочетании высокого уровня биомаркеров с ЗПА или невропатией.
Сердечно-сосудистые хирурги оценивают распространенность хронической ишемии нижних конечностей (ХИНК) примерно в 0,5–2,0%, отмечая, что этот показатель заметно выше в группе пожилых людей. Факторы риска ХИНК такие же, как при ИБС, наибольшее значение имеют курение сигарет, артериальная гипертония (АГ) и СД. У лиц с перемежающейся хромотой риск ампутации конечности в течение 5 лет оценивают в 5%, а в случае ХИНК он увеличивается каждый год на 25%. ЗАНК нередко сочетается с ИБС (50%) и ЦВЗ (20%). ХИНК серьезно увеличивает риск сокращения продолжительности жизни в целом. Смертность, не связанная с сердечно-сосудистыми событиями (ССС), например ассоциированная с онкологическими заболеваниями, при ЗАНК также выше, нежели в общей популяции, [9, 10].
Для пациентов с ЗАНК рекомендована комплексная программа, включающая модификацию образа жизни, лекарственную терапию и лечебную физкультуру. Жизненно важным является прекращение курения. Фармакотерапия направлена на уменьшение риска ССС и должна быть адаптирована к индивидуальным факторам риска, выявленным у пациента, например СД и/или АГ. Фармакотерапия, как правило, включает антитромботические препараты и статины3,4 [9].
Существующие методы лечения, направленные на реваскуляризацию и улучшение перфузии дистальных отделов конечностей, не всегда могут быть эффективными. Терапия антикоагулянтами и гиполипидемическими средствами позволяет снизить риск серьезных ССС, однако ХИНК нередко остается резистентной к медикаментозному лечению. Это побуждает авторов разрабатывать новые подходы к патогенетическому лечению, используя не только хорошо изученные (например, пентоксифиллин), но и экспериментальные (например, ангиогенные цитокины и клеточная терапия) препараты [12].
Во-вторых, важно учитывать возможность одновременного поражения периферических артерий и периферических нервов как осложнения СД, который, кроме всего прочего, может быть причиной ЦВЗ.
По мнению экспертов ВОЗ, СД «является хроническим, изнурительным, требующим больших расходов и сопровождающимся тяжелыми осложнениями заболеванием, которое создает большую угрозу для семей, государств-членов и всего мира». Всемирная диабетическая федерация (IDF) обращает внимание на ежегодный рост на нашей планете распространенности СД, которая среди взрослого населения в 2021 г. достигла уровня 10,5% и ожидает дальнейшего увеличения (до 783 млн человек к 2045 г.). Число случаев смерти от СД в мире в 2021 г. составило 6,7 млн.
По мнению эндокринологов, СД — это «группа болезней обмена, которые характеризуются хронической гипергликемией, что является результатом нарушения секреции и/или действия инсулина». Это приводит к поражению различных органов и систем организма, среди которых орган зрения, почки, нервная и сердечно-сосудистая системы [13]. Причиной основных осложнений СД обычно называют макро- и микроангиопатии. К последним принято относить нефропатию, ретинопатию. Макроангиопатии же наиболее важны тем, что способствуют развитию атеросклероза артерий, клинически проявляющегося ИБС, ЗАНК, ЦВЗ. Конечно, атеросклероз не является непосредственным осложнением СД, но именно последний приводит к раннему развитию и прогрессированию всего спектра клинических проявлений атеросклеротического поражения артерий при СД [14].
Известно, что сочетание СД с АГ, ожирением, нарушением обмена липидов и хронической сердечной недостаточностью увеличивает риск развития острых нарушений мозгового кровообращения и сосудистых когнитивных расстройств [13]. Поражение периферической нервной системы, ассоциированное с СД, принято называть диабетической невропатией [15]. При дополнительном вовлечении опорно-двигательного аппарата (развитие деструктивной артропатии) используют термин «диабетическая нейроостеоартропатия». Еще более широкое понятие «диабетическая стопа» применяется, когда невропатия дополняется нарушениями микроциркуляторного русла и артерий, суставов и костей стопы — исходом такого состояния может стать гангрена стопы.
Для всех врачей, непосредственной задачей которых является раннее выявление и диспансерное наблюдение больных СД, важно на ранней стадии распознать признаки диабетической невропатии и/или ангиопатии, поскольку это является залогом эффективного лечения и профилактики грубых нарушений ходьбы. Однако решение такой задачи может вызвать затруднения, поскольку определить этиологию невропатии и ангиопатии не всегда возможно у пациентов, страдающих от коморбидных заболеваний, даже в тех случаях, когда диагноз СД не вызывает сомнений [13].
По-прежнему важную роль играет детальный сбор анамнеза с акцентом на описание боли, нарушений чувствительности, особенностей нарушения ходьбы и связанного с ней нарушения равновесия. Важно оценить функцию каждого из черепных и периферических нервов после тщательного сбора жалоб. С целью диагностики вегетативной невропатии важно обратить внимание на симптомы, описывающие нарушения функций сердца, желудочно-кишечного тракта, почек, потоотделения и репродуктивной функции [13].
К неврологу могут обратиться пациенты с самыми разными жалобами, важно в процессе осмотра каждого пациента найти возможность оценить признаки вовлечения периферической нервной системы. Необязательно поводом для обращения к неврологу станут жалобы на нарушение функции ходьбы, боль и изменение чувствительности, характерные для невропатии. В таких случаях объективизировать такие симптомы будет несложно путем обнаружения признаков снижения вибрационной и иных видов чувствительности и/или вовлечения периферических нервов в виде угнетения рефлексов, снижения силы и нарушения трофики мышц и др. В иных ситуациях неврологи могут обнаружить проявления невропатии при проведении стандартного неврологического осмотра пациентов, обратившихся в связи с «головокружением», «снижением памяти» или другими жалобами. В сложных случаях для принятия решений полезны алгоритмы, разработанные на основе накопленного опыта и учитывающие этиологию и патогенез нарушения ходьбы (см. рисунок).
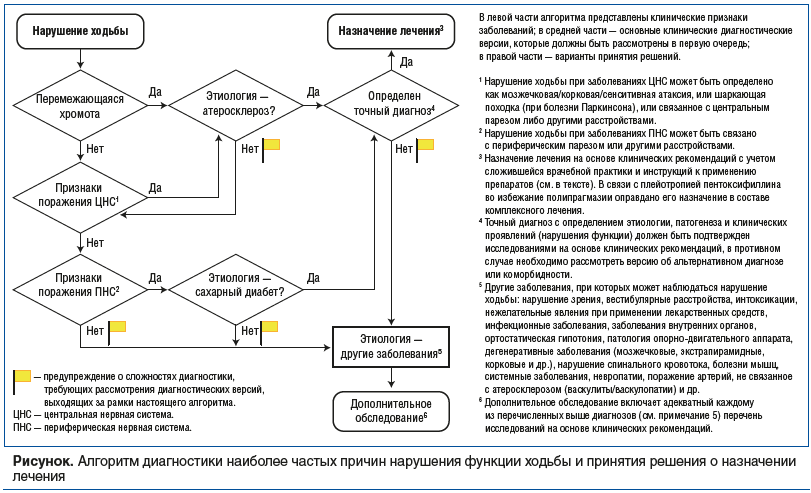
Важно помнить о том, что частота выявления моторно-сенсорной невропатии у пациентов с СД составляет 70–80%, в то время как признаки вовлечения периферических артерий выявляют у 19% больных. По этой причине ранняя диагностика диабетической невропатии особенно актуальна [16]. Представляет интерес поиск корреляции при исследовании средней скорости кровотока в бедренной и подколенной артериях нижних конечностей и скорости проведения импульсов по двигательным и сенсорным волокнам малоберцового нерва, икроножного нерва и большеберцового нерва у больных СД. Результаты показали, что такая корреляция существует, и это отражает единство патологического процесса, позволяя прогнозировать прогрессирование нарушения функции ходьбы [17].
Согласно современной позиции при СД ключевым механизмом поражения нервов и сосудов является именно хроническая гипергликемия, а ее устранение позволяет предотвратить серьезные осложнения СД. Патогенез диабетической невропатии многостадиен, его основные звенья: активация полиолового пути утилизации глюкозы (приводит к накоплению сорбитола и снижению активности протеинкиназы С в нервной ткани) (1); гликозилирование белковых молекул (2); изменение метаболизма жирных кислот (3); изменение синтеза нейротрофных факторов и их рецепторов (4); оксидативный стресс (5) [13]. Важно отметить, что на ранних этапах развития СД у многих людей повреждение нервов является обратимым, но на более поздних стадиях процесс становится необратимым и, вероятно, затрагивает всех пациентов3 [3].
Разработка программы лечения СД находится в компетенции эндокринолога. Большое значение при этом имеют увеличение приверженности больных СД лечению, учет коморбидных состояний, профилактика ЦВЗ, избегание полипрагмазии. Успешность лечения диабетической невропатии зависит от эффективности лечения СД. С точки зрения большинства эндокринологов, коррекция гликемии — основной и, возможно, единственный способ адекватного лечения СД, предотвращающий, во всяком случае на некоторое время, развитие диабетической невропатии и ангиопатии [13].
Однако некоторые авторы высказывают мнение о том, что адекватная коррекция гликемии не всегда обеспечивает профилактику прогрессирования диабетической невропатии и ангиопатии. При этом следует признать, что иные способы надежной профилактики и лечения диабетической невропатии разработаны недостаточно [18].
При обсуждении подходов к купированию боли, возникающей при диабетической невропатии, эндокринологам и неврологам удалось достигнуть консенсуса — используются антидепрессанты (дулоксетин, венлафаксин), антиконвульсанты (габапентин, прегабалин) или их сочетание [19, 20]. Однако очевидно, что именно разработка комплексного подхода к лечению коморбидных пациентов с нарушением функции ходьбы (при СД и/или атеросклерозе) позволит в перспективе сохранить активность пациентов и отодвинуть на более поздний срок неблагоприятные исходы.
Существенно снижает приверженность, а значит, и эффективность лечения коморбидных заболеваний (таких как атеросклероз и СД), полипрагмазия, поэтому необходимо назначать лекарственную терапию коморбидных заболеваний так, чтобы решить важнейшие задачи профилактики их осложнений — острых потенциально летальных заболеваний (таких как инфаркт миокарда и инфаркт головного мозга), по возможности влияя на патогенез заболевания и обеспечивая профилактику прогрессирования хронических нарушений (таких как сосудистые когнитивные расстройства, ИБС, непериферическая невропатия, ХИНК).
Одним из лекарственных средств, которое позволяет, согласно результатам многолетних мультицентровых международных и национальных исследований и официальной инструкции к препарату, обеспечить профилактику тяжелых сосудистых нарушений, считается пентоксифиллин.
Плейотропия пентоксифиллина известна, достаточно изучена, официально признана и характеризуется, в частности, влиянием на уровень фибриногена (снижение), гибкость эритроцитов (повышение), агрегацию тромбоцитов (ингибирование), активацию и адгезию нейтрофилов (ингибирование) и образование свободных радикалов (уменьшение) [21, 22]. Это позволяет одновременно решать вопросы профилактики развития и прогрессирования осложнений ЦВЗ (таких как нарушения концентрации внимания и снижение когнитивных функций, головокружение и нарушение функции ходьбы) и ЗАНК (см. рисунок).
По мнению Н.А. Ваулина [23], пентоксифиллин может быть назначен при облитерирующем атеросклерозе АНК, при перемежающейся хромоте — в дозировке 1200 мг/сут (удобнее применять ретардированные формы пентоксифиллина, например Вазонит®, по 600 мг 2 р/сут). Автор полагает, что пентоксифиллин целесообразно назначать после терапевтического изменения образа жизни и использования препаратов, указанных в международных и национальных клинических рекомендациях.
В.В. Косарев и С.А. Бабанов [24], полагая, что облитерирующий атеросклероз АНК является «частным проявлением системного патологического процесса — атеросклероза и отличается от других его форм (ИБС, хроническая ишемия головного мозга, хроническая ишемическая болезнь органов пищеварения и др.) лишь органом-мишенью», указывают на эффективность и безопасность пентоксифиллина, ссылаясь на многочисленные обзоры, включающие данные об изменении показателя дистанции безболевой ходьбы, и отмечают необходимость учета противопоказаний к назначению препарата, таких как острый инфаркт мио-карда, острый геморрагический инсульт, массивное кровотечение, кровоизлияние в сетчатку глаза.
А.В. Чупин и соавт. [25] обращают внимание на то, что ранним маркером атеросклероза как системного процесса, в который вовлекаются различные артериальные бассейны, является эндотелиальная дисфункция, а мультифокальный атеросклероз приводит к высокому риску острых и потенциально летальных ССС в любом из сосудистых бассейнов. Решению этой проблемы способствует назначение пентоксифиллина, эндотелиопротективное действие которого обусловлено угнетением продукции фактора некроза опухоли α и интерлейкинов, ответственных за эндотелиальную дисфункцию. Клиническая эффективность и безопасность препарата были доказаны в нескольких крупных отечественных исследованиях, проведенных в 2003–2011 гг. Одним из факторов, обеспечивавших приверженность лечению и создание стабильной терапевтической концентрации, может рассматриваться использование пентоксифиллина в дозировке 1200 мг/сут (таблетки 600 мг с пролонгированным высвобождением).
Работа Е.В. Исаковой и соавт. [26], посвященная изучению состояния микроциркуляторного русла у больных, перенесших инфаркт головного мозга, наглядно показывает, что при назначении пентоксифиллина (600 мг 2 р/сут), по данным проведенной авторами биомикроскопии бульбарной конъюнктивы в динамике, в бассейне внутренней сонной артерии у пациентов, перенесших инфаркт головного мозга, происходит восстановление микроциркуляторного русла, что выражается в «увеличении числа функционирующих капилляров, исчезновении сладжа, уменьшении числа «зон запустевания».
М.М. Танашян и О.В. Лагода [27], обсуждая вопросы профилактики атеротромботического инфаркта головного мозга, справедливо обращают внимание на то, что «наличие проявлений атеротромбоза в одном сосудистом русле повышает риск развития ишемических осложнений в другом», а «многофункциональные характеристики препарата пентоксифиллина (Вазонит®), в том числе улучшающего гемореологические свойства крови и церебральную микроциркуляцию» позволяют использовать его как для профилактики острых, так и для лечения хронических проявлений мультифокального атеросклероза. Для пациентов пожилого возраста в условиях полипрагмазии использование форм пролонгированного высвобождения препаратов особенно удобно, безопасно и повышает приверженность лечению, что учтено при разработке препарата Вазонит®.
В.В. Захаров [28] указывает на то, что патогенетическая терапия ЦВЗ (дисциркуляторная энцефалопатия) должна «быть направлена на оптимизацию мозгового кровотока и создание нейрометаболической защиты головного мозга от ишемии и гипоксии». Терапия пентоксифиллином способствует восстановлению нарушенных функций нервной системы при ЦВЗ, показывая весьма высокий профиль безопасности, в особенности (что важно) у лиц пожилого возраста.
D.S.H. Bell [29] обращает внимание на разнонаправленное действие пентоксифиллина, которое можно использовать в терапии СД и его осложнений, заболеваний периферических артерий, периферической невропатии, нефропатии, ретинопатии, ИБС и ЦВЗ. Пентоксифиллин может оказывать положительный эффект при неалкогольном стеатозе и стеатогепатите, которые тесно связаны с инсулинорезистентностью при СД 2 типа. Удивительно, но пентоксифиллин умеренно повышает резистентность к инсулину за счет улучшения капиллярного кровотока, а также функции β-клеток и снижения выработки глюкозы в печени. Терапевтические эффекты пентоксифиллина дополняют эффекты таких препаратов, как блокаторы ренин-ангиотензин-альдостероновой системы, при использовании в терапии диабетической нефропатии.
M. Al-Nimer et al. [30] и F. Hosseini et al. [31] указывают на то, что лечение пентоксифиллином улучшает качество жизни при синдроме диабетической стопы и дистальной диабетической невропатии. C. Broderick et al. [32] также сообщают о том, что пентоксифиллин положительно влияет на показатели дистанции безболевой ходьбы и общей дистанции ходьбы и в целом хорошо переносится.
Актуальна работа [33], авторы которой полагают, что в связи с вероятным влиянием пентоксифиллина на патогенез такого инфекционного заболевания, как COVID-19, он может быть использован у пациентов, инфицированных SARS-CoV-2, с целью профилактики и лечения неврологических проявлений постковидного синдрома, что требует дальнейшего изучения.
Представляются перспективными данные F. Fazely et al. [34] о том, что пентоксифиллин может снижать репликацию вируса иммунодефицита человека в мононуклеарных клетках периферической крови человека и в культивируемых Т-клетках. Кроме того, он способен снижать уровень фактора некроза опухоли α у онкологических больных, что приводит к улучшению их общего самочувствия.
В работе A. Meirovitz et al. [35] показан положительный эффект пентоксифиллина — а именно улучшение исходов, увеличение продолжительности жизни, массы тела и уменьшение частоты возникновения стоматита — при лечении больных раком толстой кишки в дополнение к химиотерапии. G. Golunski et al. [36] полагают, что пентоксифиллин не только сам по себе обладает противораковой активностью, но также повышает восприимчивость раковых клеток к лучевой терапии и снижает ее долгосрочные побочные эффекты. Вполне вероятно, что пентоксифиллин может повысить противораковый потенциал широко используемых противораковых препаратов, таких как цисплатин или доксорубицин, а также уменьшить нежелательные эффекты химиотерапии.
Таким образом, нарушение функции ходьбы у пациентов, особенно в пожилом возрасте, наиболее часто обусловлено сочетанием двух распространенных тяжелых заболеваний: СД (диабетическая периферическая невропатия) и атеросклероза (атеросклероз АНК). Ранняя диагностика этих болезней, с учетом коморбидных состояний, позволяет обеспечить своевременную лекарственную терапию, направленную на снижение риска смерти и инвалидизации. Одним из важных компонентов такого лечения является пентоксифиллин, плейотропия, эффективность и безопасность которого доказаны многочисленными многолетними наблюдениями.
Информация с rmj.ru
