Введение
Недостаточность митрального клапана (МК) в настоящее время занимает второе место по частоте встречаемости в структуре поражений клапанов, а в ряде стран со значительным увеличением продолжительности жизни конкурирует за первенство со стенозом аортального клапана [1].
На сегодняшний день недостаточность МК принято классифицировать как первичную, обусловленную органическими изменениями элементов клапанного аппарата, и вторичную, являющуюся следствием ремоделирования камер сердца при морфологически сохранных створках, хордах и папиллярных мышцах [2, 3].
Следует особо отметить, что развитие пролапса митрального клапана (ПМК) в своей основе всегда имеет органические причины, способствующие удлинению/отрыву хорд и удлинению створок, в их число входят и постинфарктные изменения. Так, например, постинфарктный фиброз головки папиллярной мышцы, сопровождающийся ее элонгацией и проявляющийся пролапсом ассоциированных с ней сегментов створок МК, считается первичным (органическим) пороком, поскольку обусловлен органическим поражением папиллярной мышцы. В то же время развивающиеся постинфарктные изменения левого желудочка (ЛЖ) (ремоделирование) ведут к формированию вторичной (относительной/функциональной) митральной недостаточности (МН), поскольку в этом случае в этиопатогенетическом механизме нарушения коаптации створок отсутствуют непосредственные (первичные, органические) изменения морфологии створок клапана и подклапанных структур. Дисфункция клапана обусловлена изменением геометрии ЛЖ [4].
Причины и механизм нарушения коаптационной функции клапана — не синонимичные понятия. Одни и те же причины могут продуцировать различные механизмы дисфункции клапана. В своем докладе «French correction» в 1983 г. французский хирург А. Карпантье представил анатомо-функциональную классификацию механизмов нарушения коаптации створок, в соответствии с которой до сих пор осуществляется выбор метода хирургической коррекции в большинстве кардиохирургических центров мира [5].
Классификация А. Карпантье представляет собой разделение видов дисфункции МК в зависимости от наличия одного из трех ведущих механизмов развития нарушения коаптационной функции его створок:
тип I — нормальная подвижность створок (аннулэктазия, расщепление створок, перфорация створки);
тип II — пролапс створок (удлинение/отрыв хорд, удлинение/отрыв папиллярной мышцы, миксоматозное изменение створок);
тип IIIa — рестриктивная подвижность створок, систоло-диастолическая рестрикция (укорочение хорд / папиллярных мышц);
тип IIIb — рестриктивная подвижность створок, изолированная систолическая рестрикция (дилатация ЛЖ).
Основываясь на вышеизложенной классификации, можно привести ряд примеров заболеваний или состояний, сопровождающихся развитием дисфункции МК:
примерами развития I типа дисфункции могут являться следующие причины: перфорация створки МК (первичная дисфункция), дилатация левого предсердия (ЛП) и неишемическая кардиомиопатия (вторичные дисфункции);
примерами развития II типа дисфункции первичного генеза могут быть Болезнь Барлоу (ББ), отрыв хорд;
примерами развития IIIa типа дисфункции первичного генеза могут быть ревматическое поражение, кальциноз МК;
примером развития IIIb типа дисфункции вторичного генеза может быть ремоделирование ЛЖ при развитии ишемической кардиомиопатии, постинфарктной аневризмы ЛЖ.
Предметом настоящего обсуждения является патология МК, связанная с нарушением коаптационной функции створок, развивающаяся посредством реализации механизма II типа дисфункции первичного генеза, т. е. пролапса створок МК.
Здесь необходимо заметить, что зачастую взгляды на проблему со стороны кардиолога и кардиохирурга не совпадают. Современное определение ПМК подразумевает систолическое смещение створки по длинной оси за пределы плоскости фиброзного кольца (ПФК) как минимум на 2 мм, с утолщением или без утолщения створки от 5 мм и более [6]. В России кардиологи оценивают факт наличия и выраженность дисфункции на основании тех же критериев, приведенных в классификации Н.М. Мухарлямова, согласно которой I степень ПМК соответствует 2–5 мм движения створки в сторону предсердия, II степень — 6–8 мм и III степень — 9 мм и более над уровнем левого атриовентрикулярного отверстия [7].
В то же время в кардиохирургическом сообществе сформирован альтернативный подход к данной проблеме, который базируется на основании консенсуса о том, что наличие только лишь самого факта систолического смещения створки по длинной оси за пределы ПФК как минимум на 2 мм и более как эхокардиографический/морфологический критерий не имеет непосредственного клинического интереса ввиду отсутствия значимой (влияющей на внутрисердечную гемодинамику) регургитации. Помимо этого, данные о степени пролабирования створки не несут в себе информации об изменении площади коаптирующих поверхностей и, соответственно, информации, требующейся для принятия решения о необходимости вмешательства на клапанном аппарате и выбора метода предполагаемой реконструкции. Соответственно, определение пролапса, ориентированное на выработку конкретных мероприятий, нацеленных на восстановление нарушенной функции клапана, более актуально в клинической практике. Концепция А. Карпантье содержит в себе следую-щие базисные утверждения:
– пролапс створки — это дисфункция клапана, когда во время систолы желудочка свободный край створки выходит за пределы ПФК МК — зоны коаптации;
– пролапс — это не болезнь [5].
Иными словами: пролапс — это дисфункция с регургитацией, но не болезнь, а лишь ее проявление и не причина, а следствие.
Заболеванием (или причиной) в рассматриваемом случае является ББ — одна из двух доминирующих форм дегенерации МК, характеризующаяся наличием морфологических изменений в соединительной ткани, запускающих механизм нарушения коаптационной функции створок в виде пролапса, обусловленного отрывом или удлинением хорд, увеличением площади створок и аннулэктазией. ББ имеет четкие морфологические признаки, позволяющие дифференцировать заболевание от других форм дегенеративного поражения МК. Патологическими признаками ББ при гистологическом исследовании является миксоидная инфильтрация, которая разрушает трехслойную архитектуру створок, изменяя свойства коллагена [8]. При этом миксоидная инфильтрация поражает весь клапан, соответственно billowing — синдром вздымающейся митральной створки — как правило, присутствует в нескольких сегментах. Этиология ББ до сих пор неясна, хотя многие авторы указывают на генетическую предрасположенность [9].
Другой часто встречающейся формой дегенеративного поражения МК является фиброэластический дефицит (ФЭД) в створках МК. В основе патологического процесса при данном поражении лежит недостаточная выработка эластина, коллагена и протеогликанов, что проявляется в виде истончения створок. В пролабирующих сегментах выявляются миксоидные изменения с соответствующим утолщением створки, однако трехслойная структура створки при этом сохраняется [8, 10].
Среди дегенеративных поражений МК присутствуют и другие нозологии, проявляющиеся синдромом поражения соединительной ткани. К ним относятся синдромы Марфана, Элерса — Данлоса, Тернера. Несовершенный остеогенез также может быть ассоциирован с поражением МК, напоминающим ББ. Например, дегенерация соединительной ткани створок при синдроме Марфана часто ассоциирована с МН. Как и в случае с ББ, при синдроме Марфана в створках наблюдаются высокий уровень миксоидной инфильтрации и избыток ткани, однако изменения эластических волокон при этом более выраженные и отмечаются также во внесердечных тканях [11–13].
В популяции пациентов с ПМК распространенность ББ оценивается в 24%, ФЭД — в 76%, прочие соединительнотканные дисплазии встречаются в 1–2% наблюдений [14, 15]. Различаясь этиологически, эти формы имеют также уникальные клинические и эхокардиографичес-кие отличия. Дифференциация пациентов с различными механизмами поражения МК очень важна перед принятием решения о необходимости вмешательства и выборе метода хирургического лечения, поскольку сами методы, доступы к клапану и хирургические приемы, необходимые для восстановления коаптационной функции, различаются и/или сочетаются в зависимости от этиоморфогенеза развития МН.
В настоящее время благодаря совершенствованию диагностических технологий и ужесточению критериев постановки диагноза распространенность ПМК оценивается в 2,4% в общей популяции [13], в то время как еще на рубеже 80–90-х годов XX в. этот показатель достигал 35%, что объясняется ошибочным представлением в недавнем прошлом о плоской поверхности створок МК и буквальным пониманием понятия «плоскость фиброзного кольца» [16]. Но уже в 1988 г. в работе R. Levine указывались более жесткие критерии использования 2D-эхокардиографии (ЭхоКГ) для диагностики пролапса, в частности, им было установлено, что выявление смещения створки выше уровня фиброзного кольца при проведении ЭхоКГ лишь из апикальной 4-камерной позиции не является свидетельством патологических изменений [17]. Позднее внедрение в клиническую практику 3D-ЭхоКГ и магнитно-резонансной томографии (МРТ) сердца подтвердило правильность данного подхода к диагностике ПМК и, соответственно, повлияло на подсчет распространенности данной дисфункции в популяции [6].
Болезнь Барлоу имеет весьма вариабельную клиническую картину. В 20–60% случаев заболевание протекает бессимптомно [18]. Такие клинические симптомы, как одышка, кашель, снижение толерантности к физической нагрузке, перебои в работе сердца, связаны с развитием значимой МН или вторичных изменений на фоне длительно существующей пограничной МН1.
При физикальном обследовании сердца у пациентов без МН может выявляться систолический «щелчок», при МН выслушивается систолический шум на верхушке, характер которых может изменяться при перемене положения тела, физических нагрузках [19]. При значимой или длительно существующей МН верхушечный толчок усилен и смещен влево, отмечаются смещение левой границы влево, верхней границы вверх, признаки эксцентрической гипертрофии ЛЖ. При аускультации сердца в области верхушки (в 1-й точке аускультации) определяются ослабленный I тон, систолический шум, который проводится в аксиллярную (подмышечную) область[1], иногда выслушивается III тон (протодиастолический ритм галопа), связанный с перегрузкой ЛЖ увеличенным объемом регургитации, еще реже — короткий, мезодиастолический шум (шум Кумбса), который является функциональным и обусловлен относительным стенозом левого атриовентрикулярного отверстия на фоне тяжелой МН [14].
Считается, что физикальными патогномоничными признаками ПМК являются среднесистолический клик — щелчок (непродолжительный, высокочастотный звук) и поздний систолический шум. При аускультации в вертикальном положении систолический клик выслушивается ближе к I тону, а шум становится более продолжительным1.
Диагностируют ББ в основном методом трансторакальной и чреспищеводной ЭхоКГ, реже — при проведении МРТ [20]. Подтверждается наличие данной патологии визуальной макроскопической оценкой МК во время операции: при наличии избыточных миксоматозных тканей нескольких сегментов обеих створок, дилатированного митрального кольца, элонгированных/оторванных хорд обеих створок. В отличие от ББ при ФЭД наблюдается избыточность тканей, визуально макроскопически ограниченных лишь пролабирующим сегментом (утолщение только пролабирующих зон), при этом кольцо МК может быть как дилатировано, так и иметь нормальные размеры [21].
Осложнения течения ББ включают в себя: атриомегалию, нарушения ритма сердца по типу фибрилляции предсердий и желудочковых аритмий, развитие МН, сердечной недостаточности, ишемического инсульта, инфекционного эндокардита, разрывы сухожильных хорд, отек легких и внезапную сердечную смерть (с частотой 2:10000 в год) [22, 23].
Следует заметить, что показанием к направлению пациента с предполагаемой ББ на хирургическое лечение является не сам факт предположения наличия у пациента ББ, а выявление нарушения коаптации створок с формированием умеренной или тяжелой МН, сопровождающейся эхокардиографическими признаками увеличения ЛП, развития сердечной недостаточности с наличием клинической симптоматики, приведенной выше, или без таковой.
Представляем собственное клиническое наблюдение успешного хирургического лечения пациентки с ББ. Успешность реконструктивно-пластической операции на МК у 44-летней женщины с ББ обусловлена точностью диагностики и своевременностью оказанной помощи, базирующихся на большом опыте применения различных хирургических техник, направленных на устранение ББ.
Содержание статьи
Клиническое наблюдение
Женщина 44 лет была госпитализирована в связи с появлением учащенного неритмичного сердцебиения, выраженной одышки в ночные часы, беспокоящих в течение недели. Учащенное сердцебиение, слабость при умеренных физических нагрузках, повышенную утомляемость отмечала в течение двух лет до госпитализации. Со слов больной, в раннем детстве был диагностирован ПМК, наблюдалась кардиологом.
При физикальном обследовании отмечалось смещение верхушечного толчка вниз и влево, аускультативно — ослабление I тона, среднесистолический щелчок и следующий за ним поздний систолический шум на верхушке сердца, проводящиеся в левую аксиллярную область.
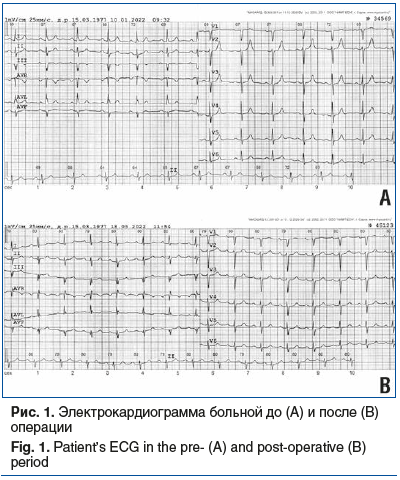
На ЭКГ (рис. 1А) ритм синусовый с ЧСС 60 в 1 мин. Отклонение электрической оси сердца влево. Нарушение внутрижелудочковой проводимости.
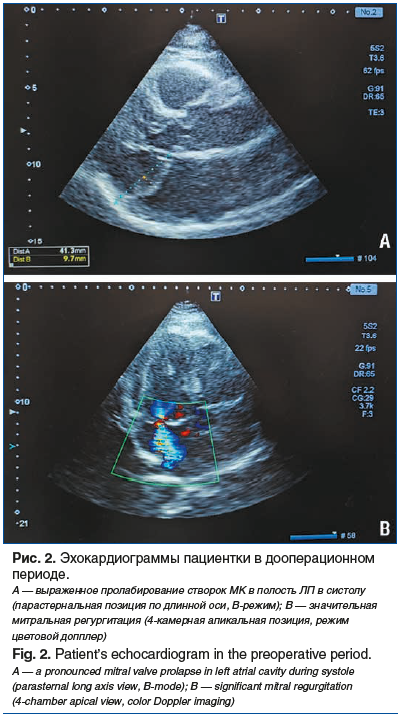
По данным ЭхоКГ (рис. 2) выявлена дилатация ЛЖ — конечный диастолический размер составил 6,3 см (норма (N) до 5,5 cм), конечный диастолический объем 170 мл (N до 138 мл), фракция выброса ЛЖ по Симпсону 59% (N≥55%), индекс массы миокарда ЛЖ 130 г/м2 (N до 95 г/м2), локальная сократимость миокарда не нарушена; дилатация ЛП: 4,7 см (N до 4,0 cм) в парастернальной позиции по длинной оси, 5,87×7,1 см (N до 4,0×4,8 см) в апикальной позиции, объем 155 мл (N до 60 мл); дилатация правого предсердия в апикальной позиции: 4,1×7,0 см (N до 3,8×4,6 см), объем 90 мл (N до 60 мл). Створки МК утолщены за счет выраженной миксоматозной дегенерации, пролабируют в полость ЛП до 1,5 см. Хорды удлинены. Диаметр фиброзного кольца (ФК) МК 45 мм (N до 40 мм). Градиент давления на МК составил 3,5/1,1 мм рт. ст. (N до 10/5 мм рт. ст.), площадь митрального отверстия 4,5 см2. При цветовом допплеровском картировании кровотока определяется высокоскоростная, центральная струя регургитации, распространяющаяся по всей полости ЛП. Vena contracta 8 мм. Площадь регургитации занимает 50% от площади ЛП. Заключение: выраженная миксоматозная дегенерация МК (предположительно ББ). Выраженный пролапс створок МК. Митральная аннулэктазия. МН 3-й степени. Умеренная дилатация левых камер, правого предсердия. Трикуспидальная недостаточность 1-й степени. Недостаточность клапана легочной артерии 1-й степени. Легочная гипертензия 1-й степени (систолическое давление в легочной артерии 40 мм рт. ст.).
Больная проконсультирована врачом-генетиком. Заключение: учитывая отсутствие проявлений дисплазии соединительной ткани, мутаций в гене филамина (FLNA), миксоматозную дегенерацию сворок МК с наличием МН 3-й степени, у пациентки высока вероятность наличия ББ.
Пациентке выполнена пластическая реконструкция МК в объеме: резекции задней створки в сегменте Р2, митральной аннулопластики опорным кольцом (34 мм), парааннулярной пликации ЛП. При интраоперационной ревизии МК выявлены миксоматозная дегенерация, утолщение всех сегментов створок, створки плотные, фиброзно изменены, тотально пролабируют в полость ЛП. Визуализирован клефт передней створки между сегментами А2 и А1, клефт задней створки между сегментами Р1 и Р2, пролапс свободного края задней створки в сегменте Р2, обусловленный отрывом хорд I порядка.
Клефт передней створки ушит. Сегмент P2 триангулярно резецирован с последующим ушиванием дефекта. Выполнена аннулопластика МК опорным кольцом Мedtronic CG Future Annuloplasty Ring 34 mm 15 отдельными П-образными швами нитью «Этибонд». Выполнена линейная шовная пликация ЛП.
Послеоперационный период протекал без осложнений. Проводилась плановая антибактериальная, противовоспалительная, антиаритмическая, гастропротективная терапия, коррекция кислотно-основного состояния, электролитов.
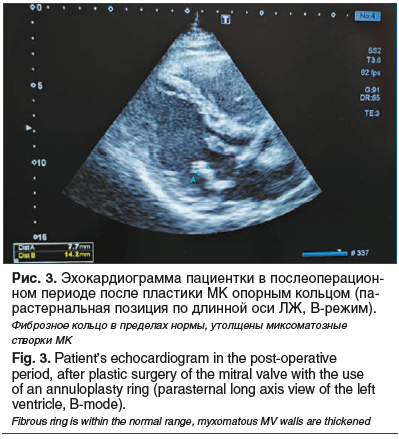
В послеоперационном периоде ЭКГ без существенной динамики (рис. 1В). При ЭхоКГ локальная сократимость ЛЖ во всех сегментах в пределах нормы (рис. 3). Градиент давления после пластики МК опорным кольцом Medtroniс-34 в пределах нормы, регургитация 0–1-й степени. Локальная сократимость миокарда и глобальная систолическая функция ЛЖ не нарушены. Данных за наличие перикардиального выпота нет. Трикуспидальная недостаточность 1-й степени.
Дренажи удалены на 3-и сутки после операции. Послеоперационные раны зажили первичным натяжением. Больная выписана в удовлетворительном состоянии на 10-е сутки для дальнейшей реабилитации.
Обсуждение
На сегодняшний день восстановление функции МК в случае осложненного течения ББ может быть достигнуто только хирургическими методами. При этом можно однозначно утверждать, что, обсуждая выбор хирургического пособия у пациентов с ББ, мы учитываем только такие хирургические методы и приемы, которые позволяют устранить пролапс и патологическую митральную регургитацию.
Определение ПМК подразумевает систолическое смещение створки по длинной оси за пределы ПФК как минимум на 2 мм с утолщением или без утолщения створки от 5 мм и более [6].
В кардиологическом сообществе до сих пор устойчиво представление, что ББ и ПМК — это во многом синонимичные понятия. Сам же Дж. Барлоу уже в 1985 г. безоговорочно признал, что «после того как в 1966 году Крайли ввел термин «пролапс» и уточнил его аудио- и киноангиографические проявления, данный термин стал слишком широко использоваться в клинической практике, даже несмотря на малую анатомическую выраженность, эхокардиографическую очевидность, абсолютную функциональную компетентность клапана и отсутствующую клиническую симптоматику. Именно это и привело к общей путанице среди терапевтического сообщества в использовании терминов «billowing» — «вздымающаяся створка», «floppy» — «болтающаяся створка», «prolapse» — «пролапс» и «fail» — «молотящая створка» [6]. В настоящее время при развитии 3D-эхокардиографической визуализации аускультативные, 2D-эхокардиографические, киноангиокардиографические и другие клинические признаки пролапса и МН должны соотноситься с точными объективными анатомо-функциональными характеристиками механизма развития недостаточности МК и степени его выраженности. В связи с этим концепция А. Карпантье четко определяет различия между пролапсом створок и их вздыманием (billowing). В этом контексте использование термина «пролапс» было ограничено исключительно неспособностью коаптирующей поверхности митральной створки нормально прилегать к оппозиционной створке (выполняя свою гидро-запирательную функцию). Эта концепция подразумевает, что при условии отсутствия перфораций в створке клапана он будет считаться компетентным, пока имеет место нормальная коаптация с оппозиционной поверхностью и нормальной гидро-запирательной функцией. Однако потеря коаптационной способности и гидро-запирательной функции может манифестировать и без вздымания (billowing) тела створки, к примеру при наличии ее перфорации, при этом МН будет неизбежна. Нарушение коаптационной функции может иметь место в случае, если один или несколько сегментов будут фиброзированы или ограничены в подвижности, а также в случае смещения коаптирующей поверхности створки относительно плоскости расположения клапана (ПФК). При этом, исходя из хирургических принципов, мы считаем, что в норме свободный край створок во время систолы остается на одном уровне (5–10 мм ниже ПФК), обеспечивая адекватную коаптацию и оптимальную гидро-запирательную функцию.
Таким образом, основываясь на согласованной концепции Дж. Барлоу и А. Карпантье, следует признать, что нормальные створки МК после закрытия могут (или даже должны) слегка вздыматься — billowing — в полость ЛП относительно ПФК (рис. 4).
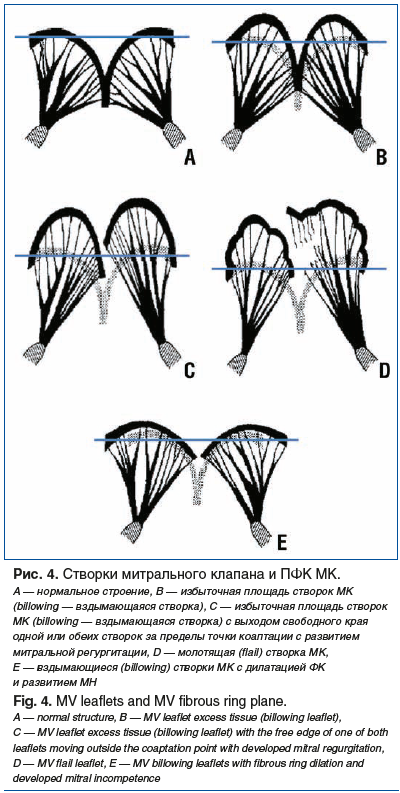
Избыточная площадь створок (рис. 4В), степень которой может варьировать от генерализованной или диффузной (вовлекающей все сегменты) до ограниченной (вовлекающей только один сегмент), должна называться «billowing» — «вздымающаяся створка». Такая анатомия клапана клинически может проявляться характерным систолическим щелчком, однако в случае умеренной выраженности и отсутствия нарушений коаптации и гидро-запирательной функции это может не визуализироваться при ЭхоКГ. И наоборот (что происходит, на наш взгляд, чаще), по данным ЭхоКГ возможна визуализация аномалии при полном отсутствии характерной аускультативной картины.
В отношении данной анатомии в руководстве А. Карпантье «Reconstructive valve surgery» приводится следующий комментарий: Пролапс створки следует отличать от вздымающейся (billowing) створки, наблюдаемой при ББ. Клапан Барлоу, неправильно называемый ПМК, представляет собой систолическое выпячивание тела створки из-за избытка ткани створок, при этом свободный край створки, длительное время оставаясь ниже ПФК, обеспечивает нормальную коаптацию и гидро-запирательную функцию клапана. В подобной ситуации будет иметь место следующая схема (рис. 4В).
Если выраженность billowing (вздымающаяся створка) будет прогрессировать, возможен выход свободного края одной или обеих створок за пределы точки коаптации, т. е. формирование истинного пролапса — реализации механизма МН [24]. При истинном ПМК МН неизбежна, и аускультативно (с высокой степенью вероятности) это будет проявляться систолическим шумом (рис. 4С). Как правило, ПМК наблюдается при значительной избыточности площади створок и значительном удлинении хорд.
То же самое, но уже с отрывом хорд называется «молотящая створка» («flail»). В данном случае МН будет носить выраженный или тотальный характер (рис. 4D).
Необходимо отметить, что при ничтожно выраженных вздымающихся — billowing — створках дилатация ФК снижает противодействие оппозиционной створки и может способствовать дополнительному растяжению хордального аппарата, провоцируя тем самым формирование пролапса с развитием МН (рис. 4E).
Резюмируя вышеизложенное, можно утверждать, что с хирургической точки зрения ПМК часто обусловлен наличием ББ, однако ББ далеко не всегда сопровождается ПМК с развитием значимой МН.
В соответствии с изложенной А. Карпантье концепцией пролапс (являющийся причиной МН) — это не заболевание, а его проявление, не причина болезни, а следствие, имеющее конкретный механизм повреждения запирательной функции клапана, который характеризуется как тип II дисфункции МК. Формирование объемной перегрузки камер сердца из-за МН на фоне пролапса способствует развитию ремоделирования ЛЖ и расширению ФК МК, что, в свою очередь, еще больше уменьшает площадь коаптации и усугубляет выраженность МН (своеобразный порочный круг), соответствующей уже I типу дисфункции МК. Таким образом, у одного пациента может иметь место не один анатомо-морфологический тип МН, а их сочетание, как и было в обсуждаемом нами клиническом наблюдении.
Только понимание анатомо-функциональных механизмов развития дисфункции клапана позволяет хирургу выбрать подходящую методику для восстановления его коаптационной функции. При выявлении механизма формирования МН II типа (пролапс) будет оправданным использование методов ограничения аномальной подвижности створок (в нашем случае выбрана резекция пролабирующего сегмента, но также можно рассматривать использование искусственных хорд и шов Альфиери). В свою очередь, коррекция дальнейшего прогрессирования расширения ФК МК (соответствующего I типу дисфункции) в рассмотренном случае проведена путем имплантации опорного кольца — ринга 34 мм.
Заключение
Представленное клиническое наблюдение наглядно демонстрирует эффективность, безопасность и безусловную необходимость использования в повседневной клинической практике приведенных нами принципов и концепции, поскольку успешная реконструктивно-пластическая операция на МК у 44-летней женщины с ББ проведена, на наш взгляд, исключительно благодаря точной диагностике, своевременно оказанной помощи и правильно выбранной хирургической тактике, базирующейся на точном понимании анатомо-функциональных механизмов развития МН, а также большом опыте применения различных хирургических техник и приемов, направленных на ее устранение. При дальнейшей адекватной терапии, на фоне регулярного динамического ЭхоКГ-контроля функции МК ожидается улучшение качества жизни пациентки при благоприятном клиническом прогнозе.
Приведенные в статье подходы на основе анатомо-функциональной концепции позволяют использовать ЭхоКГ не как описательный метод, а как руководство к выбору одной или нескольких наиболее подходящих к конкретному клиническому случаю типу дисфункции из разработанных на сегодняшний день хирургических техник.
Понимая описанные в статье принципы, врачи общей практики, кардиологи и функциональные диагносты смогут эффективнее взаимодействовать с хирургами и свое-временно, персонифицированно, эффективно и безопасно проводить лечение пациентов с дегенеративными заболеваниями МК.
При диагностике, подборе терапии, диспансерном наблюдении и принятии решения о необходимости направления пациентов с различными механизмами развития МН к хирургу, а также последующем выборе хирургической тактики, хирургического метода и послеоперационного лечения необходимо руководствоваться исключительно командным подходом по принципу Heart team, благодаря которому пациенты будут жить дольше и чувствовать себя лучше.
Сведения об авторах:
Резник Елена Владимировна — д.м.н., доцент, заведующая кафедрой пропедевтики внутренних болезней лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач-кардиолог, терапевт, врач функциональной диагностики ГБУЗ «ГКБ № 31 им. академика Г.М. Савельевой ДЗМ»; 115516, г. Москва, ул. Лобачевского, д. 42; ORCID iD 0000-0001-7479-418X.
Голубев Юрий Юрьевич — к.м.н., доцент кафедры пропедевтики внутренних болезней лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0971-3616.
Юртаева Наталья Валерьевна — врач функциональной диагностики ФГКУ ЦП ФСБ России; 107031, Россия, г. Москва, Варсонофьевский пер., д. 5, стр. 1.
Заяц Дарья Владимировна — врач функциональной диаг-ностики ФГКУ ЦП ФСБ России; 107031, Россия, г. Москва, Варсонофьевский пер., д. 5, стр. 1.
Ищенко Галина Юрьевна — к.м.н., врач-терапевт АНО ЦКБ святителя Алексия; 119071, Россия, г. Москва, Ленинский пр-т, д. 27.
Катков Андрей Ильич — к.м.н., доцент кафедры сердечно-сосудистой хирургии ФДПО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач сердечно-сосудистый хирург ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-2338-089X.
Пузенко Дмитрий Владимирович — к.м.н., и.о. заведую-щего кафедрой сердечно-сосудистой хирургии ФДПО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач сердечно-сосудистый хирург ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-2607-3895.
Новикова Екатерина Андреевна — врач-кардиолог КДО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0009-0004-2677-049X.
Леднев Павел Владимирович — к.м.н., врач сердечно-сосудистый хирург отделения кардиохирургии № 2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского»; 119991, Россия, г. Москва, Абрикосовский пер., д. 2, корп. 2; ORCID iD 0000-0002-3033-4146.
Голухов Георгий Натанович — д.м.н., член-корреспондент РАН, заместитель председателя Общественного совета при Департаменте здравоохранения города Москвы, президент ГБУЗ «ГКБ № 31 им. академика Г.М. Савельевой ДЗМ»; 119415, г. Москва, ул. Лобачевского, д. 42, стр. 1–6; ORCID iD 0000-0002-0161-005X. Контактная информация: Резник Елена Владимировна, e-mail: elenaresnik@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 14.11.2022.
Поступила после рецензирования 07.12.2022.
Принята в печать 08.02.2023.
About the authors:
Elena V. Reznik — Dr. Sc. (Med.), associate professor, Head of the Department of Propedeutics of Internal Diseases, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; cardiologist, therapist, functional diagnostics physician, Academician G.M. Savel’eva City Clinical Hospital No. 31; 42, Lobachevskiy str., Moscow, 115516, Russian Federation; ORCID iD 0000-0001-7479-418X.
Yuri Yu. Golubev — C. Sc. (Med.), associate professor of the Department of Propedeutics of Internal Diseases, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-0971-3616.
Natalya V. Yurtaeva — functional diagnostics physician, Central Polyclinic of the FSB of Russia; 5, bldn. 1, Varsonofevsky lane, Moscow, 107031, Russian Federation.
Darya V. Zayats — functional diagnostics physician, Central Polyclinic of the FSB of Russia; 5, bldn. 1, Varsonofevsky lane, Moscow, 107031, Russian Federation.
Galina Yu. Ishchenko — C. Sc. (Med.), therapist, Autonomous Non-commercial Organization Central Clinical Hospital of Svyatitel Aleksiy; 27, Leninsky Prospect, Moscow, 119071, Russian Federation.
Andrey I. Katkov — C. Sc. (Med.), associate professor of the Department of Cardiovascular Surgery, Faculty of Additional Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; cardiovascular surgeon, N.N. Blokhin National Medical Research Center; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0000-0002-2338-089X.
Dmitry V. Puzenko — C. Sc. (Med.), Acting Head of the Department of Cardiovascular Surgery, Faculty of Additional
Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; cardiovascular surgeon, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0000-0002-2607-3895.
Ekaterina A. Novikova — cardiologist, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0009-0004-2677-049X.
Pavel V. Lednev — C. Sc. (Med.), cardiovascular surgeon of Cardiac Surgery Department No. 2, Academician B.V. Petrovskiy Russian Scientific Center of Surgery; 2, Abrikosovskiy lane, Moscow, 119991, Russian Federation; ORCID iD 0000-0002-3033-4146.
Georgy N. Golukhov — Dr. Sc. (Med.), Corresponding Member of the Russian Academy of Sciences, Deputy Chairman of the Public Council at the Moscow Health Department; President, Academician G.M. Savel’eva City Clinical Hospital No. 31; 42, Lobachevskiy str., Moscow, 115516, Russian Federation; ORCID iD 0000-0002-0161-005X.
Contact information: Elena V. Reznik, e-mail: elenaresnik@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 14.11.2022.
Revised 07.12.2022.
Accepted 08.02.2023.
Информация с rmj.ru
