Введение
Инфаркт миокарда (ИМ) и его последствия остаются одной из главных проблем современной медицины. Ряд исследований, выполненных в недавние годы, позволяет предположить, что перенесенный первичный ИМ, несмотря на современные методы лечения, несет в себе так называемый высокий остаточный риск повторных сердечно-сосудистых событий, в первую очередь повторного ИМ, который часто может оказаться смертельным. Из доступных на сегодняшний день путей решения этой проблемы можно отметить необходимость жесткого следования имеющимся данным доказательной медицины. Это касается как вторичной профилактики повторного ИМ, так и методов его лечения в острой фазе и в отдаленном периоде [1]. Одновременно с этим есть необходимость в продолжении поиска новых фармакоинвазивных подходов к уменьшению остаточного риска. Исследования последних 5 лет обнаружили влияние микробной экосистемы человека на развитие сердечно-сосудистых заболеваний (ССЗ). В настоящее время изучение связи кишечного микробиома и ССЗ крайне важно для понимания патогенеза данных состояний и поиска возможностей их коррекции [2]. Большая часть работ к настоящему времени детально характеризует изменения и связи, выявленные в эксперименте на лабораторных животных. Исследований реальной клинической практики, особенно проспективных, значительно меньше, и в основном они выполнены за рубежом.
Бактерии кишечника «общаются» и «координируют» свое поведение с помощью секреции сигнальных молекул. Изменения в составе микробиоты могут ассоциироваться с активацией провоспалительного потенциала, продукцией большого числа цитокинов, способствующих поддержанию латентного воспаления и дестабилизации атеросклеротической бляшки в коронарной артерии [3].
Цель исследования: оценить состояние микробиоты толстой кишки и уровней сывороточных провоспалительных молекул в отдаленном периоде ИМ.
Материал и методы
Работа была выполнена на базе кафедры госпитальной терапии и кардиологии ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России в период с 2022 по 2025 г. Объем наблюдений составил 101 человек. Исследование было простым открытым сравнительным проспективным.
Критериями включения в опытную (1-ю) группу являлись возраст от 25 до 60 лет, верифицированный диагноз ИМ с подъемом сегмента ST (ИМпST) на электрокардио-грамме (ЭКГ) 1-го типа не позднее 12 ч до момента поступления в региональный сосудистый центр, согласие на проведение коронароангиографии, согласие на участие в исследовании.
К критериям невключения в опытную группу были отнесены: любые формы острого коронарного синдрома в анамнезе, догоспитальная тромболитическая терапия, нарушение когнитивных функций, не позволяющее участвовать в исследовании, врожденные и приобретенные пороки сердца, хронические заболевания почек (скорость клубочковой фильтрации <30 мл/мин/1,73 м2 по формуле CKD–EPI), печени (хронические гепатиты, циррозы) и поджелудочной железы (наличие экзокринной недостаточности), наличие сахарного диабета и других нарушений углеводного обмена, наличие воспалительных заболеваний кишечника, операции на органах желудочно-кишечного тракта в анамнезе, наличие инфекционных заболеваний, беременность и употребление антибактериальных препаратов в предшествующий месяц, отказ от участия в исследовании.
Все обследуемые были разделены на две группы: 1-я группа — 51 пациент с ИМпST 1-го типа на ЭКГ и 2-я группа — 50 человек без ССЗ, сопоставимых по возрасту и полу. Диагноз ИМпST на ЭКГ устанавливался в соответствии с действующими на момент набора материала клиническими рекомендациями Минздрава России1.
Дополнительно к стандартным лабораторным тес-там выполняли специальное комплексное лабораторное обследование: количественным методом иммуноферментного анализа на иммуноферментном планшетном ридере ELx800 (BioTek, Inc) определяли концентрации интерлейкина (IL) 6, IL-1β, IL-18, С-реактивного белка (СРБ), фактора некроза опухолей α (ФНО-α), моноцитарного хемотаксического белка-1 (МСР-1), белка, связывающего жирные кислоты (БСЖК). Для этого использовали наборы производства ЗАО «Вектор-Бест». В соответствии с инструкцией референсными значениями считали: 0,18±0,04 пг/мл для ФНО-α, 3,6±0,6 пг/мл для IL-1β, 10,3±1,23 пг/мл для IL-6, 104–650 пг/мл для IL-18, 9,2–138,5 пг/мл для MCP-1, 0–5 мг/л для СРБ, <1600 нг/мл для БСЖК.
Первый образец стула с момента появления клинических проявлений ИМ в течение 1 ч направляли в бактериологическую лабораторию для проведения анализа на дисбиоз и определения количественного и качественного состава микрофлоры2. Посевы инкубировали при стандартном режиме термостата (37°С) в течение 1–2–7 сут. По окончании срока инкубации на плотных средах осуществляли подсчет всех типов выросших колоний, из биомассы которых, а также микробной взвеси из пробирочных сред готовили и микроскопировали препараты, окрашенные по Граму. Подсчет количества каждого вида микроорганизмов в 1 г отобранного материала (М) проводили по формуле: M=N×10n+1, где N — количество выросших колоний на чашке; n — степень разведения материала. Определение проводили в колониеобразующих единицах (КОЕ) в 1 г фекалий в пересчете на десятичный логарифм. Количество анаэробов регистрировали по наличию признаков роста в пробирках в соответствии со степенью разведения.
Одновременно с этим у 17 пациентов изучали уровни провоспалительных молекул в супернатантах из полученных образцов фекалий на госпитальном этапе и в отдаленном периоде.
Через 207 [158; 214] дней после индексируемого события по сведениям, внесенным в Единую информационную систему здравоохранения Пермского края, оценивали выживаемость и количество повторных случаев ИМ. Кроме того, выполняли повторное исследование уровня сывороточных молекул, анализ кала на дисбиоз и определение сигнальных молекул в супернатантах с использованием тех же технологий.
Результаты, полученные в ходе исследования, обрабатывались с помощью методов вариативной статистики. Описательные данные для количественных признаков с нормальным распределением представлены как среднее и стандартное отклонение (М±σ), с ненормальным распределением — в виде медианы и интepквартильного интервала (Me [Q1; Q3]); для качественных признаков приведены абсолютная частота проявления признака (количество обследованных), частота проявления признака (%). Сравнение качественных признаков проводилось с использованием точного критерия Фишера и вычислением χ2. Если p-уровень в любых вычислениях составлял менее 0,05, различия между группами считались значимыми.
Результаты и обсуждение
Группы сравнения были сопоставимы по возрасту: 51,0 [46,0; 55,0] и 47,0 [42,0; 52,0] лет соответственно (р=0,14). Число женщин в группах составило 8 (15,7%) и 10 (20%) соответственно (р=0,36). По локализации в большинстве случаев это был ИМ передне-боковой или передне-перегородочной локализации (60,8%), одна треть приходилась на ИМ нижней локализации (37,3%). У 27,7% отсутствовали какие-либо сопутствующие заболевания на момент развития острого коронарного события, у 62,7% регистрировали предшествующую артериальную гипертензию. В 1-й группе у 7 человек диагностирована острая левожелудочковая недостаточность, Killip-2, в остальных случаях острая сердечная недостаточность не развивалась. Во время нахождения в стационаре и при выписке основные группы лекарственных препаратов назначались однотипно, в соответствии с принятыми рекомендациями1. За время проспективного этапа 1 пациент выбыл из исследования по причине смерти.
Данные иммунологического обследования, полученные в остром периоде ИМ, в сравнении с результатами отдаленного периода представлены в таблицах 1 и 2. Пациенты с ИМ в остром периоде значимо отличались от здоровых ровесников по уровню всех изучаемых сигнальных молекул. Обращает на себя внимание тот факт, что в отдаленном периоде значимость отличий также сохранилась, однако теперь показатели IL-1β, IL-18, МСР-1, IL-6 и ФНО-α оказались существенно ниже, чем у вошедших в группу контроля. Отчасти это можно объяснить высокой приверженностью лечению и контролем факторов риска с помощью лекарственных препаратов, обладающих мозаичными плейотропными эффектами. Хорошо известны отсроченные позитивные эффекты антитромбоцитарных и липидснижающих препаратов, вместе с тем появляются данные и о преимуществах этих лекарственных стратегий в ближайшее время от начала их использования [4]. Что касается уровня СРБ и БСЖК, на наш взгляд, недостижение нормы через полгода от момента острого события может косвенно свидетельствовать в пользу продолжающихся восстановительно-репаративных процессов в миокарде. Перспективным в связи с полученными результатами может стать изучение кишечной фракции БСЖК в крови, которая увеличивается при кишечных «утечках» и ассоциируется с повреждением кишечного эпителия, а также с тяжестью сердечной недостаточности в первые месяцы после перенесенного ИМ [5].
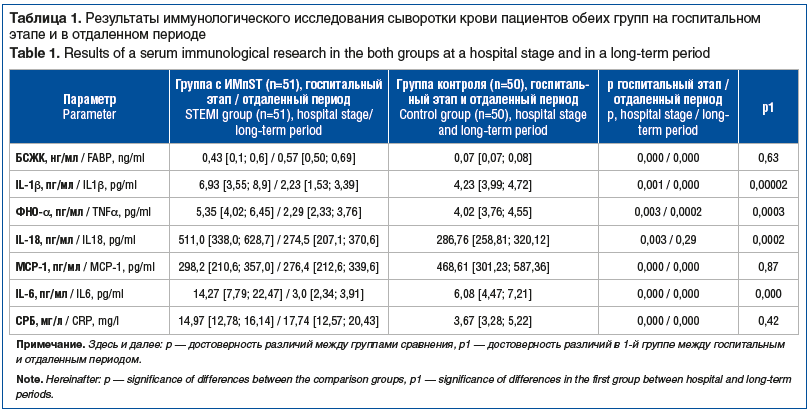

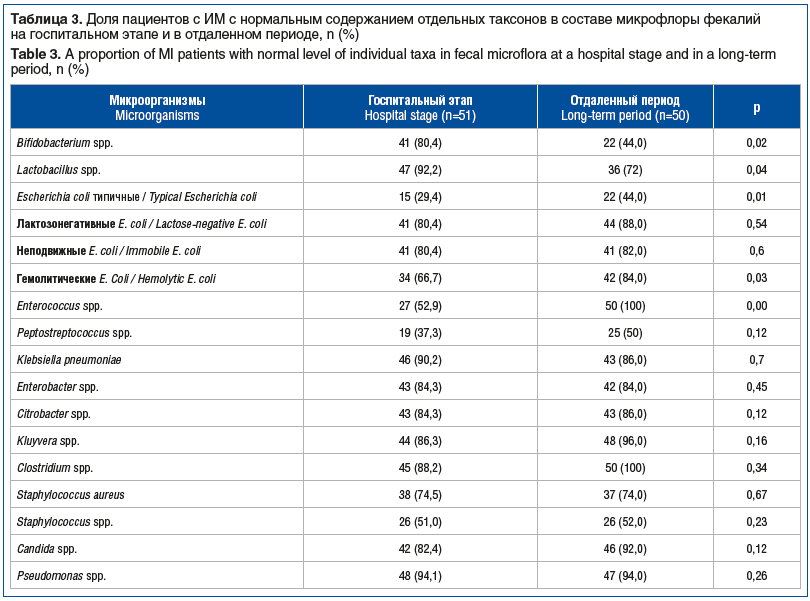
В отсутствие клинических проявлений дисбиоза установлены особенности количественного и качественного состава микроорганизмов в кишечнике больных (см. рисунок). При бактериологическом исследовании содержимого дистального сегмента толстого кишечника выделены следующие микроорганизмы: Bifidobacterium spp., Lactobacillus spp., Bacteroides spp., Fusobacterium spp., Peptostreptococcus spp., E. coli, Enterococcus spp., Enterobacteriaceae, Clostridium spp., Staphylococcus aureus, Staphylococcus spp., Candida albicans. При наличии близких к показателям нормы2 [5] концентраций бифидо- и лактобактерий, энтерококков отмечали расширение спектра и увеличение, зачастую значительное, численности факультативных условно-патогенных бактерий. Так, lg КОЕ/г представителей семейства Enterobacteriaceae, прежде всего лактозонегативных и гемолитических кишечных палочек, клебсиелл, энтеро- и цитробактеров достигали значений 7–8. Повышенным оказалось и содержание золотистого стафилококка, грибков рода Candida. При этом достоверных отличий на госпитальном этапе и в отдаленном периоде выявлено не было. Представленность облигатных бактерий в составе микробиоты обследованных больных на уровне, характерном для количественных показателей нормы, может косвенно указывать на формирование в период, предшествующий коронарному событию, патосимбиоценозов, в которых селекционировались виды бифидо- и лактобактерий со сниженной ферментативной и антагонистической активностью. Это подтверждает и избыточный рост конкурентной условно-патогенной микрофлоры. С другой стороны, имеющиеся данные предполагают, что состав микробиоты кишечника у каждого человека индивидуален. Поэтому для сравнительной характеристики анализируемых когорт, особенно при малых выборках, средние показатели численности микроорганизмов неинформативны, более того, они не корректны для установления связи между состоянием микробиоты и кардиологической нозологией.

Анализ спектров и частоты встречаемости микроорганизмов в фекалиях больных в разные периоды наблюдений (табл. 3) показал разнонаправленные изменения среди основных представителей нормальной микрофлоры. Так, значимо чаще со временем снижалась доля бифидо- и лактобактерий. Напротив, удельный вес типичных и гемолитических кишечных палочек, а также энтерококков достоверно возрастал. Процентное содержание факультативных условно-патогенных энтеробактерий, стафилококков и дрожжевых грибов оставалось устойчиво превышающим нормативные показатели. Учитывая агрессивность и высокие колонизационные способности условно-патогенных микроорганизмов и их ассоциаций с преобладанием грамотрицательных бактерий, нельзя исключать наличие риска эндотоксемии, обусловливающей вялотекущее воспаление и дисфункцию эндотелия.
Заключение
Таким образом, в работе установлены закономерные изменения концентрации провоспалительных молекул в сыворотке крови в отдаленном периоде ИМ.
Микробный пейзаж на фоне приема кардиотропной терапии в первые полгода после острого события характеризуется нарастанием удельного веса представителей условно-патогенной флоры. При этом уровень экспрессии сигнальных молекул в супернатантах остается сопоставимым с таковым на госпитальном этапе. Складывается впечатление, что для сравнительного анализа малых групп средние показатели численности микроорганизмов неинформативны и не позволяют обнаруживать устойчивые ассоциации между состоянием микробиоты и течением постинфарктного периода.
Благодарность
Выражаем благодарность за выполнение иммунологических и микробиологических тестов доценту кафедры микробиологии и вирусологии ФГБОУ ВО ПГМУ им. акад. Е.А. Вагнера к.м.н. А.П. Годовалову.
Acknowledgements
The authors acknowledge A.P. Godovalov (C. Sc. (Med.), Assistant Professor of the Department of Microbiology and Virology, Academician E.A. Vagner Perm State Medical University) for immunological and microbiological tests.
Сведения об авторах:
Степанов Максим Сергеевич — аспирант кафедры гос-питальной терапии и кардиологии ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614990, Россия, г. Пермь, ул. Петропавловская, д. 26.
Карпунина Наталья Сергеевна — д.м.н., доцент, профессор кафедры госпитальной терапии и кардиологии ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614990, Россия, г. Пермь, ул. Петропавловская, д. 26; ORCID iD 0000-0003-3127-1797
Спасенков Григорий Николаевич — к.м.н., врач-кардиолог ГБУЗ ПК «ККД», главный внештатный кардиолог Минздрава Пермского края; 614002, Россия, г. Пермь, ул. Сибирская, д. 84; ORCID iD 0000-0003-1085-5814
Контактная информация: Карпунина Наталья Сергеевна, e-mail: karpuninapsma@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.06.2025.
Поступила после рецензирования 17.06.2025.
Принята в печать 19.06.2025.
About the authors:
Maxim S. Stepanov — Post-Graduate Student at the Department of Hospital Therapy and Cardiology, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation.
Natalia S. Karpunina — Dr. Sc. (Med.), Assistant Professor, Professor of the Department of Hospital Therapy and Cardiology, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation; ORCID iD 0000-0003-3127-1797
Grigoryi N. Spasenkov — C. Sc. (Med.), Cardiologist at the Perm Territory Clinical Cardiological Dispensary, Chief Consultant Cardiologist at the Ministry of Health of the Perm Territory; 84, Sibirskaya st., Perm, 614002, Russian Federation; ORCID iD 0000-0003-1085-5814
Contact information: Natalia S. Karpunina, e-mail: karpuninapsma@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 10.06.2025.
Revised 17.06.2025.
Accepted 19.06.202
1Министерство здравоохранения Российской Федерации. Клинические рекомендации «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы», 2020.
2Приказ Министерства здравоохранения Российской Федерации от 09.06.2003 № 231 «Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004–2003).
Информация с rmj.ru
