Введение
Диабетическая ретинопатия (ДР) — осложнение сахарного диабета (СД), которое наиболее часто встречается в большинстве стран и остается ведущей причиной потери зрения [1, 2]. На основании результатов проспективного исследования EURODIAB (PCS), включавшего 3250 пациентов с СД 1 типа (СД1), 1249 из которых были выполнены снимки сетчатки в динамике (7,5 года), сделан следующий вывод: пролиферативная ДР (ПДР), ведущая причина слепоты, не может быть полностью предотвращена путем оптимизации метаболического контроля и контроля кровяного давления, а выявление факторов риска могло бы помочь определить цели для лечения [3]. Более поздние исследования подтверждают это утверждение [4]. В этом контексте интригующе выглядит информация о том, что при естественном течении (без офтальмологических процедур) ПДР может самопроизвольно стойко регрессировать с сохранением хороших функций в достаточно большом числе случаев [5, 6]. Так, G.W. Blankenship [7] показал, что через 15 лет наблюдения за глазами с ПДР, которые были отобраны в ходе исследовании DRS в группу контроля и никакого лечения не получали, острота зрения >0,1 была в 58% случаев, а от 0,5 до 1,0 (20/40 или лучше) — в 33%, однако автор не приводит частоту «тяжелой потери зрения» по критериям DRS — ≤0,025.
Известно, что ПДР возникает у 2–37% пациентов и ее частота зависит от типа СД, возраста дебюта заболевания, его продолжительности и тяжести течения [8]. Вероятно, сам по себе размах частоты ПДР может указывать на различия в течении СД у разных пациентов, обусловленные не только его длительностью. Однако в доступной литературе лишь единичные публикации посвящены выявлению факторов риска прогрессирования от непролиферативной ДР до пролиферативной [8], несмотря на исключительную важность своевременной диагностики именно ПДР для прогноза зрительных функций. Из клинических наблюдений хорошо известно, что темпы и варианты течения ПДР в разных случаях имеют принципиальные отличия [9]. Тем не менее существующая стандартизация подходов к лечению предполагает, что ДР у всех прогрессирует до терминальной стадии ПДР и, вероятно, с одинаковой скоростью. Таким образом, представленные факты в совокупности указывают на актуальность изучения вариантов прогрессирования ПДР.
Цель исследования: выявить признаки, позволяющие определить вариант развития активной ПДР и частоту неоваскулярных осложнений после витрэктомии при различных ее формах.
Содержание статьи
- 1 Материал и методы
- 2 Методы исследования
- 3 Методы статистического анализа данных
- 4 Результаты исследования
- 5 Сила корреляционной связи формы ПДР со степенью сосудистых изменений сетчатки и особенностями течения СД
- 6 Анализ частоты неоваскулярных осложнений после витрэктомии в зависимости от формы ПДР
- 7 Обсуждение
- 8 Заключение
Материал и методы
В исследование были включены 109 глаз 82 пациентов с ДР с признаками развивающейся (активной) ПДР.
Критерии включения в исследование: наличие ПДР; хорошая визуализация глазного дна; отсутствие выраженного фиброзного компонента пролиферации; добровольное информированное согласие на участие в исследовании.
Критерии невключения в исследование: миопия >2 дптр; помутнения оптических сред; заболевания глаза, не связанные с СД; любые интраокулярные вмешательства, кроме панретинальной лазеркоагуляции сетчатки (ПЛК), в анамнезе; неоваскуляризация радужки; тракционная отслойка сетчатки до операции; регматогенная отслойка сетчатки после операции.
Активными считали неоваскулярные кластеры (НК) с кровоснабжаемыми лидирующими капиллярами, оцениваемыми при офтальмоскопии. Отсутствие перфузируемых кровью неососудов указывало на их инволюцию, что в совокупности с наличием фиброзного компонента пролиферации считали признаком ремиссии ПДР (спонтанной или после ПЛК) [5]. Тяжесть ретинопатии классифицировали в соответствии с модифицированной шкалой 2003 г. [10]. Исходя из того, что наиболее тяжелые проявления патологического ангиогенеза (большая суммарная площадь неоваскуляризации, магистральные неососуды) развиваются не на всех глазах с ПДР, все случаи были отнесены к одной из трех форм течения ПДР:
группа стандартного течения (S-форма, от лат. simplex) — 51 глаз;
группа тяжелого течения (G-форма, от лат. gravis) — 37 глаз;
группа очень тяжелого / молниеносного течения (F-форма, от лат. fulgur) — 21 глаз.
К ПДР стандартного течения (S-форма) были отнесены случаи с неоваскуляризацией сетчатки и/или диска зрительного нерва (ДЗН) не более площади окружности, соответствующей двум диаметрам ДЗН (ДД) в наиболее развитом НК (равной или меньшей, чем на стандартной фотографии 10 C по шкале Early Treatment Diabetic Retinopathy Study (ETDRS)). К ПДР тяжелого течения (G-форма) были отнесены случаи с активной неоваскуляризацией сетчатки и/или ДЗН с наличием магистральных неососудов, и/или неоваскуляризацией сетчатки, и/или ДЗН более площади окружности, соответствующей 2 ДД в наиболее развитом НК (больше, чем на стандартной фотографии 10 C по шкале ETDRS) [11]. К молниеносной форме ПДР (F-форма) были отнесены случаи, соответствовавшие определению «florid diabetic retinopathy» [12, 13].
На всех глазах одним хирургом была выполнена стандартная трехпортовая витрэктомия 23-го калибра (Stellaris, Bausch & Lomb, США) без силиконовой тампонады. Срок послеоперационного наблюдения составил от 1,5 года до 12 лет. К неоваскулярным осложнениям витрэктомии относили появление признаков неоангиогенеза в переднем и/или заднем отделах глаза: рецидив ПДР, рубеоз радужной оболочки и переднегиалоидный ангиогенез (ПА) — рост неососудов и последующая клеточная пролиферация с формированием фиброзной ткани по передней гиалоидной мембране. Сочетание всех вариантов неоваскуляризации относили к пролиферативному глазному синдрому.
Методы исследования
В ретроспективный анализ были включены данные о пациентах: пол, возраст диагностики СД, его тип и продолжительность, возраст на момент выявления ПДР, состояние метаболического контроля и системных осложнений СД, особенности терапии (прежде всего, препаратами инсулина).
Всем пациентам выполнены стандартное офтальмологическое обследование с определением максимальной корригированной остроты зрения (МКОЗ), биомикроскопия, офтальмоскопия, а также оптическая когерентная томография сетчатки (RTVue модель-RT 100, Optovue). До операции выполняли 7 стандартных фотографий глазного дна по схеме ETDRS [11] при помощи фундус-камеры Topcon TRC-50 EX (Япония) и флюоресцеиновую ангиографию (ФАГ) (Spectralis HRA-OCT, Heidelberg Engineering, Германия). Для измерения сосудов использовали графическую программу Universal Desktop Ruler (AVPSoft, США). Диаметр сосудов был рассчитан в наиболее крупной артерии и вене сетчатки в пределах 0,5–1 диаметра ДЗН от его края, в двух квадрантах (верхне- и нижневисочном). При анализе результатов использовали среднее арифметическое. Вычисляли среднее значение из 6 измерений для каждого сосуда. Подсчет общей площади аваскулярных зон был проведен по результатам ФАГ с помощью программы ImageJ (National Institutes of Helth, США). Для оценки тяжести сосудистого поражения сетчатки использовали систему полуколичественной оценки при помощи стандартных нестереоскопических фотографий по алгоритму ETDRS [11]. Исследования выполняли при нормальных показателях роговично-компенсированного внутриглазного давления (Оcular Response Analyzer (ORA), Reichert, США), системного артериального давления, уровня гликемии.
Методы статистического анализа данных
Для статистической обработки данных использовали программу SPSS Statistics v.26.0 (IBM, США). Описательная статистика представлена в виде среднего значения и стандартного отклонения для показателей с нормальным распределением (M±SD), медианы [1-й и 3-й квартиль] (Me [Q1; Q3]) для показателей c распределением, отличным от нормального. Нормальность распределения определяли в соответствии с критерием Колмогорова — Смирнова. Для оценки статистической значимости различий между группами использовали критерий χ2 Пирсона для номинальных показателей и критерий Краскела — Уоллиса для количественных показателей. При сравнении трех групп значимость приведена с учетом поправки Бонферрони. Статистически значимыми считали различия при p<0,05. Для определения наличия взаимосвязи между переменными использовали коэффициент корреляции Спирмена. Изменения параметров приведены в виде относительных величин, рассчитанных как изменение в процентах от исходного уровня.
Результаты исследования
Пациентам с признаками развивающейся (активной) ПДР без тракционной отслойки сетчатки, включенным в настоящее исследование, была выполнена витрэктомия без силиконовой тампонады. Количество глаз пациентов с СД1 составило 62% (68 глаз). Срок наблюдения составил от 1,5 года до 12 лет.
У подавляющего большинства пациентов ПДР выявлялась на обоих глазах (в 96% случаев). Группы с разной тяжестью ПДР на исходном уровне значительно отличались по клинико-анамнестическим данным (табл. 1), особенностям течения СД, офтальмоскопическим проявлениям фоновой ДР (табл. 2–4), частоте неоваскулярных осложнений после витрэктомии (табл. 5).
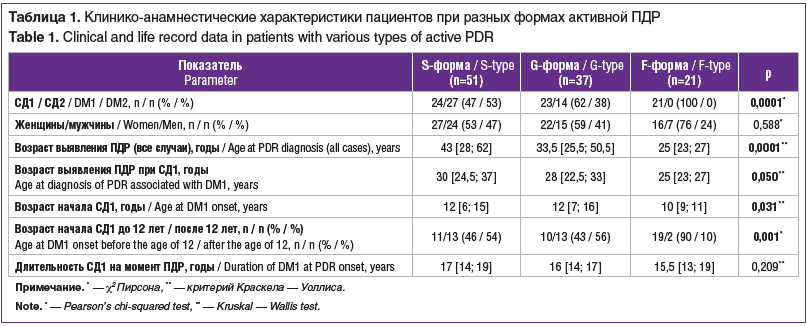

Распределение клинико-анамнестических характеристик и типа СД при разных формах активной ПДР
У пациентов с СД 2 типа (СД2) только в 15 (37%) случаях из 41 можно было точно установить возраст начала заболевания, поэтому анализ данных анамнеза у пациентов с СД1 был проведен отдельно (табл. 1).
Для классической S-формы ПДР было характерно относительно равномерное распределение пациентов по типу СД (приблизительно 1:1), при быстротекущей G-форме доля пациентов с CД1 составляла 62%, а молниеносная F-форма была выявлена исключительно у пациентов с СД1, что статистически значимо отличает эту форму заболевания от других (соответственно pS–F=0,0001; pS–G=0,97; pG–F=0,001). В исследуемых группах статистически значимых отличий по полу пациентов не обнаружено.
У пациентов с F-формой ПДР статистически значимо (р=0,031 с учетом поправки Бонферрони) СД дебютировал в более раннем возрасте, чем у пациентов с G-формой (10 [9; 11] и 12 [7; 16] лет соответственно), и в 90% наблюдений был выявлен до 12-летнего возраста, что статистически значимо ранее (p<0,001), чем у пациентов с S- и G-формами заболевания. Несмотря на то, что средняя длительность СД1 на момент установления диагноза ПДР по мере нарастания тяжести ПДР снижалась (17 [14; 19], 16 [14; 17] и 15,5 [13; 19] года при S-, G- и F-форме соответственно), при попарном сравнении статистически значимой разницы между группами выявлено не было. Среди всех пациентов с СД статистически значимо возраст к моменту установления диагноза ПДР в группе с F-формой был ниже (рS–F=0,0001; рG–F=0,007), при этом возраст в группах с S- и G-формами значимо не отличался (pS–G=0,375). Среди пациентов с СД1 при попарном сравнении групп с разными формами ПДР с учетом поправки Бонферрони на множественность сравнения (в 3 группах) статистически значимых отличий по показателю «возраст возникновения ПДР» обнаружено не было.
Сила корреляционной связи формы ПДР со степенью сосудистых изменений сетчатки и особенностями течения СД
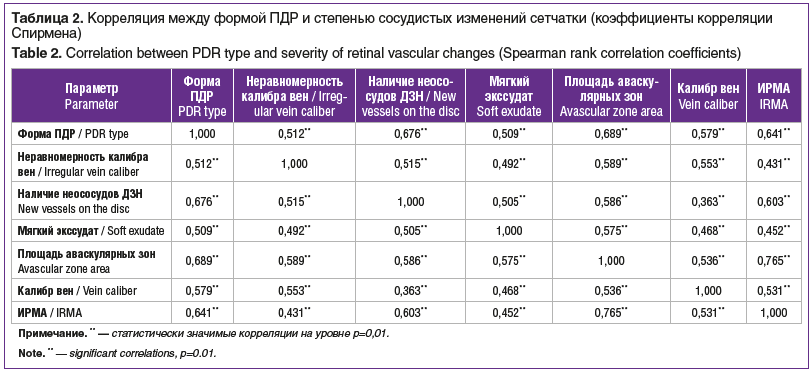
Задачей этого этапа исследования было выявление наличия и силы корреляционной связи между формой ПДР и степенью диабетического поражения ретинальных сосудов. Статистически значимая сильная прямая корреляция была выявлена между формой ПДР и площадью аваскулярных зон (К=0,69), неоваскуляризацией ДЗН (К=0,68), наличием интраретинальных микроваскулярных аномалий (ИРМА) (К=0,64), калибром ретинальных вен (К=0,58), неравномерностью калибра вен (К=0,51), присутствием мягкого экссудата (К=0,51), площадью аваскулярной зоны в макуле (К=0,5) (см. табл. 2). Не было обнаружено статистически значимой корреляции между тяжестью ПДР и количеством капиллярных микроаневризм / точечных интраретинальных кровоизлияний, наличием и локализацией субгиалоидных кровоизлияний, калибром артерий и наличием фиброза.
Мягкий экссудат не всегда обнаруживался только при тяжелой ПДР и не только в зонах капиллярной неперфузии, но неизменно при G- и F-форме. Помимо этого, можно отметить другие особенности F-формы: во всех глазах наблюдалась неоваскуляризация ДЗН, при этом неососуды сетчатки, как правило, отсутствовали. Размеры новообразованных сосудов были относительно небольшими, несмотря на «экстремальную неперфузию» мелких ретинальных сосудов; не перфузировались не только капилляры, но и сосуды среднего калибра, в том числе в макулярной области (рис. 1А). В некоторых глазах с G-формой заболевания и во всех глазах при F-форме наблюдались характерные изменения вен, которые можно охарактеризовать как критические и по калибру, и по выраженности патологической деформации (рис. 1В). При F-форме ПДР гемоперфузия сохранялась преимущественно в магистральных сосудах сетчатки, в периферических (постэкваториальных) отделах они образовывали дистальные артериовенозные шунты. Перипапиллярная зона была значительно более устойчивой к нарушениям перфузии, в ней кровоток сохранялся даже в наиболее тяжелых случаях. Только по офтальмоскопическим признакам, без ФАГ выявить данную форму ПДР на начальных стадиях и дифференцировать F- и G-форму заболевания крайне затруднительно; тем не менее такие глаза могут принципиально отличаться площадью аваскулярных зон. Различия могут стать явными по мере выполнения лечебных процедур: ПЛК, витрэктомии, интравитреальных инъекций (ИВИ) ингибиторов ангиогенеза, особенно в отдаленном периоде.
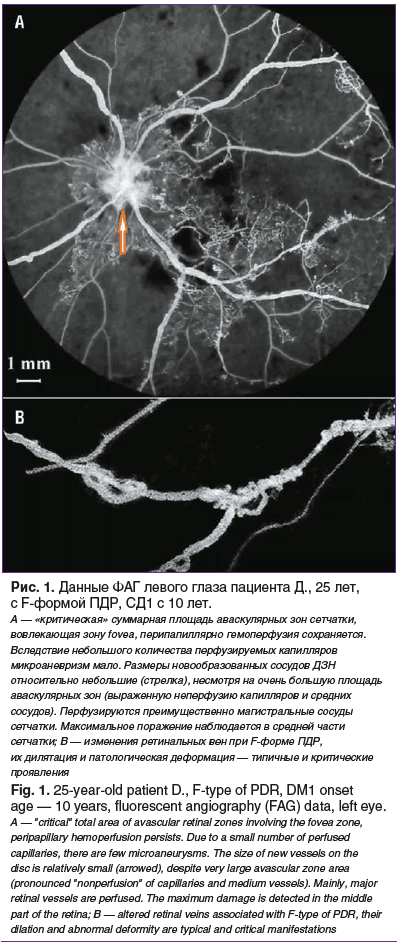
При всех вариантах ПДР сосудистый рисунок в макуле и периферических отделах сетчатки был значительно более сохранен по сравнению с ее средними отделами. Преэкваториальные отделы были поражены в наибольшей степени, в том числе по сравнению с более периферическими отделами сетчатки. Однако локальная зона межаркадного пространства «височнее» fovea также поражалась часто.
Все приведенные выше показатели значимо коррелировали между собой. Наиболее сильная корреляция была выявлена для ИРМА и площади аваскулярных зон (К=0,77), ИРМА и наличия неососудов ДЗН (К=0,60), площади аваскулярных зон и мягкого экссудата (К=0,58). Значимая, но более слабая взаимосвязь установлена между калибром вен и наличием обширной аваскулярной зоны в макуле (К=0,36), а также между неравномерностью калибра вен и ИРМА (К=0,43) (см. табл. 2).
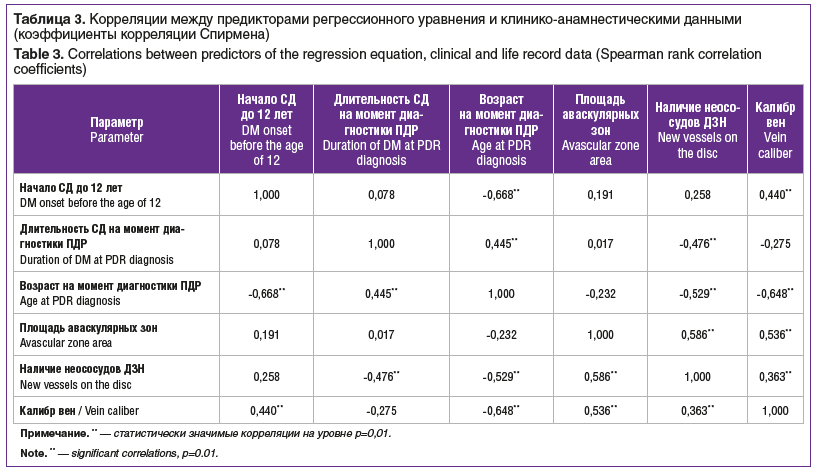
Существовала статистически значимая корреляция между формой ПДР и тяжестью СД (К=0,65), уровнем гликированного гемоглобина (К=0,52), возрастом на момент выявления ПДР (К=-0,37), возрастом дебюта СД (<12 лет) (К=0,34), типом СД (К=0,31) (см. табл. 3).
На основании найденных значимых корреляций было составлено линейное уравнение регрессии, определяющее силу влияния показателей на зависимую переменную — тип течения ПДР (см. табл. 4). Коэффициент детерминации полученного регрессионного уравнения оказался достаточно высоким: R2=0,76. Соответственно, около 76% изменений при разных формах ПДР объясняется изменениями трех показателей. Среди данных показателей наибольшее влияние оказывали площадь аваскулярных зон, калибр вен и наличие неососудов ДЗН.
Анализ частоты неоваскулярных осложнений после витрэктомии в зависимости от формы ПДР
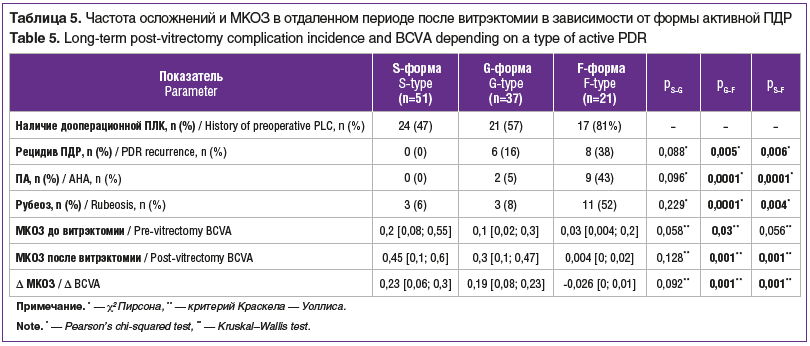
Частота неоваскулярных осложнений после витрэктомии (рецидивов ПДР, ПА, рубеоза радужки) выраженно и статистически значимо зависела от формы ПДР (см. табл. 5). Наиболее часто неоваскулярные осложнения возникали на глазах с неососудами ДЗН. Как правило, осложнения возникали в течение первого года после витрэктомии, наиболее часто — в первые 6 мес.
Обращает на себя внимание тот факт, что у пациентов с F-формой ПДР отмечались беспрецедентная частота и тяжесть неоваскулярных осложнений, хотя в этой группе в 82% случаев была выполнена ПЛК до витрэктомии, в отличие от 47 и 57% случаев при S- и G-форме соответственно. Витрэктомию старались выполнять как можно раньше. У всех пациентов с F-формой ПДР заболевание было выявлено на обоих глазах, у 1 пациентки исходно имелась тотальная тракционная отслойка сетчатки и рубеоз радужки на 1 глазу.
При классической S-форме заболевания рецидивов ПДР и ПА не было. Доля рецидивов ПДР после витрэктомии нарастала от G- к F-форме. На всех 14 глазах с рецидивами ПДР выполнена ревизия полости стекловидного тела. Частота развития ПА и рубеоза радужки при F-форме статистически значимо была выше, чем при G- и S-форме ПДР. При G-форме в глазах с рецидивом неоангиогенеза сетчатки и/или ДЗН не было выявлено случаев с одномоментной неоваскуляризацией в переднем отделе. Также интересно, что среди случаев с неоваскулярными осложнениями и хирургическим вмешательством на обоих глазах рецидивы ангиогенеза и ПА встречались у пациента только на 1 глазу. Лишь у 1 пациентки 22 лет (при стаже СД1 12 лет) были рецидивы неоваскуляризации ДЗН на обоих глазах, однако на одном был один рецидив, на другом — два. На одном глазу с ПА были выполнены ленсэктомия и силиконовая тампонада, на другом артифакичном глазу — ретинотомия и силиконовая тампонада, в обоих глазах силиконовое масло было удалено.
До витрэктомии при S-форме ПДР МКОЗ составила 0,2 [0,075; 0,55], а после — 0,45 [0,1; 0,7], при G-форме до операции — 0,1 [0,02; 0,3], а после — 0,3 [0,1; 0,475]. Отдаленные результаты стандартного подхода к лечению F-формы ПДР, включавшего не только витрэктомию с дополнительной эндолазеркоагуляцией, но и ИВИ ингибиторов ангиогенеза и ревизии полости стекловидного тела с силиконовой тампонадой, можно охарактеризовать как провальные: МКОЗ до витрэктомии составила 0,03 [0,004; 0,2], а после — 0,004 [0; 0,02].
Таким образом, развитие рецидивов ангиогенеза сетчатки / ДЗН, ПА и рубеоза радужки после витрэктомии во многом определяло отдаленные результаты. В настоящем исследовании показано, что наличие и тяжесть неоваскулярных осложнений зависели от формы ПДР. Таким образом, конечной точкой хорошего результата лечения ПДР, помимо улучшения остроты зрения, целесообразно считать достижение стойкого регресса всех признаков неоваскулярного поражения глаза при СД. Вероятно, в тяжелых случаях ПДР термин «стойкая ремиссия пролиферативного глазного синдрома» может быть более точным определением.
Обсуждение
Для ДР, в том числе пролиферативной, характерны хорошо известные маркеры поражения ретинальных сосудов; зачастую они просто перечисляются. Однако между одними признаками хронологический разрыв может исчисляться годами, а другие (например, такие, как мягкий экссудат или новообразованные сосуды) могут вообще не появляться. Известно, что ПДР развивается только на 2–37% глаз с ДР [8]. Тем не менее в доступной литературе публикации, посвященные выявлению факторов риска прогрессирования от непролиферативной ДР до пролиферативной формы заболевания, единичны [8].
Помимо этого, ДР, в том числе пролиферативная, обладает и другими важными признаками. Во-первых, ПДР может самопроизвольно или в результате лечения стойко регрессировать [5], спонтанная ремиссия одного из самых грозных осложнений СД представляет безусловный исследовательский и клинический интерес. Во-вторых, активность ПДР имеет четкие временные рамки — в среднем 5 лет, но период активности значительно варьирует — от 1 года до 9 лет [14]. Из этих наблюдений следует, что последствия роста неососудов при ПДР в значительной мере зависят от темпов прогрессирования неоангиогенеза. С точки зрения индивидуальных отличий прогрессирования ДР / ПДР интересно, что пациенты с СД исходно представляют собой неоднородную группу по выраженности ретинальных сосудистых реакций, сохранность или восстановление которых во многом может определять исход диабетического поражения сетчатки [15].
В настоящее время нам не известны предикторы, позволяющие прогнозировать переход из активной фазы неоангио-генеза в фазу ремиссии при ПДР; мы можем лишь констатировать факт ремиссии, когда уже имеются ее отчетливые признаки [5]. Признаки, позволяющие судить об активности ПДР, изучены лучше. Однако формулировка показаний и оценка эффективности лечения в эталонных исследованиях (DRS / EDTRS) были основаны на том, что ПДР у всех пациентов развивается по единому сценарию [16].
Исходя из того, что неососуды большого калибра и большой суммарной площади развиваются не на всех глазах с ПДР, все случаи в настоящем исследовании были отнесены, как указывалось выше, либо к стандартной форме — с неососудами площадью не более 2 ДД, либо к тяжелой — с неососудами площадью более 2 ДД и/или магистральными неососудами. К третьей группе были отнесены случаи очень тяжелого / молниеносного течения ПДР [12, 13]. Известно, что эта редкая форма ПДР характеризуется бурным прогрессированием, двусторонним характером, резистентностью к ПЛК даже очень большого объема и высоким риском слепоты.
Группы с разной тяжестью ПДР исходно значительно различались по клинико-анамнестическим данным, особенностям течения СД, офтальмоскопическим проявлениям фоновой ДР, а также по частоте неоваскулярных осложнений после витрэктомии. Доля пациентов с СД1 нарастала в следующем порядке: S-форма, G-форма, F-форма. Последняя была выявлена только у пациентов с СД1. У пациентов с молниеносной формой ПДР СД начинался статистически значимо в более раннем возрасте — в 10 [9; 11] лет (р=0,031 с учетом поправки Бонферрони).
Одной из задач исследования было изучение силы корреляционной связи между формой активной ПДР и степенью диабетического поражения ретинальных сосудов, а также особенностями течения СД. Была выявлена статистически значимая корреляция между формой ПДР и тяжестью СД (К=0,65), уровнем гликированного гемоглобина (К=0,52), возрастом на момент выявления ПДР (К=- 0,37), возрастом дебюта СД (моложе 12 лет) (К=0,34), типом СД (К=0,31). После составления линейного уравнения регрессии, определяющего силу влияния всех исследуемых показателей на тип течения ПДР, было показано, что наибольшее влияние оказывали площадь аваскулярных зон, затем калибр вен и наличие неососудов ДЗН. Таким образом, определение формы активной ПДР без данных ФАГ может оказаться затруднительным. Не было обнаружено статистически значимой корреляции между тяжестью ПДР и количеством капиллярных микроаневризм / точечных интраретинальных кровоизлияний, наличием и локализацией субгиалоидных кровоизлияний, калибром артерий и наличием фиброза.
Интересным было топографическое распределение аваскулярных зон по данным ФАГ: преэкваториальные отделы при всех формах ПДР были поражены в наибольшей степени; гемоперфузия в периферических отделах сетчатки по сравнению со средней зоной была более сохранной. Эта особенность также была показана в исследовании K. Shimizu et al. [17]. Она до сих пор не нашла объяснения, поскольку идет вразрез с представлением об окклюзирующем поражении сосудов в аваскулярных зонах.
Частота неоваскулярных осложнений после витрэктомии (рецидивов ПДР, ПА, рубеоза радужки) выраженно и значимо зависела от формы ПДР. Вероятно, в тяжелых случаях ПДР термин «пролиферативный глазной синдром», включающий все варианты патологического ангиогенеза в переднем и заднем отделах глаза — неоваскуляризацию сетчатки / ДЗН, ПА, рубеоз радужки, — может быть более точным определением для данного состояния. Частота и тяжесть неоваскулярных осложнений при F-форме ПДР были беспрецедентными. Отдаленные результаты стандартного лечения F-формы ПДР, включавшего витр-эктомию с эндолазеркоагуляцией, ИВИ ингибиторов ангиогенеза и ревизию витреальной полости с силиконовой тампонадой, можно охарактеризовать как провальные, что отмечалось и в других исследованиях [12]. Были опубликованы результаты лечения florid-ретинопатии при помощи ранней витрэктомии [13, 18], которые показывали обнадеживающие результаты. Однако, с нашей точки зрения, не все случаи из представленных авторами, учитывая данные ФАГ и фотографии сетчатки, соответствовали признакам florid-ретинопатии. На основании таких параметров, как преимущественная неоваскуляризация сетчатки и относительно небольшая площадь аваскулярных зон, согласно нашим критериям, представленные случаи следовало бы отнести к G-форме [13, 18]. Однако молниеносная ПДР является очень редкой формой, и наш принцип деления ПДР по тяжести, возможно, не самый точный. Между предложенными нами вариантами могут существовать переходные формы. Данные разногласия во многом терминологические и свидетельствуют о целесообразности принятия четких критериев, позволяющих различать варианты развития ПДР.
Кроме того, важно отметить, что в настоящем исследовании соотношение пациентов по каждой из форм было нерепрезентативным, поскольку, в связи со специализацией автора, обращаемость с наиболее тяжелыми проявлениями ПДР была значительно более высокой. Тем не менее данные, полученные в каждой из групп, могут отражать реальную ситуацию.
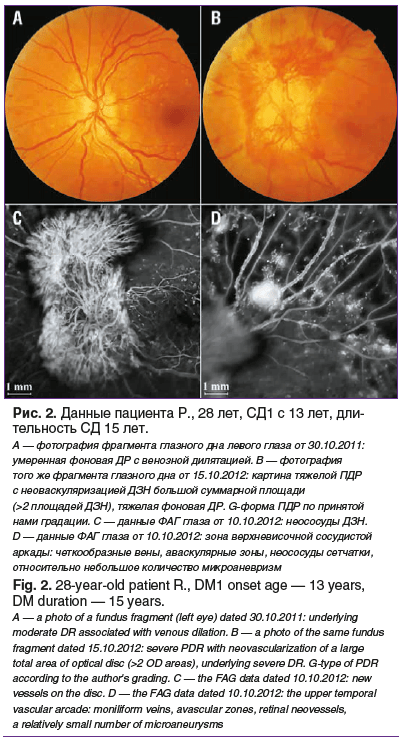
Результаты настоящего исследования позволяют предположить, что активная ПДР исходно развивается по разным сценариям (рис. 2). Существуют объективные признаки этих сценариев. Скорость развития ПДР может быть настолько высокой, что обычные интервалы наблюдения пациентов с ПДР могут быть неэффективными. Ранняя диагностика состояния глазного дна при помощи фотофиксации позволяет значительно снизить количество осложнений ДР [19]. В целях дальнейшего совершенствования стратегии лечения ПДР, вероятно, целесообразно рассматривать дифференцированный подход к разным типам течения данного процесса.
Заключение
В настоящем исследовании предложены признаки, позволяющие распределить случаи ПДР по тяжести (форме) заболевания. Группы с разной тяжестью ПДР исходно значительно отличались по клинико-анамнестическим данным, особенностям течения СД, проявлениям фоновой ДР. Линейное уравнение регрессии продемонстрировало, что наиболее значимыми для диагностики формы ПДР были площадь аваскулярных зон и калибр ретинальных вен. Ни один из этих признаков не учитывается в используемых классификациях. Частота неоваскулярных осложнений и отдаленные функциональные результаты витрэктомии зависели от формы ПДР. Результаты представленного исследования позволяют предположить, что активная ПДР исходно развивается по разным сценариям, что, вероятно, требует дифференцированного подхода к лечению в зависимости от формы процесса. С учетом связи функционального исхода лечения с частотой и тяжестью неоваскулярных осложнений конечный результат лечения ПДР не должен ограничиваться улучшением остроты зрения. Целью лечения целесообразно считать стойкую ремиссию пролиферативного глазного синдрома.
Сведения об авторе:
Сдобникова Светлана Владиленовна — к.м.н., старший научный сотрудник МНОИ МГУ; 119192, Россия, г. Москва, Ломоносовский пр-т, д. 27, корп. 10; ORCID iD: 0009-0000-9067-3863
Контактная информация: Сдобникова Светлана Владиленовна, e-mail: sdobnikova_sv@mail.ru
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 13.02.2025.
Поступила после рецензирования 10.03.2025.
Принята в печать 02.04.2025.
About the author:
Svetlana V. Sdobnikova — C. Sc. (Med.), Senior Scientific Officer, Medical Research & Educational Institute, Moscow State University; 27, build. 10, Lomonosovskyi ave., Moscow, 119192, Russian Federation; ORCID iD: 0009-0000-9067-3863
Contact information: Svetlana V. Sdobnikova, e-mail: sdobnikova_sv@mail.ru
Financial Disclosure: the author does not have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 13.02.2025.
Revised 10.03.2025.
Accepted 02.04.2025.
Информация с rmj.ru
