Введение
Сахарный диабет 2 типа (СД2) — одно из самых распространенных заболеваний во всем мире. Несмотря на большое количество имеющихся сахароснижающих препаратов, число пациентов, достигших целевого уровня гликированного гемоглобина (HbA1c), невелико. По данным Российского регистра пациентов с СД2, уровень HbA1c <7% имеют 52,2% пациентов, а в некоторых регионах — 25,2% [1].
Прогрессирующий характер заболевания связан со сложным патогенезом диабета, при котором развитию осложнений способствует не только гипергликемия, но и другие метаболические нарушения. Кроме основных звеньев патогенеза — инсулинорезистентности (ИР) и недостаточности функции β-клеток определены и другие патофизиологические механизмы:
сниженный инкретиновый эффект — нарушение секреции глюкагоноподобного пептида (ГПП-1), резистентность β-клеток к стимулирующему действию ГПП-1;
увеличение в плазме крови свободных жирных кислот, накопление в β-клетках, гепатоцитах и миоцитах токсичных липидных метаболитов из-за резистентности адипоцитов к антилиполитическому действию инсулина;
повышенная секреция глюкагона α-клетками поджелудочной железы и повышенная чувствительность печеночных клеток к глюкагону;
усиление реабсорбции глюкозы почками;
повышение аппетита, увеличение веса, усугубление резистентности к инсулину в мышцах и печени [2].
Ключевым звеном патогенеза СД2 служит ИР, которая со временем приводит к нарастающему снижению функции β-клеток поджелудочной железы. На оба нарушения можно воздействовать посредством сенсибилизации гепатоцитов, миоцитов и адипоцитов к инсулину, а также корректируя недостаточность инкретинов — ГПП-1 и глюкозозависимого инсулинотропного полипептида (ГИП) [3]. Применяемые сахароснижающие препараты определенных классов не могут влиять сразу на все патофизиологические нарушения, имеющиеся при СД2, поэтому для оптимального гликемического контроля необходимо сочетание препаратов различных групп, в частности глитазонов с ингибитором дипептидилпептидазы-4 (иДПП-4). Кроме того, поскольку препараты различных групп снижают уровень глюкозы в плазме посредством различных механизмов, то подобная комбинированная терапия будет иметь суммарный эффект в снижении HbA1c по сравнению с каждым отдельно взятым препаратом [4].
Пиоглитазон
В настоящее время пиоглитазон — единственный представитель группы сахароснижающих препаратов — тиазолидиндионов (глитазонов). Эти препараты являются агонистами ядерных γ-рецепторов, активируемых пролифератором пероксисом (PPARγ), который экспрессируется преимущественно в жировой ткани и вызывает транскрипцию генов, принимающих участие в метаболизме глюкозы и липидов. В адипоцитах активация PPARγ снижает уровни воспалительных цитокинов и свободных жирных кислот и увеличивает концентрацию адипонектина, таким образом способствуя повышению чувствительности к инсулину и снижению уровня глюкозы (рис. 1) [5].
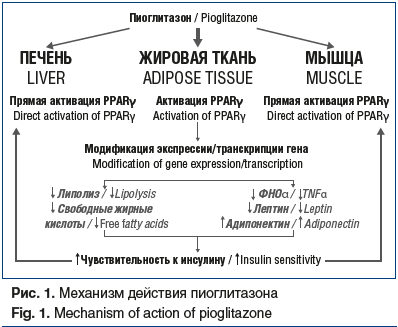
К преимуществам пиоглитазона можно отнести:
достаточно высокую сахароснижающую активность — эффективность пиоглитазона сравнима или превосходит эффективность иДПП-4 и производных сульфонилмочевины, действие препаратов из этой группы не связано с гипогликемией (рис. 2) [6, 7];
![Рис. 2. Улучшение функции β-клеток (секреция инсулина / индекс ИР) у пациентов с впервые выявленным СД2, не принимавших пероральные сахароснижающие препараты, и у лиц, длительно принимавших производные сульфонилмочевины (адаптировано из [7]). ПИО — пиогли Рис. 2. Улучшение функции β-клеток (секреция инсулина / индекс ИР) у пациентов с впервые выявленным СД2, не принимавших пероральные сахароснижающие препараты, и у лиц, длительно принимавших производные сульфонилмочевины (адаптировано из [7]). ПИО — пиогли](https://medblog.su/wp-content/uploads/2021/11/1636162152_800_novyj-moshhnyj-podhod-v-lechenii-bolnyh-saharnym-diabetom-2-tipa-mkrtumyan-a-m-sviridova-m-i.png)
положительное влияние на липидный спектр: пиоглитазон снижает уровень триглицеридов, увеличивает количество липопротеинов высокой плотности и увеличивает размер частиц липопротеинов низкой плотности при одновременном снижении их концентрации в связи с активацией PPARα [2];
снижение концентрации свободных жирных кислот в плазме крови, усиление образования оксида азота и, таким образом, улучшение эндотелиальной функции [8];
стимуляцию PPARα, повышение секреции адипонектина, что приводит к повышению чувствительности тканей к инсулину и ингибированию атерогенеза [9].
Подобные эффекты напрямую связаны со снижением ИР, которая, как показывают большие проспективные исследования, является сильным независимым предиктором сердечно-сосудистых заболеваний, инфаркта миокарда (ИМ) и инсульта [10, 11]. Исследование PROactive, в котором участвовало более 5000 пациентов с СД2, подтвердило, что пиоглитазон снижает основную вторичную конечную точку смертности от всех причин, нефатального ИМ и инсульта на 16% по сравнению с плацебо [11, 12].
Исследование PROactive является крупномасштабным проспективным, рандомизированным, двойным слепым исследованием вторичной профилактики, в котором изучали влияние пиоглитазона на макрососудистые осложнения у 5238 пациентов с СД2 и сердечно-сосудистыми заболеваниями в анамнезе. Около 50% пациентов, включенных в данное исследование, имели в анамнезе ИМ, а 25% пациентов — инсульт. У 25% пациентов было установлено заболевание периферических артерий. Согласно протоколу исследования пиоглитазон или плацебо назначали в дополнение к стандартному лечению диабета, которое включало сахароснижающие, антигипертензивные, липидснижающие и антитромботические препараты. Результаты исследования показали статистически значимое снижение риска комбинированной конечной точки MACE на 18% (смерть от сердечно-сосудистых причин, нефатальный ИМ и нефатальный инсульт) (ОР 0,82, 95% ДИ 0,70–0,97) [11, 13]. Следует особо отметить, что у пациентов с ИМ в анамнезе пиоглитазон достоверно снизил риск повторного ИМ на 28% и риск развития острого коронарного синдрома на 38% [14]. У пациентов же с инсультом в анамнезе пиоглитазон снизил риск развития повторного инсульта на 47% [15].
Препараты группы тиазолидиндионов продемонстрировали благоприятное действие на различные биомаркеры атеросклероза: в исследованиях показано снижение уровня провоспалительных цитокинов у пациентов с СД2 — С-реактивного белка, интерлейкина 6, CD40L, хемоаттрактантного белка моноцитов-1 и металлопротеиназы-9 [16], в результате чего отмечено улучшение функции эндотелия, уменьшение толщины интима-медиа сонной артерии [17].
Известно, что ИР связана с фибрилляцией предсердий, а СД2 является одним из самых сильных независимых факторов риска этого нарушения. По данным метаанализа, прием пиоглитазона был связан с более низким риском возобновления фибрилляции предсердий [18].
Значимым преимуществом пиоглитазона является защитное действие на β-клетки. Проведенные исследования показывают, что после начального снижения HbA1c более качественный гликемический контроль обеспечивается сохранением функции β-клеток у пациентов с СД2 [19]. В исследовании ACT NOW риск развития СД2 был снижен на 72% (p<0,0001). Наряду с этим наступило улучшение индекса секреции инсулина/ИР (диспозиции) — «золотого стандарта» оценки функции β-клеток. Именно этот показатель является самым сильным предиктором профилактики диабета [20].
Улучшение функции β-клеток под влиянием пиоглитазона происходит, с одной стороны, вследствие стимуляции ядерных рецепторов PPARγ на β-клетках, а с другой — из-за повышения чувствительности β-клеток к глюкозе и снижения липотоксичности [21].
Алоглиптин
Как уже было отмечено, у пациентов с СД2 снижен инкретиновый эффект, в связи с чем не происходит должного влияния инкретиновых гормонов на секрецию инсулина β-клетками и нарушается механизм необходимого подавления секреции глюкагона в ответ на прием пищи.
Препараты группы иДПП-4, к которым относится алоглиптин, предотвращают физиологическую инактивацию ГИП и ГПП-1, в результате чего удерживаются повышенные уровни этих гормонов в плазме крови после приема пищи (рис. 3).
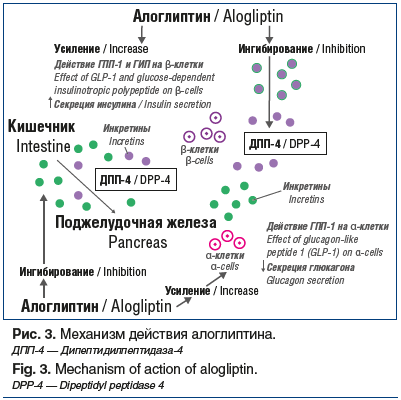
В результате такого действия иДПП-4 снижают уровень глюкозы в плазме крови после приема пищи и натощак. Особенностями действия иДПП-4 также являются снижение уровня HbA1c при низком риске гипогликемии и отсутствие набора веса [22]. Повышенные уровни инкретиновых гормонов определяют дополнительную чувствительность к глюкозе в α- и β-клетках поджелудочной железы, что при гипергликемии приводит к увеличению секреции инсулина и снижению секреции глюкагона, а при гипогликемии — к снижению секреции инсулина и увеличению секреции глюкагона [22, 23]. Кроме того, при лечении иДПП-4 определяются и дополнительные эффекты: уменьшение липолиза и снижение уровня богатых триацилглицерином атерогенных липопротеинов после приема пищи [24, 25].
Сахароснижающий эффект алоглиптина доказан в ходе большого числа исследований. При добавлении алоглиптина к терапии пациентов с недостаточно контролируемым диабетом на фоне приема препаратов сульфонилмочевины (уровень НbA1c 8,1%) уровень HbA1c снижался на 0,39–0,53% по сравнению с группой контроля [26]. В другом исследовании у пациентов с исходным уровнем HbA1c 7,9±0,8%, не получавших лечения, назначение алоглиптина показало хороший сахароснижающий эффект. У 50% пациентов наблюдалось снижение уровня HbA1c на 0,5%, у 29% — более чем на 1%. Кроме того, при приеме алоглиптина в дозе 25 мг отмечалось небольшое снижение уровня общего холестерина и триглицеридов [27, 28].
Алоглиптин — высокоселективный иДПП-4. Селективность алоглиптина по отношению к ДПП-4 более чем в 10 000 раз выше, чем к другим типам ДПП, что выше, чем у других представителей класса иДПП-4. Терапевтические дозы алоглиптина ингибируют ДПП-4 плазмы более чем на 80% с сохранением эффекта в течение 24 ч и повышают концентрацию ГПП-1 в 2–3 раза [29].
Исследование EXAMINE, в котором приняли участие 5380 пациентов с СД2 и острым ИМ или нестабильной стенокардией, не выявило кардиопротективного действия алоглиптина, но продемонстрировало его безопасность: после среднего периода наблюдения 18 мес. не наблюдалось значительных различий в частоте возникновения ИМ, инсульта, смертности от сердечно-сосудистых заболеваний и смертности от всех причин в группе пациентов, к терапии которых был добавлен алоглиптин, и в группе пациентов, получающих плацебо [30]. Вместе с тем исследованиe, проведенное в Японии, показало, что применение алоглиптина у пациентов с СД2 и гипертонической болезнью не только улучшало гликемический контроль (через 3, 6 и 12 мес. уровень HbA1c снизился с 7,0±0,97% до 6,4±0,61%, 6,3±0,58% и 6,3±0,75% соответственно, p<0,01), но и снижало систолическое артериальное давление с 137±18 мм рт. ст. до 127±13, 125±15 и 120±17 мм рт. ст. соответственно (p<0,01), диастолическое артериальное давление — c 79±13 мм рт. ст. до 74±8, 74±10 и 70±8 мм рт. ст. соответственно (p<0,01) [31].
По результатам субанализа исследования EXAMINE J.P. Ferreira et al. [32] отметили в подгруппе пациентов с СКФ≥60 мл/мин/1,73 м2, лечившихся алоглиптином, статистически значимое снижение риска развития комбинированной конечной точки MACE, включающей смерть по причине сердечно-сосудистых причин, нефатальный инсульт и нефатальный ИМ, на 19% (ОР 0,81, 95% ДИ 0,65–0,99, р=0,014) по сравнению с получавшими плацебо [32]. При этом риск сердечно-сосудистой смертности снизился на 39% (p=0,013), риск нефатального ИМ — на 14% (p=0,013).
В другом субанализе EXAMINE W.B. White et al. (2018) оценивали эффективность и безопасность добавления алоглиптина к двум пероральным сахароснижающим препаратам (метформину и производному сульфонилмочевины) в сравнении с плацебо. Было установлено, что добавление алоглиптина привело не только к дополнительному снижению HbA1c на 0,5%, но и к достоверному снижению сердечно-сосудистой смертности и смертности от всех причин на 51% (ОР 0,49, ДИ 95% 0,28–0,84, p=0,01) и 39% (ОР 0,61, 95% ДИ 0,38–0,96, p=0,033) соответственно [33].
Комбинация пиоглитазона и алоглиптина
Комбинированная терапия тиазолидиндионом и иДПП-4 в первую очередь показала хороший сахароснижающий эффект. Так, в 26-недельном исследовании среди наивных пациентов [27] на фиксированной комбинации пиоглитазона и алоглиптина (Инкресинк®) 63% пациентов достигли уровня HbA1c <7%, причем у пациентов с исходным уровнем HbA1c >8,5% на комбинированном препарате снижение HbA1c в среднем составило 2,1%. Комбинация препаратов обеспечивала более выраженное улучшение гликемического контроля, чем монотерапия пиоглитазоном и алоглиптином (рис. 4).
![Рис. 4. Динамика уровня HbA1с (A) и частота достижения целевого уровня HbA1с (B) на фоне различной пероральной сахароснижающей терапии (адаптировано из [27]). Исходный уровень HbA1с во всех случаях составил 8,8% Fig. 4. Changes in HbA1с levels (A) and the Рис. 4. Динамика уровня HbA1с (A) и частота достижения целевого уровня HbA1с (B) на фоне различной пероральной сахароснижающей терапии (адаптировано из [27]). Исходный уровень HbA1с во всех случаях составил 8,8% Fig. 4. Changes in HbA1с levels (A) and the](https://medblog.su/wp-content/uploads/2021/11/1636162152_203_novyj-moshhnyj-podhod-v-lechenii-bolnyh-saharnym-diabetom-2-tipa-mkrtumyan-a-m-sviridova-m-i.png)
В другом 26-недельном исследовании пациентам, получающим метформин, с недостаточным гликемическим контролем был добавлен алоглиптин отдельно или в комбинации с пиоглитазоном. Изучалось изменение уровня HbA1с по сравнению с исходным, изменение уровня глюкозы в плазме натощак и оценивалась функция β-клеток. В результате на фоне комбинированной терапии было получено значительное снижение уровня HbA1c и гликемии натощак. Результаты исследования показали улучшение функции β-клеток (по оценке модели гомеостаза функции β-клеток) [28].
Также в ряде исследований было показано благотворное влияние комбинации алоглиптина и пиоглитазона на метаболизм липидов: на фоне приема комбинированного препарата отмечалось значительное снижение уровня постпрандиальных триглицеридов и липопротеинов, богатых триглицеридами, что в целом снижает общий кардиометаболический риск [24, 25].
Заключение
Таким образом, фиксированная комбинация пиоглитазона и алоглиптина (Инкресинк®) представляется клинически эффективной, так как воздействует сразу на несколько звеньев патогенеза сахарного диабета: снижает ИР, увеличивая поглощение глюкозы в мышечной ткани и снижая производство глюкозы в печени, а также снижая липолиз в адипоцитах, усиливает инкретиновый эффект, секрецию инсулина, снижает секрецию глюкагона. Используемые препараты по механизму действия взаимно дополняют друг друга. Пиоглитазон снижает прогрессирование атеросклероза, улучшая функцию эндотелия и снижая риск сердечно-сосудистых событий. Вместе с тем нельзя не учитывать его побочные эффекты: повышение веса на 1–2 кг и задержку жидкости у 2–4% пациентов. Алоглиптин показал безопасность в плане сердечно-сосудистых событий и хороший сахароснижающий эффект. Использование препаратов в комбинации позволяет применять более низкие дозы пиоглитазона, минимизируя побочные эффекты.
Фиксированная доза препарата, удобство приема делают препарат привлекательным для назначения пациентам с небольшой длительностью диабета или впервые выявленным диабетом, при непереносимости метформина или возможных побочных действиях при увеличении дозы метформина, а также пациентам, имеющим дополнительные факторы сердечно-сосудистого риска. Препарат может использоваться и при длительном течении диабета, когда длительный прием секретагенов, неудовлетворительный контроль гликемии истощает β-клетки и речь заходит о назначении инсулина — использование подобной комбинации может отодвинуть назначение инсулинотерапии.
Благодарность
Редакция благодарит компанию «Штада» за оказанную помощь в технической редактуре настоящей публикации.
Aknowledgement
The technical edition is supported by Stada.
Сведения об авторах:
Мкртумян Ашот Мусаелович — д.м.н., профессор, руководитель отдела эндокринных и метаболических нарушений ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86; ORCID iD 0000-0003-1316-5245.
Свиридова Мария Ивановна — к.м.н., заведующая центром эндокринных заболеваний беременных женщин ГБУЗ «ГКБ № 29 им. Н.Э. Баумана»; 111020, Россия, г. Москва, Госпитальная пл., д. 2; ORCID iD 0000-0001-8942-3111.
Контактная информация: Мкртумян Ашот Мусаелович, e-mail: vagrashot@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.08.2021.
Поступила после рецензирования 12.09.2021.
Принята в печать 30.09.2021.
About the authors:
Ashot M. Mkrtumyan — Dr. Sc. (Med.), Professor, Head of the Division of Endocrine and Metabolic Disorders, A.S. Loginov Moscow Clinical Research Center; 86, Entuziastov road, Moscow, 111123, Russian Federation; ORCID iD 0000-0003-1316-5245.
Mariya I. Sviridova — C. Sc. (Med.), Head of the Center of Endocrine Disorders of Pregnancy, N.E. Bauman City Clinical Hospital No. 29; 2, Gospital’naya sq., Moscow, 111020, Russian Federation; ORCID iD 0000-0001-8942-3111.
Contact information: Ashot M. Mkrtumyan, e-mail: vagrashot@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 26.08.2021.
Revised 12.09.2021.
Accepted 30.09.2021.