Содержание статьи
Введение
Тазовый конгестивный синдром (Pelvic congestion syndrome (PCS), тазовый венозный стаз, синдром тазового венозного полнокровия, овариоцеле) — заболевание венозного отдела кровообращения, которое сопровождается расширением гонадных вен или внутритазовых венозных сплетений с формированием венозного полнокровия органов малого таза. Термин «синдром тазового венозного застоя» впервые был предложен Тейлором в 1949 г. [1]. PCS — это одна из частых причин хронической тазовой боли у женщин репродуктивного возраста, которая часто неправильно диагностируется. Истинная частота данного синдрома неизвестна из-за трудностей диагностики, обусловленных маскировкой заболевания различными формами гинекологической (воспалительные заболевания матки и ее придатков, эндометриоз), урологической (цистит), хирургической (колит, болезнь Крона) и ортопедической патологии.
Особенности патогенеза
По данным литературы, PCS чаще встречается у женщин в пременопаузе, имеющих в анамнезе несколько родов. О возникновении PCS у женщин в постменопаузальном периоде не сообщается [2]. Полное исчезновение симптомов после менопаузы свидетельствует о влиянии гормонов на PCS. Известно, что под влиянием эстрогенов может происходить эндотелийзависимое и эндотелийнезависимое расширение сосудов. Предполагают, что эти эффекты обусловлены наличием в кавеолах мембран эндотелиальных клеток эстрогеновых рецепторов. Таким образом, эстрогены могут вызывать расширение вен, служащее патофизиологической основой конгестивного синдрома. Среди пациенток с жалобами на хроническую тазовую боль распространенность данного заболевания достигает 30% [3].
Застой в тазовых венах (внутренней подвздошной, яичниковой, левой почечной) может быть вызван гормональными изменениями, нарушением в системе оттока венозной крови или непроходимостью какой-либо вены яичника, увеличением внутрисосудистого давления, не контролируемого венозным тонусом на уровне таза [4]. Примерами влияния гормонов на тонус сосудов являются расширение вен на фоне влияния прогестерона во время беременности, изменение тонуса сосудов перед менструацией, в период овуляции как результат увеличения выработки простагландинов вследствие гормональных колебаний [5].
Недостаточность первичных вен может быть результатом отсутствия венозных клапанов либо несоответствия их диаметру сосуда. Так, врожденное отсутствие клапанов вен яичников было зарегистрировано у 6% пациенток с правой стороны и от 13% до 15% — с левой. Несостоятельность клапанов справа имеет место у 35–46% женщин, слева — у 41–43%. Склонность к развитию PCS у женщин, имеющих в анамнезе несколько родов, может быть связана с увеличением емкости тазовых вен на 50% из-за физиологических изменений во время беременности, что может привести к ретроградному кровотоку и нарушению работы клапанов. Подобные сосудистые изменения могут сохраняться даже спустя 6 мес. после беременности [6].
Клинические проявления и подходы к диагностике
Клинически PCS выражается тупой болью или ощущением тяжести в тазу, которая безуспешно лечится как дисменорея. Любой фактор, повышающий давление в брюшной полости (ходьба, изменение осанки, поднятие тяжестей и длительное положение стоя), может увеличить интенсивность боли. Она часто обостряется до или во время менструации. Интенсивность болевого синдрома увеличивается во время или после полового акта, и с каждой последующей беременностью боль становится более выраженной. Нужно отметить, что на интенсивность боли влияет также время суток, она усиливается в конце дня [7].
Перед планируемым лечением PCS пациенткам необходимо провести оценку тазового венозного рефлюкса с помощью УЗИ, ретроградную венографию внутренней подвздошной или яичниковой вен, КТ или МРТ [8]. При допплерографии, помимо гонадных, следует выполнить визуализацию внутренних подвздошных вен с проведением пробы Вальсальвы. Рекомендуется также оценить состояние запирательных и срамных вен как возможных коллатеральных путей, а также общей подвздошной вены, нижней полой и почечной вены — для исключения обструкции. В настоящее время нет «золотого стандарта» для диагностики рефлюкса тазовых вен, предпочтение здесь отдается трансвагинальной дуплексной ультрасонографии [9].
Лечение
Выбор метода лечения PCS у женщин — еще один предмет оживленных дискуссий в профессиональной среде, что связано с высокой частотой рецидивов как после консервативного, так и после хирургического лечения. Медикаментозное лечение, связанное с меньшими осложнениями по сравнению с инвазивными процедурами, на современном этапе является первой линией лечения PCS. Агонисты гонадотропин-рилизинг-гормона, даназол, комбинированные пероральные контрацептивы, прогестины, флеботоники и нестероидные противовоспалительные препараты показали эффективность в купировании боли при PCS [3, 10]. Однако при этом необходимо понимать, что медикаментозная терапия обеспечивает лишь временный эффект.
Хирургическое лечение в виде перевязки несостоятельных вен яичников характеризуется довольно высокой результативностью — почти у 75% женщин данная операция приводит к исчезновению симптомов. Выполнение же двусторонней сальпингоофорэктомии и гистерэктомии в качестве лечения PCS, несмотря на свою радикальность, не дает благоприятных результатов [11].
Бурное развитие эндоваскулярных методов лечения заболеваний различных локализаций позволило рассматривать внутрисосудистые вмешательства как перспективный вариант терапии PCS. Среди внутрисосудистых методик наиболее распространены механическая окклюзия, склеротерапевтическая облитерация яичниковых вен, а также комбинированные методики эмболизации [12].
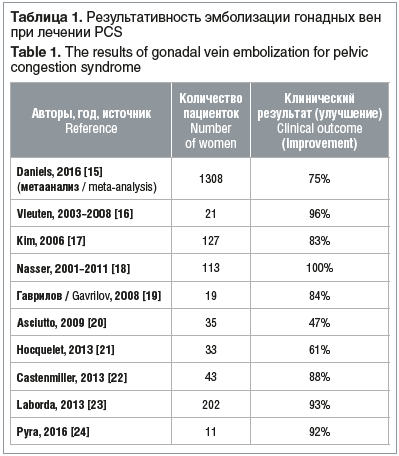
Двусторонняя эмболизация яичниковой вены как метод лечения PCS впервые была описана R.D. Edwards et al. в 1993 г. [13]. В России о первых результатах освоения метода доложил Е.В. Галкин в 1991 г., и к сегодняшнему дню уже опубликовано довольно большое количество отчетов о случаях и когортных исследованиях, в которых успешность вмешательств оценивается в среднем на 75–80% [14]. Проведенный поиск в доступной нам литературе [15–24] позволил проанализировать данные об эндоваскулярных вмешательствах (табл. 1).
Использование рентгеноэндоваскулярных методов расширяет возможности диагностики и лечения PCS.
Доступ для проведения эмболизации варикозно расширенных вен таза может осуществляться через правую общую бедренную, яремную вены, через медиальную или латеральную подкожные вены верхней конечности (v. basilica, v. cephalica). Правая внутренняя яремная вена представляет собой наиболее удобный доступ, поскольку обычно не реагирует спазмом в отличие от плечевых вен. После проведения катетеризации левой почечной вены проводится флебография в покое для оценки рефлюкса по всей длине вены, затем во время пробы Вальсальвы для оценки контралатерального венозного рефлюкса, а также рефлюкса в нижние конечности. Агентами для проведения эмболизации являются микроспирали из платины, эмболизационный клей и пена, а также жидкие склерозанты (полидоканол, 3% тетрадецилсульфат) [25]. Данные агенты можно использовать по отдельности или вместе [26]. Предпочтение отдается использованию спиралей, механически прикрепляющихся к спиралевидному доставляющему проводнику с внутренним диаметром 0,021 дюйма. Использование спиралей данного типа с фиксирующейся конструкцией дает возможность перемещать эти спирали вперед и возвращать обратно до окончательной оптимальной установки в вене. Стандартный диаметр используемого гайд-катетера — 5F, однако оптимальным следует признать выбор в пользу катетера диаметром 6F, позволяющего извлечь неправильно размещенную или смещенную микроспираль.
Осложнения эмболизации гонадных вен — редкое явление. Они делятся на непосредственные, возникающие во время проведения интервенционного вмешательства, и отсроченные. К непосредственным относятся осложнения, связанные с приемом лекарственных средств, к примеру гиперчувствительная реакция на йодсодержащий контрастный препарат [27], гематомы в месте пункции вены, пневмоторакс при катетеризации шейных вен, эмболизация нецелевых вен, в том числе смещение спиралей [28], инсульт, связанный с парадоксальной эмболией при миграции спирали или неконтролируемой эмболизацией с помощью пены. К отсроченным осложнениям относится миграция спиралей при неправильном подборе размера микроспиралей.
В исследовании A. Laborda et al. [23] оценивался клинический исход 5-летнего периода наблюдения после проведения эмболизации спиралями у пациенток с PCS. Дополнительно проводилась оценка уровня боли до и после лечения с использованием визуальной аналоговой шкалы (ВАШ). Технический успех интервенционного вмешательства составил 100%. Клинический успех достигнут в 93,85% случаев. Оценка по ВАШ перед процедурой составила 7,34±0,7, в конце периода наблюдения — 0,78±1,2.
Ретроспективное исследование, проведенное F. Nasser et al. [18], также показало высокую эффективность эмболизации спиралями при PCS. Технический и клинический успех в данном ретроспективном анализе составил 100%. Через 1 год после вмешательства 53% пациенток не отмечали болевого синдрома в тазовой области, 47% сообщили о значимом снижении выраженности боли. Оценка по ВАШ до эмболизации составила в среднем 7,34, через 12 мес. после эмболизации — 0,47.
Также был проведен ряд исследований, посвященных сравнению эмболизации с другими методами лечения. M.H. Chung et al. [28] продемонстрировали, что эмболизация превосходит гистерэктомию и овариэктомию в облегчении симптомов когнестии. Средний балл по ВАШ снизился с 7,8 до 3,2 в группе эмболизации по сравнению с 4,6 в группе двусторонней овариэктомии и 5,6 в группе пациенток, перенесших одностороннюю овариэктомию.
Несмотря на немалый опыт применения эндоваскулярной технологии при лечении различных вариантов патологии органов малого таза, влияние внутрисосудистой окклюзии на репродуктивные возможности женщин и их гормональный статус изучено недостаточно. Анализ результатов опубликованных работ не выявил значительных колебаний базального уровня фолликулостимулирующего, лютеинизирующего гормонов и эстрадиола. У пациенток, прошедших процедуру эмболизации овариальных вен, зарегистрированы беременности, завершившиеся родами [17].
Отдельного внимания заслуживает синдром аортомезентериального пинцета (синдром «щелкунчика»), при котором левая почечная вена сдавливается между верхней брыжеечной артерией и аортой. В этой ситуации яичниковая вена является основным коллатеральным путем венозного оттока и может вызывать боли даже в отсутствие гематурии, как при классическом синдроме «щелкунчика». МРТ, КТ и УЗИ с дуплексным сканированием наряду с внутрисосудистым УЗИ позволяют выявить значимый стеноз левой почечной вены [29]. Венография с пробой Вальсальвы все еще является полезным методом определения гемодинамически значимого стеноза, поскольку стеноз >50% при внутрисосудистом УЗИ не всегда обозначает клиническую значимость стеноза. В настоящее время для лечения данной патологии используются специальные нитиноловые стенты с высокой радиальной устойчивостью.
Синдром Мэя — Тернера, при котором происходит сдавление левой общей подвздошной вены правой общей подвздошной артерией, являясь предиктором возникновения илеофеморального тромбоза, также может приводить к развитию PCS. Для коррекции возникающих нарушений наряду со специальными венозными стентами используются саморасширяющиеся стенты. Однако в настоящее время нет убедительных доказательств преимущества какого-либо типа стентов для эндоваскулярного лечения данной патологии. S.F. Daugherty et al. [30] провели серию стентирований левой подвздошной вены при PCS. Дальнейшее наблюдение показало полное исчезновение тазовой боли у 15 из 19 пациенток. Ограничением данного исследования является исключение пациенток, у которых жалобы со стороны нижних конечностей превалировали над болью, связанной с PCS. Однако стентирование подвздошных вен, связанное с варикозной болезнью нижних конечностей, показывает хорошие клинические результаты [31].
Заключение
Таким образом, несмотря на то, что PCS является сравнительно молодой нозологией, сегодня имеются достаточные знания о патогенезе, клиническом проявлении данного заболевания и возможных методах коррекции. Что же касается дифференциальной диагностики, то необходимо отметить, что она вызывает значительные трудности у практикующих гинекологов. Улучшить диагностику PCS возможно, повышая осведомленность специалистов первичного звена о признаках и симптомах данной патологии, а также о необходимости консультирования соответствующих пациенток у сосудистых хирургов.
Эндоваскулярное вмешательство, на наш взгляд, — лучший вариант лечения PCS у пациенток с расширением яичниковых вен более 5–6 мм (что является верхним пределом нормы диаметра венозных сосудов) и присутствием признаков рефлюкса и венозной конгестии. Эмболизация гонадных вен — мини-инвазивный, безопасный и достаточно эффективный метод. Однако, несмотря на немалый опыт его использования (преимущественно в США и странах Западной Европы), вопросы влияния на последующую фертильность женщины, прогнозы в отношении полного выздоровления с учетом отягощения соматического и/или гинекологического анамнеза недостаточно освещены и нуждаются в более глубоком изучении. Требуется проведение многоцентровых рандомизированных исследований для оптимизации критериев отбора пациенток с PCS и введения их в повседневную клиническую практику.
Сведения об авторах:
Антропова Елена Юрьевна — к.м.н., доцент кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-5991-5163.
Шарафутдинов Булат Марсович — к.м.н., ассистент кафедры кардиологии, рентгенэндоваскулярной и сердечно-сосудистой хирургии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; заведующий отделением ангиографических и рентгеноперационных исследований МСЧ ФГАОУ ВО «Казанский (Приволжский) федеральный университет»; 420043, Россия, г. Казань, ул. Чехова, д. 1а; ORCID iD 0000-0002-4149-118X.
Мазитова Мадина Ирековна — д.м.н., профессор кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-9608-2076.
Газиев Эдгар Айратович — врач отделения ангиографических и рентгеноперационных исследований МСЧ ФГАОУ ВО «Казанский (Приволжский) федеральный университет»; 420043, Россия, г. Казань, ул. Чехова, д. 1а.
Хисамиева Гузель Альфредовна — ординатор кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-2277-1290.
Штерн Вячеслав Владимирович — ординатор кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-0444-5088.
Контактная информация: Антропова Елена Юрьевна, e-mail: antropoval@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 18.05.2021.
Поступила после рецензирования 10.06.2021.
Принята в печать 06.07.2021.
About the authors:
Elena Yu. Antropova — C. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-5991-5163.
Bulat M. Sharafutdinov — C. Sc. (Med.), assistant of the Department of Cardiology, Endovascular, and Cardiovascular Surgery, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; Head of the Department of Angiography and Interventional Radiology, Medical Wing of the Kazan (Volga Region) Federal University; 1а, Chekhova str., Kazan, 420043, Russian Federation; ORCID iD 0000-0002-4149-118X.
Madina I. Mazitova — Dr. Sc. (Med.), professor of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-9608-2076.
Edgar A. Gaziev — physician of the Department of Angiography and Interventional Radiology, Medical Wing of the Kazan (Volga Region) Federal University; 1а, Chekhova str., Kazan, 420043, Russian Federation.
Guzel A. Khisamieva — clinical resident of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-2277-1290.
Vyacheslav V. Shtern — clinical resident of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-0444-5088.
Contact information: Elena Yu. Antropova, e-mail: antropoval@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 18.05.2021.
Revised 10.06.2021.
Accepted 06.07.2021.
.
Информация с rmj.ru


