Введение
Неалкогольная жировая болезнь печени (НАЖБП) и желчнокаменная болезнь (ЖКБ) — хронические неинфекционные и метаболически-ассоциированные заболевания, распространенность которых во всем мире высока. Так, частота встречаемости НАЖБП в Европе достигает 25–26% с большой разницей в популяциях [1]. Заболеваемость ЖКБ в Европе и США составляет около 15–20% [2]. Российское же эпидемиологическое исследование DIREG-2 [3] демонстрирует встречаемость НАЖБП, достигающую 40% среди пациентов поликлинического звена.
Зачастую оба эти состояния одновременно выявляются у одного и того же пациента, что безусловно ассоциировано с общими факторами риска развития заболеваний (ожирение, инсулинорезистентность, гипер- и дислипидемия), а также анатомо-физиологическими особенностями [4–7]. Ассоциация этих двух заболеваний изучалась в нескольких крупных исследованиях [8–10]. Т. Koller et al. [8] обнаружили более высокую распространенность ЖКБ среди пациентов с НАЖБП, чем без таковой (47% и 26% соответственно). Кроме того, исследование, проведенное A.L. Fracanzani et al. [9], доказало, что вероятность образования камней в желчевыводящих протоках связана со степенью фиброза (при степени F0–1 вероятность равна 14%, при F2–3 — 23% и при F4 — 56%) и выраженностью воспаления. Имеются описания развития НАЖБП у пациентов, перенесших холецистэктомию [7]. Также известно, что НАЖБП связана с повышенным риском холангиокарциномы и рака желчного пузыря [10]. Интересными представляются данные об увеличении риска развития сердечно-сосудистых заболеваний (ССЗ) как у пациентов с НАЖБП, так и в период формирования конкрементов и после холецистэктомии, что предполагает суммацию рисков у пациентов в условиях коморбидности этих заболеваний [11, 12]. Сложная и, очевидно, двусторонняя взаимосвязь между этими заболеваниями представляется весьма актуальной для изучения.
Содержание статьи
Анатомо-физиологические особенности
Известно, что НАЖБП и ЖКБ имеют несколько общих факторов риска, включая возраст (достигая плато после 50 и 60 лет у женщин и мужчин соответственно), этническую принадлежность и метаболические факторы [10, 11].
Рассмотрим возможные патофизиологические механизмы коморбидного течения НАЖБП и ЖКБ (см. рисунок).
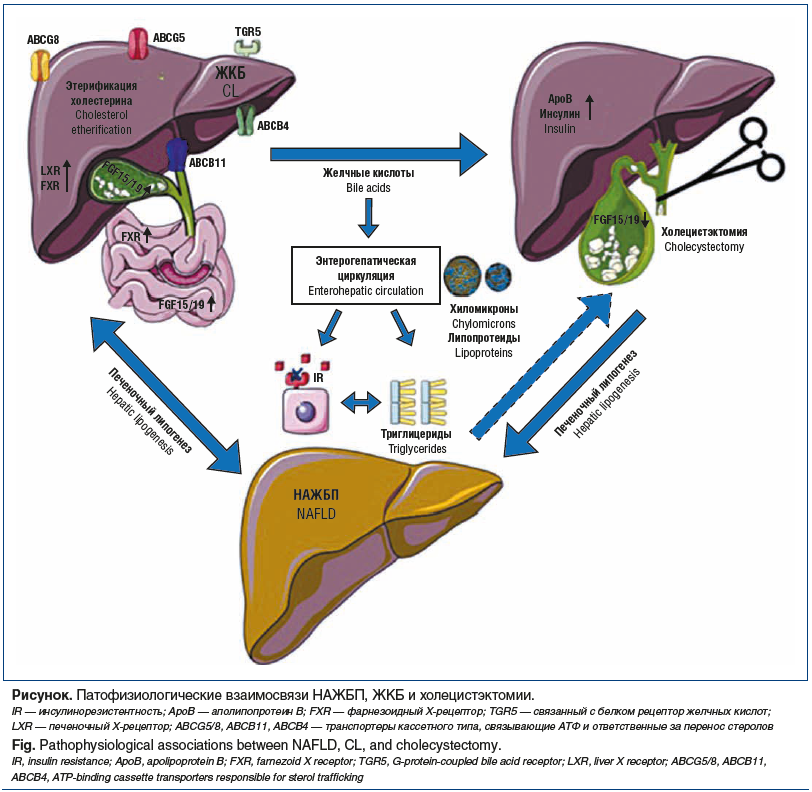
Желчные кислоты (ЖК) синтезируются гепатоцитами преимущественно по классическому пути из холестерина при участии фермента холестерин-7α-гидроксилазы. При избытке ЖК в случае нарушения энтерогепатической циркуляции или превращения первичных ЖК во вторичные данный путь синтеза будет заблокирован по механизму обратной связи. Основные первичные ЖК включают холевую и хенодезоксихолевую кислоты, которые после конъюгации с аминокислотами глицином и таурином для повышения их растворимости поступают в желчный пузырь, где хранятся до эвакуации в кишечник для реализации пищеварительной функции и усвоения жирорастворимых витаминов. Кроме того, ЖК активируют множество ядерных рецепторов, таких как фарнезоидные X-рецепторы (FXR), рецепторы витамина D и рецепторы pregnane X, а также поверхностные рецепторы, например TGR5, чтобы вызвать их сигнальные эффекты. FXR широко экспрессируются как в гепатоцитах, так и в энтероцитах. В энтероцитах ЖК индуцируют выработку фактора роста фибробластов-19 (FGF-19). Действуя на TGR5, ЖК вызывают высвобождение глюкагоноподобного пептида-1 [13]. Вероятно, таким способом реализуется метаболическая функция ЖК через регуляцию скорости и объема липолиза, глюконеогенеза и процесса насыщаемости как при формировании конкрементов, так и после удаления желчного пузыря [14]. Становится очевидно, что при заболеваниях печени и нарушении соотношения ЖК меняется микробный пейзаж в кишечнике в сторону провоспалительных бактерий типа Proteobacteria, особенно Enterobacteriaceae, что в свою очередь нарушает целостность интестинального мукозального барьера и дополнительно способствует прогрессированию гепатита и фиброза печени [15].
Желчные кислоты могут вызвать клеточный некроз, растворяя плазматическую мембрану или сигнализируя о запрограммированной гибели клеток. Исследование in vitro [16] гепатоцитов показало, что при внутриклеточном накоплении ЖК происходит олигомеризация рецепторов Fas и активация каспазы 8, что запускает апоптоз. Кроме того, реактивные формы кислорода, образующиеся в результате чрезмерного повреждения мембраны, вызванного ЖК (через фосфолипазу A2 и ядерные рецепторы), подавляют синтез глутатиона. Это увеличивает вероятность повреждения и некроза клеток. Таким образом, цитокины, высвобождающиеся при вызванном ЖК клеточном повреждении, активируют стеллатные клетки печени, что неминуемо приводит к фиброзу. В исследовании [17] было продемонстрировано увеличение в сыворотке уровня первичных глицин-конъюгированных холевых и хенодезоксихолевых ЖК при НАЖБП с фиброзом. Фекальный профиль ЖК при НАЖБП отличается у пациентов с ожирением и без ожирения. Установлено, что у пациентов с ожирением и НАЖБП количество первичных конъюгированных и неконъюгированных ЖК в кале увеличено, а количество вторичных ЖК постепенно уменьшается по мере прогрессирования фиброза [18]. Сравнительное исследование [19] пациентов с НАЖБП и с ЖКБ, проведенное коллегами из Ижевской государственной медицинской академии, продемонстрировало при проведении масс-спектрометрии желчи снижение общего количества свободных ЖК (холевой, хенодезоксихолевой, дезоксихолевой) и увеличение содержания конъюгированных ЖК (гликохолевой, гликодезоксихолевой, таурохолевой, тауродезоксихолевой, урсодезоксихолевой), а также увеличение уровня общего холестерина и маркеров цитолиза и холестаза. Наиболее выраженные изменения были выявлены у больных НАЖБП. Авторы предполагают, что снижение первичных ЖК и дисбаланс фосфолипидов нарушают стабилизацию желчи, что приводит к образованию камней в желчевыводящих путях у пациентов с НАЖБП.
Гендерные особенности
Исследование A. Kichloo et al. [20], показало, что сочетание НАЖБП и ЖКБ встречается у 64,3% женщин и 35,7% мужчин. Различие в частоте может быть обусловлено естественными изменениями в женской физио-логии, особенно в постменопаузальные годы, такими как повышение резистентности к инсулину, центральное ожирение, и изменениями в распределении жировой ткани в результате колебаний уровня эстрогена. Также было отмечено, что раннее менархе может стать причиной повышенного риска НАЖБП в более позднем возрасте [21]. В исследовании [22] с использованием экспериментальных моделей, а именно рыбок Данио-рерио с избыточным питанием, результаты гистологического анализа доказали, что старение яичников, вызывающее гипоэстрогенемию, способствует развитию стеатоза печени и прогрессированию фиброза. В этом же исследовании авторы продемонстрировали, что среди женщин в менопаузе имеется более высокая распространенность метаболических нарушений (высокий уровень общего холестерина, повышенный индекс инсулинорезистентности (HOMA-IR), сахарный диабет 2 типа и артериальная гипертензия), чем среди женщин репродуктивного возраста, и что менопаузальный статус увеличивает риск развития стадий F2–F4 фиброза печени. Понимание гендерных различий при оценке и лечении коморбидных НАЖБП и ЖКБ имеет большое значение, поскольку позволит разработать точные программы скрининга и профилактики.
Инсулинорезистентность
Гиперинсулинемия стимулирует активность гидрокси-3-метилглутарил-коэнзима А редуктазы и увеличивает насыщение желчи холестерином, что в свою очередь ведет к образованию холестериновых желчных камней и нарушению моторики желчного пузыря [20, 23]. Некоторые авторы [24] разделяют системную и печеночную инсулинорезистентность, печеночная считается более важной для образования конкрементов. Следует отметить, что системная инсулинорезистентность связана со снижением сократимости желчного пузыря у пациентов без ожирения и сахарного диабета [25]. В свою очередь, инсулинорезистентность признана ключевым фактором возникновения и прогрессирования НАЖБП. Оценка HOMA-IR рекомендована всем пациентам с подозрением на НАЖБП и в дальнейшем при динамическом наблюдении [12, 26]. В недавнем междисциплинарном обзоре [27], посвященном патогенетическим механизмам взаимовлияния НАЖБП и сахарного диабета 2 типа, подчеркнуто, что лечение НАЖБП должно быть частью стратегии лечения пациентов с диабетом и что данное заболевание имеет большое значение для стратификации риска осложнений диабета, а наличие НАЖБП у пациента следует учитывать для персонализации лечения, так как некоторые лекарственные препараты, используемые для контроля гликемии (метформин, пиоглитазоны и инкретины), могут быть частью лечения неалкогольного стеатогепатита и ассоциированного с ним фиброза.
У пациентов с метаболическим синдромом и сахарным диабетом 2 типа (группа высокого риска) комбинация НАЖБП и ЖКБ встречается чаще [28]. Однако эта связь не однонаправленная, так как нарушение моторики желчевыводящих путей может усугублять инсулинорезистентность [29]. Повышенный de novo липогенез активирует «липогенную ветвь» инсулинового сигнального пути в гепатоците, приводя к формированию стеатоза [30]. В регуляции печеночного липогенеза участвуют несколько транскрипционных факторов, в том числе печеночный X-рецептор (LXR). Он регулирует экспрессию АВС-транспортеров ABCG5/ABCG8, ответственных за каналикулярную экскрецию холестерина. Это приводит к усилению синтеза ЖК и ускорению этерификации холестерина. Другим важным транскрипционным фактором являются FXR, которые экспрессируются как в печени, так и в кишечнике и участвуют в обмене холестерина, триглицеридов и глюкозы, как было упомянуто ранее. FXR также регулирует экспрессию канальцевых транспортеров ABCB11 и ABCB4, которые транспортируют соответственно ЖК и фосфатидилхолин в желчь [31]. Недавнее исследование [6], проведенное с участием 4325 больных сахарным диабетом 2 типа с НАЖБП и без таковой, не продемонстрировало различий в распространенности ЖКБ, однако выявило методом логистического регрессионного анализа, что ЖКБ (отношение шансов (ОШ) 1,241, 95% ДИ 1,036–1,488, p=0,002) и холецистэктомия (OШ 1,946, 95% ДИ 1,546–2,445, p<0,001) были тесно связаны с НАЖБП. В свою очередь, бессимптомное течение ЖКБ (OШ 0,663, 95% ДИ 0,513–0,856, p=0,002) реже ассоциируется с НАЖБП.
Абдоминальное ожирение
Ожирение характеризуется увеличением массы жировой ткани, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают нарушения углеводного, липидного, пуринового обмена и артериальную гипертонию [32]. Как предиктор развития ЖКБ, ожирение связано с повышенным синтезом и выведением холестерина с желчью. При недостаточном потреблении клетчатки замедляется транзит кишечного содержимого, что способствует повышенному образованию и всасыванию вторичных ЖК и усилению литогенных свойств желчи [33]. С другой стороны, потеря веса сопровождается повышением уровня муцина и кальция в желчи, что приводит к формированию билиарного сладжа и камней в желчном пузыре. Кроме того, важную роль играет распределение жировой ткани, а не ее количество. Висцеральная жировая ткань ассоциирована с более частым развитием НАЖБП даже при более низком индексе массы тела. Очевидно, что данные эффекты связаны со способностью жировой ткани к активному синтезу провоспалительных цитокинов и адипокинов. Было показано, что адипокины оказывают воздействие на все патогенетические звенья НАЖБП и среди них особое значение имеет лептин, уровень которого у пациентов с НАЖБП значительно повышен [34]. Гиперлептин-емия и лептинорезистентность ассоциированы с более тяжелым течением НАЖБП и развитием фиброза [35]. Вместе с тем высокий уровень лептина в исследованиях коррелирует с риском развития и/или наличием ЖКБ у пациентов с ожирением и избыточной массой тела [36]. В экспериментальных моделях у мышей с индуцированной гиперлептинемией и лептинорезистентностью было обнаружено изменение качества желчи, а именно повышенное содержание холестерина в ней и способность его к кристаллизации, а также увеличение муцина в составе желчи — «литогенный эффект». Кроме того, лептин уменьшает уровень липопротеинов высокой плотности, т. е. способствует развитию дислипидемии [37]. Для пациентов с ЖКБ и избыточной массой тела характерен достоверно более высокий уровень лептина и одновременно более низкий уровень сывороточного адипонектина, чем у пациентов с ЖКБ и нормальной массой тела. Уровень сывороточного адипонектина обратно пропорционален уровню триглицеридов в сыворотке крови у больных с ЖКБ [38].
Холецистэктомия
Удаление желчного пузыря влечет за собой метаболические изменения, вызывающие развитие и прогрессирование НАЖБП. После удаления желчного пузыря желчь непрерывно выделяется в двенадцатиперстную кишку. Это приводит к более быстрой циркуляции ЖК и соответственно большей концентрации их в печени, что может запустить вышеописанные механизмы клеточного повреждения и индукции фиброгенеза в печени [39]. В исследовании F. Barrera et al. [40] было обнаружено, что холецистэктомия приводит к снижению уровня FGF-19 в сыворотке, что предрасполагает к развитию гипергликемии и гиперхолестеринемии, увеличивающих риск формирования стеатоза печени. Повышенный уровень триглицеридов и липопротеинов очень низкой плотности после холецистэктомии установлен и в другом исследовании [41]. Ряд исследований, проведенных в Европе, Корее, США и включивших в анализ до 20 тыс. человек, однозначно демонстрируют независимую от других метаболических факторов (массы тела, сахарного диабета, гиперлипидемии и гипертриглицеридемии) связь развития НАЖБП с предшествующей холецистэктомией, более сильную даже, чем связь с ЖКБ в стадии формирования и бессимптомного наличия камней в желчном пузыре [42]. Исследовательская группа Папского католического университета Чили провела двухлетнее сравнительное наблюдение пациентов с ЖКБ после холецистэктомии и здоровых лиц, оценивая у них содержание жира в печени с помощью магнитно-резонансной томографии и уровня инсулина. Авторы обнаружили статистически значимое увеличение уровня инсулина в крови и HOMA-IR у пациентов, перенесших холецистэктомию, а также значительное увеличение жира в печени у пациентов, перенесших хирургическую процедуру, по сравнению с пациентами без хирургического вмешательства, учитывая, что все они не страдали ожирением и сахарным диабетом на момент включения в исследование [43].
В предлагаемых стратегиях ведения пациентов с НАЖБП после холецистэктомии подчеркивается, что при отсутствии клинических проявлений ЖКБ, очаговой кальцификации стенки желчного пузыря и растущих в нем полипов размером более 10 мм целесообразно выбрать выжидательную тактику. Пациентам, перенесшим оперативное вмешательство, рекомендуется оценка липидного спектра, глюкозы, маркеров цитолиза и холестаза начиная со 2-й недели после операции и далее не реже 1 раза в 3 мес. в течение первого года, а также оценка фиброэластометрии через 6 и 12 мес. после операции [44].
Собственный опыт
На кафедре факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России было проведено исследование, включившее 183 пациента, страдающих НАЖБП. Для определения диагностически ценных клинических признаков коморбидного течения НАЖБП и ЖКБ полученные результаты обследования изучались в группах и подгруппах: в основную группу вошли пациенты, страдающие НАЖБП и ЖКБ (n=88), из которых 53 пациента перенесли холецистэктомию, группу сравнения составили пациенты, страдающие НАЖБП без ЖКБ (n=95). Всем пациентам проводилось стандартное лабораторно-инструментальное обследование, а также измерение уровня лептина, его растворимого рецептора, инсулина, адипонектина в сыворотке крови. Фиброз печени оценивали с помощью транзиентной эластометрии.
При анализе пола и возраста лиц, страдающих НАЖБП и ЖКБ, было установлено, что женщин среди пациентов основной группы статистически значимо больше: 36 (40,9%) пациенток основной группы против 20 (21,1%) пациенток группы сравнения (χ2=8,48, р<0,01) — при отсутствии статистически значимых различий по возрасту. Достоверно чаще пациенты основной группы предъявляли жалобы на ощущение горечи во рту (χ2=11,66, р<0,01), при этом сила положительной взаимосвязи возрастала после холецистэктомии (χ2=0,231, р<0,01). Нами было выявлено, что у пациентов с НАЖБП и ЖКБ чаще была диагностирована ишемическая болезнь сердца (у 25% лиц основной группы и у 9,47% — группы сравнения, χ2=7,83, р<0,01, rs=0,207, р<0,01). Бóльшая распространенность ССЗ была отмечена у лиц с ЖКБ, перенесших холецистэктомию (rs=0,258, р<0,01). Также установлено, что при коморбидном течении НАЖБП и ЖКБ характерным было наличие сопутствующего сахарного диабета 2 типа, более высоких значений γ-глутамилтрансферазы и липопротеидов низкой плотности (р<0,01). Достоверно чаще были зафиксированы прогрессирующие стадии фиброза печени (F2–3) у пациентов с НАЖБП и ЖКБ, при этом стадия фиброза имела положительную достоверно значимую взаимосвязь с холецистэктомией (rs=0,366, р≤ 0,01), что говорит об увеличении риска прогрессирующего течения НАЖБП после удаления желчного пузыря. В целом для пациентов с НАЖБП и ЖКБ были характерны высокие значения инсулина, лептина и более низкие значения адипонектина. Вместе с тем было установлено, что у лиц с сохраненным желчным пузырем уровень лептина сопоставим с таковым у пациентов, страдающих НАЖБП без ЖКБ, а после перенесенной холецистэктомии отмечен скачкообразный, более чем двукратный рост уровня лептина по сравнению с лицами с ЖКБ до операции.
Для того чтобы оценить влияние рассматриваемых патологий на уровень риска развития фатальных ССЗ, мы провели оценку степени риска по шкале SCORE 2019 г. в наших группах сравнения (использовали шкалу для регионов с повышенным риском). В подгруппе пациентов с коморбидным течением и проведенной холецистэктомией выявлена достоверно бóльшая доля лиц с высоким уровнем риска ССЗ в течение следующих 10 лет (χ2=9,4140, p<0,01).
Таким образом, коморбидное течение НАЖБП и ЖКБ имеет клинико-лабораторные особенности. Постхолецистэктомическое течение ЖКБ у пациентов с НАЖБП характеризуется повышением кардиоваскулярного риска и прогрессированием фиброза печени.
Фармакотерапия при НАЖБП и ЖКБ
Для профилактики развития кардиоваскулярных заболеваний у пациентов с НАЖБП и ЖКБ необходимо использовать патогенетически обоснованную и высокоэффективную терапию. Урсодезоксихолевая кислота (УДХК) обладает мощным литолитическим эффектом и является препаратом первого выбора у пациентов с ЖКБ [2, 45]. Имеются неоспоримые данные о том, что монотерапия УДХК при лечении НАЖБП от 5 до 24 мес. достоверно снижает клинико-биохимическую активность заболевания и выраженность фиброза [46]. В исследовании [47] с участием 207 пациентов с НАЖБП, которые имели признаки раннего атеросклероза, было обнаружено, что прием УДХК в дозе 15 мг на 1 кг массы тела привел к статистически значимому уменьшению стеатоза печени (оценивался по индексу FLI) и толщины комплекса интима-медиа, это позволяет говорить о самостоятельном гиполипидемическом эффекте УДХК, который реализуется через уменьшение инсулинорезистентности и повышение уровня аполипопротеина А1 (липопротеида высокой плотности).
Представляет интерес также глицирризиновая кислота (ГК, глицирризин) — сапонин корня солодки. Солодка входит в состав препаратов традиционной китайской медицины, применяется в различных областях, и в частности в терапии ЖКБ с целью купирования воспаления и восстановления функции печени. Из всех известных эффектов ГК наиболее актуальны противовоспалительный (системный и местный), гепатопротективный, антифибротический и антиканцерогенный [48]. Так, в плацебо-контролируемом рандомизированном клиническом исследовании [49], включившем 66 пациентов с НАЖБП, назначение препарата солодки сопровождалось статистически значимым снижением активности аланинаминотрансферазы и аспартатаминотрансферазы. В группе плацебо такого эффекта зарегистрировано не было.
В 2019 г. впервые в России и в мире была зарегистрирована фиксированная комбинация ГК и УДХК (Фосфоглив® УРСО) в форме капсул, содержащих действующие вещества в количестве 35 мг и 250 мг соответственно. На доклиническом этапе исследований [50] на модели холестаза было установлено, что фиксированная комбинация в сравнении с монопрепаратом УДХК эффективнее влияет на активность аланинаминотрансферазы, аспартатаминотрансферазы, γ-глутамилтранспептидазы, щелочной фосфатазы, уровень прямого и непрямого билирубина, а также на гистологическую картину печени. Комбинированный препарат Фосфоглив® УРСО запатентован в качестве лекарственного средства для профилактики и лечения острого и хронического гепатита и холестаза. Учитывая его более выраженный плейотропный эффект в сравнении с монотерапией УДХК, препарат используют в лечении пациентов с сочетанной патологией — функциональными расстройствами, билиарным сладжем и НАЖБП. Препарат показал хорошую переносимость и минимальное количество побочных эффектов [51, 52].
Заключение
Клинические исследования и систематические обзоры демонстрируют связь между ЖКБ, холецистэктомией и НАЖБП, которая выражается в том, что, во-первых, НАЖБП является независимым фактором риска развития ЖКБ и наоборот, а во-вторых, после выполнения холецистэктомии развиваются метаболические нарушения и ассоциированная с ними НАЖБП. Коморбидное течение НАЖБП и ЖКБ характеризуется — наряду с нарушениями липидного обмена, изменениями количества и соотношения ЖК, гормональными расстройствами — гиперлептинемией, лептинорезистентностью и инсулинорезистентностью. Холецистэктомия выступает как неблагоприятный фактор прогрессирующего течения НАЖБП и развития фиброза печени. Вся эта взаимообусловленность коморбидных патологий и сопутствующих им факторов риска требует разработки индивидуальных схем ведения пациентов. Двухкомпонентный препарат Фосфоглив® УРСО применяется как гепатопротективное средство с патогенетически направленным действием при коморбидном течении НАЖБП и ЖКБ.
Сведения об авторах:
Кролевец Татьяна Сергеевна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-7452-7230.
Ливзан Мария Анатольевна — д.м.н., профессор, член-корреспондент РАН, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Сыровенко Мария Игоревна — ординатор кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-6300-367X.
Черкащенко Наталья Александровна— к.м.н., заведующая терапевтическим отделением ФГБУЗ ЗСМЦ ФМБА России; 644099, Россия, г. Омск, ул. Красный Путь, д. 127, корп. 1; ORCID iD 000-003-3743-143X.
Контактная информация: Кролевец Татьяна Сергеевна, e-mail: mts-8-90@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 31.03.2022.
Поступила после рецензирования 25.04.2022.
Принята в печать 24.05.2022.
About the authors:
Tatyana S. Krolevets — C. Sc. (Med.), associate professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-7452-7230.
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the RAS, Head of the Department of Faculty Therapy and Gastroenterology, Chancellor Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Maria I. Syrovenko — resident of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-6300-367X.
Natal’ya A. Cherkashchenko — C. Sc. (Med.), Head of the Therapeutic Department, West Siberian Medical Center of the Federal Medical Biological Agency of Russia; 127 build. 1, Krasnyy Put’ str., Omsk, 644099, Russian Federation; ORCID iD 000-003-3743-143X.
Contact information: Tatyana S. Krolevets, e-mail: mts-8-90@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 31.03.2022.
Revised 25.04.2022.
Accepted 24.05.2022.
.
Информация с rmj.ru






