Введение
Внебольничная пневмония (ВП) в педиатрической практике является одной из самых частых причин госпитализации детей в инфекционные стационары [1]. Заболеваемость ВП, в том числе вирусно-бактериальной этиологии, в педиатрической практике высока, несмотря на эффективность проводимой вакцинопрофилактики пневмококковой и гемофильной инфекции [2].
По данным крупномасштабного популяционного исследования, проведенного в США в 2015 г., в этиологии ВП у детей преобладали вирусные патогены. При этом доля вирусно-бактериальных пневмоний составляла 7% [3]. В исследовании, проведенном в Китае в период до пандемии COVID-19, в этиологической структуре ВП преобладали бактериальные патогены, при этом доля вирусно-бактериальных ВП была значительно выше по сравнению с данными США – 38,6%. В период после пандемии COVID-19 в Китае отмечалось увеличение доли монобактериальных ВП с 7,53 до 9,6% [4].
Известно о диагностической и прогностической значимости уровня цитокинов в сыворотке крови, а также зависимости их уровня от тяжести течения, наличия осложнений ВП [5–7]. Ранее изучение значимости/роли цитокинов при ВП было реализовано посредством оценки уровней только отдельных цитокинов и лишь у взрослых [8]. Для взрослых были разработаны шкалы прогнозирования тяжести или смертности — CURB-65, PSI, SMART-COP [9], но для детей таких оценок мало [1, 10, 11]. В большинстве исследований, проведенных в период пандемии COVID-19, изучался уровень ИЛ-6 как диагностического и прогностического фактора [12]. Значимость ВП в структуре детской смертности во всем мире высока, но диагностика, лечение и профилактика ВП в большей степени были основаны на исследованиях, проведенных среди взрослых [1]. Таким образом, в постпандемийный период исследований по данным вопросам недостаточно.
Цель исследования: определить прогностические признаки неблагоприятного течения ВП у детей на основании исследования уровня сывороточных цитокинов и этиологии заболевания.
Содержание статьи
Материал и методы
Обследовано 126 детей с подтвержденной ВП, из них младше 1 года — 23, от 1 года до 2 лет 11 мес. — 31, от 3 лет до 6 лет 11 мес. — 33, от 7 лет и старше — 39. Среди пациентов с нетяжелой ВП (n=66) в возрасте до 1 года было 7, от 1 года до 2 лет 11 мес. — 13, от 3 до 7 лет — 21, от 7 лет и старше — 25; с тяжелой ВП (n=60) в возрасте до 1 года было 16, от 1 года до 2 лет 11 мес. — 18, от 3 до 7 лет — 12, от 7 лет и старше — 14. Обследование пациентов и наблюдение за ними осуществляли на базе детского инфекционного отделения ГАУЗ МО «Химкинская ОБ». Исследование одобрено локальным этическим комитетом. От всех законных представителей пациентов получено добровольное информированное согласие.
Этиология ВП определена у всех 126 детей. Исследован материал из ротоглотки и/или трахеи (взят в первые сутки госпитализации) на возбудителей респираторных инфекций методом ПЦР на базе референс-центра по контролю за возбудителями инфекций верхних и нижних дыхательных путей с помощью наборов АмплиСенс® (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия): мазки (66,9%), аспираты (29,8%), мазок и аспират (3,2%). Исследование проводилось в двух периодах наблюдения: с марта 2022 г. по март 2023 г. (79 детей), с марта 2023 г. по март 2024 г. (47 детей). Всем пациентам выполнено исследование крови на специфические IgM, IgG к M. pneumoniae методом ИФА-БЕСТ («Вектор-Бест», Россия). Кроме того, у 73 детей проведена ретроспективная оценка уровня сывороточных цитокинов (материал взят в первые сутки госпитализации) в зависимости от этиологии, тяжести течения, наличия осложнений и локализации процесса. Контролем служили показатели, полученные у 15 здоровых детей, сопоставимых по полу и возрасту. Сыворотка крови исследована методом ИФА для количественного определения уровней цитокинов — использованы наборы Invitrogen (ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-17F, ИЛ-21, ФНО-α), RayBiotech (ИЛ-12), R&D systems (ИЛ-3). Дизайн исследования представлен на рисунке 1.
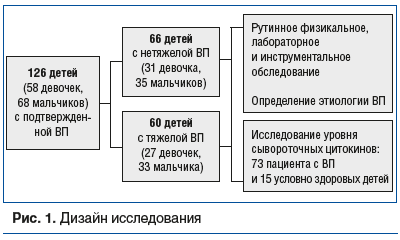
Статистическая обработка данных проведена с использованием программы StatTech 4.3.2 (ООО «Статтех», Россия, 2024). Нормальность распределения определяли с помощью критерия Шапиро — Уилка или критерия Колмогорова — Смирнова. Количественные данные при ненормальном распределении описывали с помощью медианы и интерквартильного интервала (Me [Q1–Q3]). При сравнении двух групп использовали U-критерий Манна — Уитни, при сравнении трех и более групп — критерий Краскела — Уоллиса. Категориальные данные указаны в процентных долях. Сравнение осуществляли с помощью критерия χ2 Пирсона или точного критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Доля вирусной этиологии ВП среди всех обследованных детей за оба периода наблюдения составила 14,3%, бактериальной — 30,2%, вирусно-бактериальной — 41,3%, неустановленной — 14,2%. Доля ВП, вызванной M. pneumoniae, по данным прямых и непрямых методов диагностики, за два периода наблюдения составила 40,5%. За весь период наблюдения бактериальные возбудители выделены у 71,4% пациентов (67,1% — в 2022–2023 гг., 78,7% — в 2023–2024 гг.), вирусные — у 55,6% (58,2% — в 2022–2023 гг., 51,1% — в 2023–2024 гг.). Среди бактериальных возбудителей ВП преобладали: S. pneumoniae (22,2%), K. pneumoniae (19,8%), H. influenzae (17,5%); среди вирусных патогенов — риновирус (15,1%), респираторно-синцитиальный вирус (РСВ) (11,9%), бокавирус (11,1%). При этом преобладали ВП сочетанной этиологии — 46,8% в 2022–2023 гг., 44,7% в 2023–2024 гг. (p>0,05). Доля моноинфекции возросла в 2023–2024 гг. — 42,6% против 27,8% в 2022–2023 гг. (p>0,05). В 2022–2023 гг. вирусно-бактериальная этиология ВП была у 43,0%, вирусная — у 15,2%, бактериальная — у 24,1%. В 2023–2024 гг. доли вирусно-бактериальных (38,3%) и вирусных (12,8%) ВП были ниже, а бактериальных — выше (40,4%) (p>0,05).
Частота моновирусной этиологии заболевания снизилась с 15,2% в 2022–2023 гг. до 12,8% в 2023–2024 гг. (р>0,05). Доли бактериальных ВП, напротив, имели тенденцию к росту — с 24,1 до 40,4% (p>0,05).
В 2022–2023 гг. среди патогенов преобладали K. pneumoniae (22,8%), A. baumannii (18,9%), а также риновирус (20,3%), бокавирус (15,2%). В 2023–2024 гг. возросла доля S. pneumoniae — с 18,9 до 27,7%, H. influenzae — с 15,2 до 21,3%, РСВ — с 8,9 до 14,9% (для всех p>0,05).
Особое место в структуре этиологических факторов ВП в 2023–2024 гг. занимает M. pneumoniae, доля которой увеличилась с 5,1 до 23,4% (по результатам выделения ДНК из материала из дыхательных путей) (p<0,05). Согласно данным комплексной диагностики с применением прямых и непрямых методов микоплазменная ВП в 2022–2023 гг. зарегистрирована у 34,2% обследованных, в 2023–2024 гг. — у 51,1% (р>0,05).
Внебольничные пневмонии микоплазменной этиологии чаще протекали в форме сочетанной инфекции — 60,8%. За весь период наблюдения M. pneumoniae чаще всего сочеталась с H. influenzae (19,6%), S. pneumoniae (11,8%), риновирусом (11,8%), РСВ (7,8%). При этом при тяжелых ВП чаще, чем при нетяжелых, зафиксировано сочетание M. pneumoniae с вирусами — 60% против 40% соответственно. При нетяжелых ВП чаще по сравнению с тяжелыми ВП регистрировали сочетания с другими бактериями — 58,5% против 41,5% соответственно.
В группе пациентов (n=73), у которых определяли уровни сывороточных цитокинов, по результатам изучения материала из дыхательных путей вирусная этиология ВП подтверждена у 15,1%, бактериальная — у 34,2%, вирусно-бактериальная — у 39,7%, возбудители не выделены у 11,0%. Доля моноинфекции в данной группе составила 35,6%, доля инфекции сочетанной этиологии — 53,4%. Среди бактериальных возбудителей преобладали S. pneumoniae (24,7%) и H. influenzae (17,8%), среди вирусов — риновирус (16,4%), бокавирус (9,6%). Двустороннее поражение легких зафиксировано у 41,1%, одностороннее — у 58,9%. Тяжелая ВП имела место в 49,3% наблюдений, нетяжелая — в 50,7%.
Микоплазменная этиология ВП, по данным прямых и непрямых методов диагностики, установлена в 39,7% наблюдений, из них моноинфекция — в 34,5%, инфекция сочетанной этиологии — в 65,5%. Нетяжелых ВП в данной группе было 79,3%, тяжелых — 20,7%.
Зафиксирован более высокий уровень ИЛ-6 и ИЛ-8 в группе пациентов с тяжелыми ВП по сравнению с нетяжелыми (табл. 1). При этом уровень ИЛ-6 был выше в группе детей с ВП по сравнению с группой условно здоровых. Уровень ИЛ-8, напротив, был выше в группе условно здоровых, чем у детей с ВП. Не установлено различий при анализе уровня ИЛ-12 и ИЛ-3 в подгруппах тяжелых и нетяжелых ВП и по сравнению с условно здоровыми. Уровни ФНО-α и ИЛ-17F были выше у детей с ВП, чем в контрольной группе. Содержание ИЛ-17F и ИЛ-21 было выше у пациентов с тяжелыми ВП по сравнению с нетяжелыми ВП и с условно здоровыми. При двустороннем поражении легких уровень ИЛ-17F и ИЛ-8 был значимо выше, чем при одностороннем. Для ИЛ-17F при двустороннем и одностороннем поражении значения составили 64,6 [43,85–74,6] и 39,5 [35,85–66,1] пг/мл соответственно (p<0,05), для ИЛ-8 — 7,65 [4,65–21,95] и 5,2 [2,8–7,5] пг/мл соответственно (p<0,05).
![Таблица 1. Уровни сывороточных цитокинов (пг/мл) в обследованной группе в зависимости от тяжести ВП, Me [Q1–Q3] Таблица 1. Уровни сывороточных цитокинов (пг/мл) в обследованной группе в зависимости от тяжести ВП, Me [Q1–Q3]](https://medblog.su/wp-content/uploads/2025/04/1744291133_449_Vnebolnichnye-pnevmonii-u-detej-v-period-posle-pandemii-COVID-19-CHto.png)
При вирусной этиологии ВП уровень ИЛ-17F был достоверно выше, чем при бактериальной (табл. 2). Уровень ИЛ-3 при вирусно-бактериальном поражении был выше по сравнению как с моновирусной этиологией, так и с монобактериальной этиологией. По другим изученным показателям статистически значимых различий не получено.
![Таблица 2. Уровни сывороточных цитокинов (пг/мл) в об- следованной группе в зависимости от этиологии ВП, Me [Q1–Q3] Таблица 2. Уровни сывороточных цитокинов (пг/мл) в об- следованной группе в зависимости от этиологии ВП, Me [Q1–Q3]](https://medblog.su/wp-content/uploads/2025/04/1744291133_377_Vnebolnichnye-pnevmonii-u-detej-v-period-posle-pandemii-COVID-19-CHto.png)
У детей с микоплазменной этиологией ВП уровень противовоспалительного ИЛ-21 был значимо ниже, чем у детей с другой этиологией ВП, — 89,60 [60,26–124,26] и 125,60 [84,26–164,93] пг/мл соответственно (p<0,05). При этом при тяжелых микоплазменных ВП уровень ИЛ-17F оказался значимо выше в сравнении с нетяжелыми микоплазменными ВП — 75,38 [68,22–80,45] и 38,8 [35,85–40,8] пг/мл соответственно (p<0,05). Не выявлено зависимости уровней цитокинов при ВП микоплазменной этиологии от объема поражения.
Не выявлено различий сывороточных уровней ИЛ-6 и ИЛ-8 у пациентов с моноинфекцией и инфекцией сочетанной этиологии. Содержание ИЛ-6 при микоплазменных ВП составило 10,5 [6,4–30,5] пг/мл, при ВП другой этиологии — 9,15 [6,47–68,72] пг/мл; ИЛ-8 — 6,1 [4,3–7,7] и 6,2 [2,88–19,33] пг/мл соответственно (p>0,05).
При двустороннем поражении легких уровень ИЛ-8 был выше по сравнению с односторонним — 7,65 [4,65–21,95] и 5,2 [2,8–7,5] пг/мл соответственно (p<0,05). Та же тенденция установлена для ИЛ-17F — 64,6 [43,85–74,6] и 39,5 [35,85–66,1] пг/мл соответственно (p<0,05). По другим исследуемым цитокинам не было выявлено статистически значимых различий.
Анализ уровня ИЛ-21 выявил его более высокий уровень при немикоплазменной этиологии ВП — 125,6 [84,26–164,93] пг/мл, чем при микоплазменной этиологии, — 89,6 [60,26–124,26] пг/мл (p<0,05).
При ВП, осложненных выпотным плевритом, зафиксирован статистически значимо более высокий уровень ИЛ-6, ИЛ-8 и ИЛ-12 в сравнении с неосложненными ВП (рис. 2).
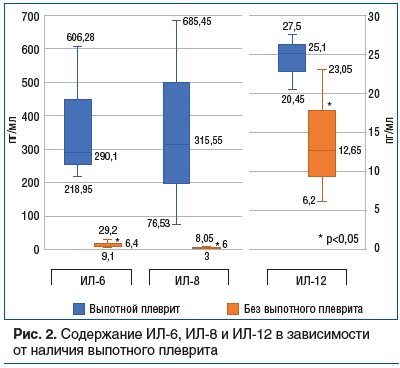
Уровень ФНО-α был выше у детей, имевших дыхательную недостаточность (ДН) при поступлении, по сравнению с пациентами без нее — 7,56 [4,57–8,58] пг/мл против 3,8 [1,96–6,11] пг/мл (p<0,05).
Обсуждение
В 2023–2024 гг. во всем мире отмечена тенденция к увеличению роли бактериальных возбудителей в этиологии ВП у детей по сравнению с допандемийным и пандемийным периодами. В исследовании, проведенном в Китае, отмечается схожая динамика: над вирусными преобладают бактериальные патогены, высока доля вирусно-бактериальных ВП [4]. Однако в нашем исследовании доля моноинфекций возросла в сравнении с 2022–2023 гг. Чаще всего в материале от больных в 2023–2024 гг. выявляли S. pneumoniae, M. pneumoniae, H. influenzае. Доля микоплазменной ВП в 2023–2024 гг. возросла, что было спрогнозировано P.M. Meyer Sauteur et al. [13]. В обследованных группах детей преобладала вирусно-бактериальная этиология ВП. Среди бактериальных возбудителей ВП преобладали: S. pneumoniae, K. pneumoniae, H. influenzae; среди вирусных — риновирус, РСВ, бокавирус. Важно отметить, что микоплазменная инфекция в 60,8% наблюдений протекала в форме инфекций сочетанной этиологии. При этом доля вирусных сочетаний была выше у детей с тяжелым течением микоплазменной инфекции, а бактериальных — с нетяжелым.
В ряде работ показано, что высокий уровень ИЛ-6 является предиктором тяжелого и осложненного течения ВП различной этиологии. Установлено, что при высоком уровне ИЛ-6 бактериальная этиология ВП более вероятна, чем вирусная [14]. Течение тяжелой ВП у детей, нуждающихся в искусственной вентиляции легких, в шоковом состоянии, с долевым поражением легких и летальным исходом сопровождалось высоким уровнем ИЛ-6 [4, 5, 15]. Согласно полученным нами данным уровень ИЛ-6 был выше при тяжелых ВП в сравнении с нетяжелыми, а также при ВП, осложненных выпотным плевритом. Однако зависимости от объема поражения не выявлено. Кроме того, у детей с выпотным плевритом мы зарегистрировали высокие значения сывороточного ИЛ-12, что может объясняться активацией T-лимфоцитов, усилением цитотоксической активности NK-клеток и CD8+ цитотоксических Т-лимфоцитов, а также индукцией синтеза интерферона γ, что в совокупности способствует образованию экссудата в плевральной полости.
Существуют данные о том, что ИЛ-6 и ФНО-α являются предикторами тяжелого течения ВП не только бактериальной, но и вирусной этиологии. При этом уровень ИЛ-6 и ФНО-α при ВП у детей зависел от вида вируса — метапневмовирус, вирусы гриппа типа А и В [7]. Однако в нашем исследовании значимости данных цитокинов при определении этиологии не выявлено. При этом уровень ФНО-α был выше в группе детей, имевших ДН при поступлении в стационар. В работе A. Bénard et al. [16] низкие уровни ИЛ-3 были связаны с тяжестью, высокой вирусной нагрузкой и смертностью при инфекции SARS-CoV-2. В нашем исследовании уровень ИЛ-3 не зависел от тяжести ВП, однако более высокие уровни ассоциировались с вирусно-бактериальной этиологией заболевания.
По данным М.В. Шипилова и соавт. [17], высокий уровень ИЛ-17 наблюдался в остром периоде ОРВИ, тогда как истощение его выработки — при тяжелой форме гриппа с начального периода заболевания. В работе Г.П. Евсеевой и соавт. [18] при сравнении групп детей с осложненными и неосложненными ВП уровень ИЛ-17 был ниже в группе осложненных. В нашем исследовании зафиксирован достоверно более высокий уровень ИЛ-17F при вирусных, тяжелых и двусторонних ВП.
В исследовании Q. Chen et al. [19] в группе детей с долевой ВП сывороточные уровни провоспалительного ИЛ-8 увеличивались по мере прогрессирования заболевания и уменьшались после проведенного лечения. В работе A.L. Jung et al. [20] у пациентов с ВП и здоровых добровольцев уровни ИЛ-8 значимо различались и были выше у пациентов с тяжелой ВП по сравнению с нетяжелыми, что подтверждается данными нашего исследования. Также в нашем исследовании продемонстрирована зависимость уровня ИЛ-8 от объема поражения легких, он был выше при двусторонних ВП и при выпотном плеврите.
В работе N.A. Acet Öztürk et al. [21] показано, что высокие уровни сывороточных ИЛ-6 и ИЛ-21 при поступлении являются независимыми предикторами клинического ухудшения течения ВП. При этом выявлены различия в уровне сывороточного ИЛ-21 — у пациентов с ВП, вызванной SARS-CoV-2, он выше по сравнению с ВП не-SARS-CoV-2-этиологии. В нашем исследовании уровень сывороточного ИЛ-21 был значимо выше при тяжелых ВП по сравнению с нетяжелыми, хотя SARS-CoV-2 в наших наблюдениях не был выявлен ни у одного пациента.
Учитывая рост доли микоплазменной этиологии заболевания (до 40% в этиологической структуре ВП), изучение цитокинового статуса при ВП, вызванной M. pneumoniae, представляется актуальным. По данным L.P. Wang et al. [3], у детей с тяжелой ВП микоплазменной этиологии наблюдается более выраженное увеличение уровня провоспалительных цитокинов (ИЛ-6, ИЛ-8, ИЛ-10 и ФНО-α) по сравнению с нетяжелыми. Более низкие уровни ИЛ-17A, по данным M. Yang et al. [22], коррелировали с рефрактерностью микоплазменной ВП к антибактериальной терапии и развитием осложнений — экссудативного плеврита. По данным нашего исследования, при тяжелых ВП микоплазменной этиологии отмечается более высокий уровень провоспалительного ИЛ-17F. Как показали H. Xing et al. [23], высокий уровень сывороточного ИЛ-21 может способствовать прогрессированию ВП микоплазменной этиологии у детей, а его чрезмерно высокий уровень может быть связан с развитием рефрактерности к терапии. В приведенном исследовании сравнивали только микоплазменную ВП с рефрактерной к терапии микоплазменной ВП. В наших наблюдениях развития рефрактерной микоплазменной инфекции не зафиксировано.
Уровень противовоспалительного ИЛ-21 при микоплазменной ВП в наших наблюдениях был ниже, чем при ВП другой этиологии, что демонстрирует дисбаланс между про- и противовоспалительными цитокинами, приводящий к выраженной воспалительной реакции и развитию внелегочных осложнений. Так, у детей с тяжелой ВП, вызванной M. pneumoniae, наблюдались значительно более высокие уровни провоспалительных ИЛ-6 и ИЛ-8 по сравнению с нетяжелыми микоплазменными ВП [24].
По данным W. Li et al. [25], уровни ДНК M. pneumoniae в аспиратах из дыхательных путей, ИЛ-6 и ИЛ-8 имеют решающее значение в развитии и прогрессировании ВП, вызванной M. pneumoniae. В исследовании F. Fan et al. [26] выявлены различия в клинических характеристиках и уровнях сывороточных воспалительных маркеров (ИЛ-6 и ИЛ-8) между группами микоплазменной ВП и ВП другой этиологии, рефрактерной микоплазменной ВП и микоплазменной ВП. Значительное повышение уровня ИЛ-17A при ВП, вызванной M. pneumoniae, коррелировало с диффузным бронхиолитом и поражением доли легкого; повышение содержания ИЛ-6 ассоциировалось с долевым поражением, которое осложнялось некротическим процессом [27]. В нашем исследовании при микоплазменных ВП, в сравнении с ВП другой этиологии, не установлено различий в уровнях ИЛ-6 и ИЛ-8. Зависимости уровней цитокинов от объема поражения при микоплазменной ВП в нашем исследовании выявлено не было.
Таким образом, нами было показано, что при участии вирусных возбудителей в этиологии ВП у детей (в том числе и микоплазменной этиологии) заболевание протекает в более тяжелой, осложненной форме на фоне дисбаланса про- и противовоспалительных цитокинов в сторону усиления воспаления.
Учитывая, что вирусная коинфекция способна приводить к более тяжелому течению ВП, включение в комплексную терапию пневмонии у таких пациентов препаратов с противовирусной активностью рассматривается как необходимая и полностью соответствующая рациональным принципам лечения тактика. Еще более перспективным может считаться применение препаратов, способных оказывать дополнительно и противовоспалительное действие. Например, у препарата Ингавирин®, действующим веществом которого является имидазолилэтанамид пентандиовой кислоты, выявлена способность снижать уровни провоспалительных цитокинов — ФНО-α, ИЛ-1β и ИЛ-6, повышенные у пациентов с ОРВИ [28]. Препарат Ингавирин® разрешен для применения у детей с 6 мес. Действие препарата включает усиление врожденного иммунного ответа через повышение чувствительности к интерферонам I типа, а также противовоспалительный эффект. Анализ показателей профиля цитокинов при применении имидазолилэтанамида пентандиовой кислоты (Ингавирин®) выявил снижение содержания провоспалительных цитокинов (ИФН-γ, ИЛ-1β, ИЛ-17) и противовоспалительного ИЛ-4, а также более выраженное снижение исходно повышенного уровня ИЛ-6 при лечении препаратом по сравнению с плацебо [28, 29].
Ограничения настоящего исследования: при сравнении уровней цитокинов пациенты не были разделены по возрастным группам; микоплазменная этиология пневмонии устанавливалась по данным косвенных и/или прямых методов диагностики; пациенты с тяжелыми ВП были обследованы в период наблюдения 2022–2023 гг.
Заключение
Прогностические признаки неблагоприятного течения ВП у детей в постпандемийный период:
-
наличие вирусной коинфекции с M. pneumoniae, что утяжеляет клиническое течение заболевания. При ВП сочетанной этиологии с M. pneumoniae чаще фиксировались H. influenzae, S. pneumoniae, риновирус и РСВ; при тяжелых микоплазменных ВП чаще — вирусы, при нетяжелых — бактерии;
-
повышение продукции как провоспалительных (ИЛ-6, ИЛ-8, ИЛ-17F) так и противовоспалительных (ИЛ-21) цитокинов;
-
повышение содержания ИЛ-17F и ИЛ-8 как маркер двустороннего поражения легких;
-
высокие уровни ИЛ-6, ИЛ-8 и ИЛ-12 как маркер наличия выпотного плеврита;
-
повышение уровня ФНО-α как предиктор развития ДН;
-
высокий уровень ИЛ-17F как прогностический маркер тяжести микоплазменной ВП.
Кроме того, установлено, что для вирусной этиологии ВП характерны наиболее высокие уровни провоспалительного ИЛ-17F, а для вирусно-бактериальной ВП — ИЛ-3.
Таким образом, наличие вирусного патогена как этиологического фактора ВП повышает уровень системного воспаления, что обусловливает необходимость проведения противовирусной терапии, в том числе с целью профилактики развития осложнений.
Информация с rmj.ru






