Введение
В настоящее время, несмотря на очевидные достижения в диагностике, лечении и профилактике атеросклеротических сердечно-сосудистых заболеваний, инфаркт миокарда (ИМ) по-прежнему сохраняет лидирующие позиции по распространенности и частоте осложнений в российской популяции. При отсутствии своевременных и адекватных лечебных мероприятий у этой категории больных в постинфарктном периоде неизбежно формируются фиброзирование миокарда, нарастающая гемодинамическая перегрузка камер сердца давлением и объемом кровотока (миокардиальный стресс), нейрогуморальная гиперактивность. В конечном итоге перечисленные патоморфологические и патофизиологические процессы приводят к ремоделированию миокарда и коронарных артерий с клиническими проявлениями хронической сердечной недостаточности (ХСН) и к другим осложнениям ишемического генеза [1, 2].
Ключевыми инструментами прогнозирования ишемических событий при остром коронарном синдроме (ОКС) являются шкалы риска (GRACE 2.0, TIMI, CADILLAC, DAPT, Zwolle и др.), включающие различные клинические, инструментальные и лабораторные показатели (тропонины, креатинин). Биомаркеры (высокочувствительный тропонин Т, натрийуретические пептиды (НУП), высокочувствительный С-реактивный белок) уже заняли прочные позиции в диагностике, оценке прогноза и мониторинге эффективности терапии у пациентов с ИМ. С учетом высокой важности вышеупомянутых патологических процессов в развитии ХСН и других осложнений на постинфарктном этапе исследование сывороточной активности биомаркеров миокардиального стресса (растворимый белок подавления онкогенности 2 (soluble protein suppressor of tumorigenicity 2, ST2), копептин) и фиброза (матриксная металлопротеиназа 9 (ММП-9), галектин-3) у лиц в ранние сроки от начала ИМ для комплексной оценки риска крупных ишемических событий (КИС) представляет большой научно-практический интерес [3–6].
Цель исследования: оценка ассоциаций между риском по шкале GRACE 2.0 и биомаркерами миокардиального стресса и фиброза, определенными у больных в острой фазе ИМ (до 24 ч), с риском развития КИС при 4-летнем постинфарктном наблюдении.
Содержание статьи
Материал и методы
В проспективное обсервационное исследование на протяжении 2020 г. последовательно было включено 88 пациентов с острым ИМ, которые проходили курс стационарного и амбулаторного лечения в БУ «Окружной кардиологический диспансер «Центр диагностики и сердечно-сосудистой хирургии» (г. Сургут). На этапе поступления и первичного врачебного осмотра в приемном отделении всем пациентам были разъяснены основные положения научного исследования, после чего состоялось подписание информированного согласия. Дизайн исследования был рассмотрен и одобрен локальным биоэтическим комитетом в клинике перед инициацией эксперимента (протокол № 4 от 26 декабря 2019 г.).
Критерии включения: острый ИМ с элевацией и без элевации сегмента ST на электрокардиограмме (ЭКГ) и началом болевого синдрома до 24 ч, возраст 35–70 лет. Критерии невключения: продолжительность болевого синдрома более 24 ч, серологически подтвержденное инфицирование SARS-CoV-2, беременность и лактация, онкологическое заболевание, инфицированность вирусом иммунодефицита человека, отказ пациента от участия в исследовании.
В случае согласия в приемном отделении клиники проводился однократный забор венозной крови (1–24 ч от начала ИМ) в вакуумные пробирки с активатором свертывания для получения сыворотки. Затем биообразцы транспортировались в лабораторию «Биобанк Югры» (Медицинский институт Сургутского государственного университета) для аликвотирования в криопробирки и размещения на долговременное хранение в термостатах при температуре -80 °C. На этапе биохимического исследования в размороженных образцах сыворотки были определены иммуноферментным методом уровни биомаркеров миокардиального стресса: ST2 (тест-система Presage ST2, Critical Care Diagnostics, США), копептин (тест-система Human EIA Kit, Phoenix Pharmaceuticals, США), уровни биомаркеров фиброза миокарда: ММП-9 и галектин-3 (тест-системы Invitrogen Human ELISA Kit, ThermoFisher Scientific, США).
После обследования и подготовки в условиях приемного отделения пациенты транспортировались в рентген-хирургический блок для проведения экстренной коронарной ангиографии. В результате 79 (90%) пациентам в острой фазе ИМ выполнена коронарная ангиопластика со стентированием (КС), а 9 (10%) лицам — коронарное шунтирование (КШ) в условиях искусственного кровообращения. После выполнения экстренной реваскуляризации миокарда (РМ) пациенты переводились в кардиологическое отделение, где получали базисную медикаментозную терапию в полном объеме. После выписки из стационара все постинфарктные больные наблюдались у кардиолога в консультативном кардиологическом отделении клиники на протяжении 4 лет. В процессе амбулаторного наблюдения у пациентов регистрировались КИС, включая кардиальную смерть, госпитализацию по поводу острой/декомпенсированной СН, повторный ОКС, повторную симптом-обусловленную РМ (КС или КШ), ишемический инсульт. Риск 3-летней кардиальной смерти после ИМ был рассчитан по соответствующей формуле шкалы GRACE 2.0 (далее — риск GRACE 2.0), величины представлены в процентах.
Статистический анализ клинических данных проводился в программных пакетах Statistica 13 (TIBCO, США) и SPSS 25 (IBM, США). Интервальные показатели представлены в абсолютных и относительных величинах (n, %). Для описания непараметрических признаков были использованы медиана (Me) и квартили [Q1; Q3]; для оценки наличия ассоциаций между признаками — корреляционный анализ (линейная связь), парциальный корреляционный анализ (нелинейная связь), анализ таблиц сопряженности (критерий Пирсона χ2); для оценки предиктивной точности биомаркеров — анализ характеристических кривых обнаружения (receiver operating curve — ROC, далее — ROC-анализ), бинарная логистическая регрессия. Уровень статистической значимости (p) <0,05 считали приемлемым для отклонения нулевой гипотезы.
Результаты и обсуждение
Клинико-анамнестические данные, показатели риска по шкале GRACE 2.0, результаты инструментального и лабораторного обследования пациентов с ИМ в кардиологическом стационаре представлены в таблице 1.

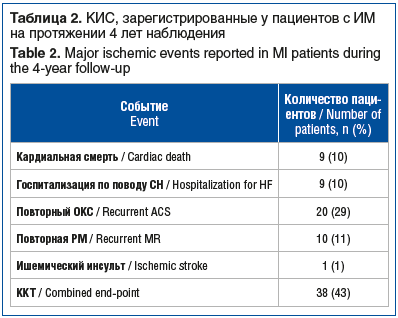
В таблице 2 показана частота развития КИС, которые были зарегистрированы в процессе амбулаторного наблюдения у постинфарктных пациентов на протяжении 4 лет.
На следующем этапе анализа данных исследования у постинфарктных лиц проанализированы взаимосвязи риска по шкале GRACE 2.0, а также биомаркеров миокардиального стресса и фиброза с представленными выше КИС, которые собраны в единую комбинированную конечную точку (ККТ).
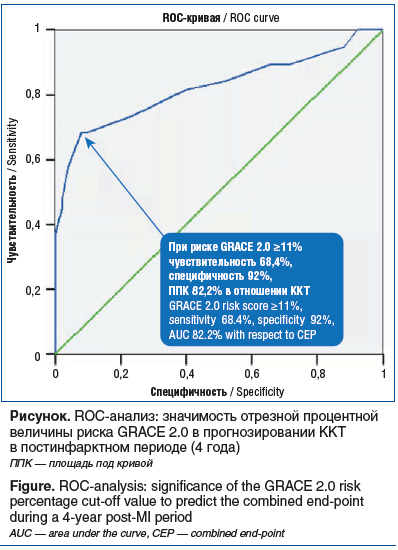
Так, изучена возможность шкалы GRACE 2.0 прогнозировать ККТ в 4-летнем постинфарктном периоде. По данным корреляционного анализа определена значимая прямая связь между риском GRACE 2.0 и ККТ (r=0,56, p<0,0001), а также с повторным ОКС (r=0,64, p<0,0001) и кардиальной смертностью (r=0,64, p=0,005). Для определения точности прогнозирования ККТ по шкале GRACE 2.0 у больных ИМ проведен ROC-анализ (см. рисунок).
По результатам ROC-анализа получены модель высокого качества (ППК 82,2%) для прогнозирования ККТ по шкале GRACE 2.0 и ее отрезная (cut-off) величина (не менее 11%), превышение которой фактически объединяет категории умеренного (11–30%) и высокого (≥30%) риска. Для измерения риска ККТ у лиц с риском GRACE 2.0 ≥11% проведен анализ бинарной многофакторной логистической регрессии, включившей в качестве независимых переменных атеросклероз БЦС и риск GRACE 2.0 ≥11% (табл. 3).
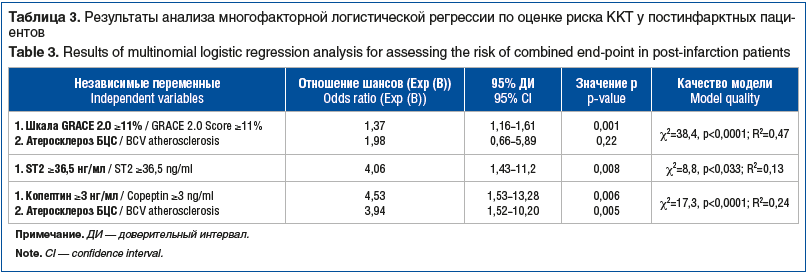
Как показано, риск GRACE 2.0 ≥11% увеличивает риск наступления ККТ на 37% (Exp(B) 1,37, p=0,001), включившей все ишемические события на протяжении 4 лет. Известно, что величины ≥30% представляют категорию высокого риска кардиальной смерти по шкале GRACE 2.0. Нами установлено, что риск GRACE 2.0 ≥11% увеличивает риск наступления всех КИС на протяжении 4 лет на 37%, что сопоставимо с величинами (≥30%) категории высокого риска 3-летней кардиальной смерти по шкале GRACE 2.0. Соответственно, при расчете 3-летнего риска кардиальной смерти по шкале GRACE 2.0 его величины ≥11% обозначают более чем 3-кратное увеличение риска КИС на отдаленных постинфарктных этапах. Важно отметить, что исследование 3-летней модальности шкалы GRACE 2.0 в международной и отечественной литературе представлено малочисленными работами, тогда как большинство исследований по GRACE 2.0 посвящены госпитальным, 30-дневным, 6-месячным и 1-годичным клиническим наблюдениям по оценке смертности при ОКС [7–10]. Клинические работы по применению 3-летней модальности шкалы GRACE 2.0 для оценки КИС (помимо кардиальной смерти и повторного ИМ), а также применения этой шкалы при долгосрочном прогнозе (более 3 лет) нами не найдены.
Миокардиальный стресс представляет собой гемодинамическую перегрузку миокарда ЛЖ объемом и/или давлением кровотока вследствие повышенного артериального давления, нарушений ритма сердца, клапанной или мышечной обструкции выносящего тракта, острого ИМ. Миокардиальный стресс также вносит существенный вклад в развитие постинфарктного ремоделирования миокарда ЛЖ и СН. Одной из базовых ответных реакций миокарда на гемодинамический стресс является секреция целого ряда молекулярных веществ, таких как НУП, ST2, копептин, хромогранин, адреномедуллин [11].
ST2 является белком, подобным рецептору к интерлейкину 1. ST2 существует в мембранной лиганд-связывающей и растворимой изоформах. В современных условиях растворимая форма ST2 используется в качестве диагностического и предиктивного биомаркера у больных острой и хронической СН. В работе А.А. Скворцова и соавт. [12] показано, что пациенты после компенсации СН и выписки из стационара с уровнем ST2 ≥37,8 нг/мл имеют высокий риск сердечно-сосудистой смерти и повторной декомпенсации СН. При этом авторы считают величины ST2 <30 нг/мл целевыми при длительном лечении ХСН после ее компенсации. В работе Н.В. Шиляевой и соавт. [13] установлено, что у пациентов с ХСН и сохраненной ФВ ЛЖ без выраженной коморбидности, госпитализированных для планового КС в период от 4 до 6 нед. после перенесенного ИМ, исходные концентрации ST2 ≥43,6 нг/мл и аминотерминального фрагмента предшественника мозгового НУП (N-Terminal Pro-brain Natriuretic Peptide — NT-proBNP) ≥285 пг/мл демонстрировали высокий риск негативных сердечно-сосудистых событий (повторный ОКС, декомпенсация СН, инсульт) при 9-месячном наблюдении. В многоцентровом клиническом исследовании B. Ky et al. [14] уровни ST2 ≥36,3 нг/мл у амбулаторных пациентов с ХСН и сниженной ФВ ЛЖ показали 2-кратное повышение риска неблагоприятных исходов по сравнению с уровнями <22,3 нг/мл. В ряде отечественных и зарубежных исследований у пациентов, госпитализированных с острым ИМ, в том числе осложненным СН, сывороточные уровни ST2 >35 нг/мл прямо и достоверно ассоциированы с риском наступления госпитальной и 30-дневной кардиальной смерти и декомпенсации СН [11, 15–17].
По нашим данным, сывороточные уровни ST2 прямо коррелируют с госпитализациями по поводу СН (r=0,37, p=0,0004) и ККТ (r=0,26, p=0,014). Для дальнейшего анализа 3-й квартиль уровней ST2 (не менее 36,5 нг/мл) при остром ИМ был взят в качестве отрезной величины, с учетом ее отчетливой ассоциации с постинфарктной ККТ (χ2=7,5, p=0,006). Превышение этой отрезной величины (≥36,5 нг/мл) представляет диапазон уровней ST2 4-го квартиля (36,6–200 нг/мл) у 22 (25%) больных ИМ и прямо сопряжено с 4-кратным статистически значимым повышением риска ККТ (см. табл. 3) на постинфарктном этапе. Установленная в настоящем исследовании отрезная величина ST2 в 1-е сутки ИМ (36,5 нг/мл) отчетливо корреспондирует с соответствующими отрезными значениями этого биомаркера в указанных выше работах.
Копептин является неактивным карбокситерминальным фрагментом провазопрессина. Соответственно, циркулирующие уровни копептина напрямую отражают циркулирующие уровни вазопрессина. Копептин активно высвобождается в системный кровоток у пациентов в течение 4 ч от начала ОКС, в то время как тропонины еще демонстрируют референсные значения, поэтому в кардиологии активно изучается в качестве биомаркера. Установлено, что копептин может использоваться в качестве экспресс-теста для исключения ИМ, однако только в сочетании со стандартными и высокочувствительными тропониновыми тестами [18]. При этом повышенные уровни копептина (>10 пмоль/л или >2 нг/мл) в острой фазе ИМ достоверно ассоциированы с высоким риском неблагоприятных постинфарктных исходов [19].
Нами выявлена прямая корреляция уровней копептина при остром ИМ с госпитализациями по поводу СН (r=0,29, p=0,06), однако значимой связи с ККТ не установлено (r=0,16, p=0,13). При этом 3-й квартиль уровней копептина (не менее 3,0 нг/мл) взят как отрезная величина, превышение которой представляет 4-й квартиль (3,0–9,8 нг/мл) концентраций копептина у 23 (26%) лиц в острой фазе ИМ. Превышение этого уровня копептина (≥3 нг/мл) прямо сопряжено с ККТ (χ2=8,8, p=0,003) и, согласно результатам бинарной логистической регрессии, увеличивает риск ее наступления в 4,5 раза на протяжении 4 лет после ИМ (см. табл. 3). Установленная нами отрезная величина копептина (3,0 нг/мл) близка к отрезному уровню копептина (2 нг/мл) при остром ИМ в указанных выше подобных исследованиях.
На следующем этапе изучены ассоциации биомаркеров фиброза с ККТ. Так, при проведении корреляционного анализа между уровнями галектина-3 и ККТ установлена значимая обратная слабая связь (r=-0,24, p=0,024). Для подтверждения наличия этой связи дополнительно выполнен парциальный корреляционный анализ между галектином-3 и ККТ с введением двух переменных (пол, возраст), но его результат оказался статистически незначимым (r=-0,07, p=0,529). Вероятно, это связано с тем, что в острой фазе ИМ уровни этого белка увеличиваются лишь через 24 ч, достигая пикового значения через 7–14 дней, при этом уровни активности его информационной РНК и синтеза белка регистрируются уже в течение 30 мин от начала ИМ в эксперименте у мышей [20]. Во всех доступных нам клинических исследованиях уровни галектина-3 были сопряжены с ремоделированием ЛЖ и клиническими событиями при их определении на 2–14-е сутки ИМ, тогда как нами оценивались уровни галектина-3 до 24 ч от начала ИМ [1, 4–6, 20].
Корреляционная связь между сывороточными уровнями ММП-9 в острой фазе ИМ и наступлением ККТ также не установлена (r=-0,08, p=0,44) у постинфарктных пациентов. В это же время нет единых позиций по прогностической роли ММП-9 в постинфарктном периоде. Так, в одном исследовании пациенты с ИМ с подъемом сегмента ST показали более высокие уровни ММП-9 по сравнению с лицами без ишемической болезни сердца, но они не имели прогностической ценности при 2-летнем наблюдении. В другом исследовании с более длительным наблюдением (4 года) повышенные уровни ММП-9 при ОКС были ассоциированы с неблагоприятными событиями [21, 22].
Заключение
Шкала GRACE 2.0 и биомаркеры миокардиального стресса являются независимыми предикторами КИС на протяжении 4 лет и могут быть использованы для оценки отдаленного прогноза после перенесенного ИМ. Пациенты с повышенными уровнями ST2 (≥36,5 нг/мл) и копептина (≥3,0 нг/мл) в острой фазе ИМ (до 24 ч), а также с умеренным и высоким риском по шкале GRACE 2.0 (≥11%) представляют фокусную группу ишемического риска для интенсификации наблюдения и оптимизации лечения в постинфарктном периоде.
Сведения об авторах:
Воробьев Антон Сергеевич — к.м.н., доцент, заместитель заведующего кафедрой кардиологии, ведущий научный сотрудник научно-образовательного центра Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; врач-кардиолог отдела госпитализации с телемедицинским центром БУ «Окружной кардиологический диспансер «Центр диагностики и сердечно-сосудистой хирургии»; 628416, Россия, г. Сургут, пр-т Ленина, д. 69/1; научный сотрудник лаборатории неотложной терапии НИИТПМ — филиала ИЦиГ СО РАН; 630089, Россия, г. Новосибирск, ул. Б. Богаткова, д. 175/1; ORCID iD 0000-0001-7014-2096
Урванцева Ирина Александровна — к.м.н., доцент, заведующая кафедрой кардиологии Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; главный врач БУ «Окружной кардиологический диспансер «Центр диагностики и сердечно-сосудистой хирургии»; 628416, Россия, г. Сургут, пр-т Ленина, д. 69/1; ORCID iD 0000-0002-5545-9826
Кашталап Василий Васильевич — д.м.н., профессор, заведующий отделом клинической кардиологии НИИ КПССЗ; 650002, Россия, г. Кемерово, б-р имени академика Л.С. Барбараша, д. 6; профессор кафедры кардиологии Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; ORCID iD 0000-0003-3729-616X
Коваленко Людмила Васильевна — д.м.н., профессор, заведующая кафедрой патофизиологии и общей патологии, директор Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; ORCID iD 0000-0002-0918-7129
Донников Максим Юрьевич — к.м.н., ведущий научный сотрудник научно-образовательного центра Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; ORCID iD 0000-0003-0120-4163
Гребенникова Валерия Евгеньевна — врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции БУ «Окружной кардиологический диспансер «Центр диагностики и сердечно-сосудистой хирургии»; 628416, Россия, г. Сургут, пр-т Ленина, д. 69/1; преподаватель кафедры кардиологии Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; ORCID iD 0000-0001-5952-3226
Николаев Константин Юрьевич — д.м.н., профессор, заведующий лабораторией неотложной терапии НИИТПМ — филиала ИЦиГ СО РАН; 630089, Россия, г. Новосибирск, ул. Б. Богаткова, д. 175/1; профессор кафедры кардиологии Медицинского института Сургутского государственного университета; 628412, Россия, г. Сургут, пр-т Ленина, д. 1; ORCID iD 0000-0003-4601-6203
Контактная информация: Воробьев Антон Сергеевич, e-mail: a.s.vorobyov@gmail.com
Источник финансирования: работа выполнена в рамках бюджетной темы «Изучение молекулярно-генетических и молекулярно-биологических механизмов развития распространенных терапевтических заболеваний в Сибири для совершенствования подходов к их ранней диагностике и профилактике», 2024-2028 гг. (FWNR-2024-0004).
Конфликт интересов отсутствует.
Статья поступила 11.12.2024.
Поступила после рецензирования 13.01.2025.
Принята в печать 05.02.2025.
About the authors:
Anton S. Vorob’yov — C. Sc. (Med.), Assistant Professor, Deputy Head of the Department of Cardiology, Leading Scientific Officer of the Scientific and Educational Center, Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; Cardiologist, Department of Hospitalization with a Telehealth Center, District Cardiological Dispensary Center for Diagnosis and Cardiovascular Surgery; 69/1, Lenin ave., Surgut, Tyumen Region, 628416, Russian Federation; Scientific Officer, Laboratory of Emergency Therapy, Research Institute for Therapy and Preventive Medicine — Branch of the Institute of Cytology and Genetics of the Siberian Branch of the RAS; 175/1, B. Bogatkov str., Novosibirsk, 630089, Russian Federation; ORCID iD 0000-0001-7014-2096
Irina A. Urvantseva — C. Sc. (Med.), Assistant Professor, Head of the Department of Cardiology, Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; Chief Physician of District Cardiological
Dispensary Center for Diagnosis and Cardiovascular Surgery; 69/1, Lenin ave., Surgut, 628416, Russian Federation; ORCID iD 0000-0002-5545-9826
Vasilyi V. Kashtalap — Dr. Sc. (Med.), Professor, Head of the Department of Clinical Cardiology, Research Institute for Complex Issues of Cardiovascular Diseases; 6, Academician L.S. Barbarash blvd., Kemerovo, 650002, Russian Federation; Professor, Department of Cardiology, Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; ORCID iD 0000-0003-3729-616X
Lyudmila V. Kovalenko — Dr. Sc. (Med.), Professor, Head of the Department of Pathophysiology and General Pathology, Director of the Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; ORCID iD 0000-0002-0918-7129
Maxim Yu. Donnikov — C. Sc. (Med.), Leading Scientific Officer of the Scientific and Educational Center, Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; ORCID iD 0000-0003-0120-4163
Valeriya E. Grebennikova — Cardiologist, Department of Surgical Treatment of Complex Cardiac Arrhythmias and Electrocardiostimulation, District Cardiological Dispensary Center for Diagnosis and Cardiovascular Surgery; 69/1, Lenin ave., Surgut, 628416, Russian Federation; Lecturer, Department of Cardiology, Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; ORCID iD 0000-0001-5952-3226
Konstantin Yu. Nikolaev — Dr. Sc. (Med.), Professor, Head of the Laboratory of Emergency Therapy, Research Institute for Therapy and Preventive Medicine — Branch of the Institute of Cytology and Genetics of the Siberian Branch of the RAS; 175/1, B. Bogatkov str., Novosibirsk, 630089, Russian Federation; Professor of the Department of Cardiology, Medical Institute, Surgut State University; 1, Lenin ave., Surgut, 628412, Russian Federation; ORCID iD 0000-0003-4601-6203
Contact information: Anton S. Vorob’yov, e-mail: a.s.vorobyov@gmail.com
The study is supported within the framework of the budget topic «Studying the molecular genetic and molecular biological mechanisms of the development of common therapeutic diseases in Siberia to improve approaches to their early diagnosis and prevention», 2024-2028 (FWNR-2024-0004).
There is no conflict of interest.
Received 11.12.2024.
Revised 13.01.2025.
Accepted 05.02.2025.
Информация с rmj.ru

