Введение
На сегодняшний день в российской клинической медицине широко используется термин «дисплазия соединительной ткани» (ДСТ) [1], от которого в конце XX в. отделился термин «наследственные нарушения соединительной ткани» [2]. Пациенты с признаками ДСТ наиболее часто обращаются по поводу болевых синдромов и функциональных расстройств к терапевту и ревматологу. В процессе обследования проводится дифференциальная диагностика синдрома гипермобильности суставов и ревматических заболеваний. Диагностика пациентов с признаками ДСТ может потребовать повторных лабораторно-инструментальных обследований в течение года, особенно при появлении новых симптомов, чтобы не пропустить возможные серологические маркеры ревматических заболеваний [3]. Ответственность за постановку правильного диагноза нередко ложится на плечи узкого специалиста — ревматолога.
Необходимо учитывать, что традиционные фенотипы пациентов с ДСТ могут включать пациентов не только с моногенными дефектами фибриллярных белков соединительной ткани, в частности фибриллина (синдром Марфана (СМ)) или коллагена разных типов (синдром Элерса — Данло (СЭД), несовершенный остеогенез, cutis laxa, синдром Альпорта, синдром Каффи) [4–6], но и с трансформирующими факторами роста соединительной ткани (синдром Луиса — Дитца) [7], а также цинк-зависимыми протеиназами (ADAMTS10) (синдром Вейла — Марчезани) [8]. Известны также перекрестные варианты моногенных болезней, когда формируется фенотип, похожий одновременно на СЭД и несовершенный остеогенез [9]. Каждый год описываются новые неизвестные генетические дефекты известных болезней [10]. К ДСТ относят также мультифакториальные синдромы: синдром гипермобильности суставов [11], синдром пролапса митрального клапана [12], синдром прямой спины [13], кифосколиоз [14], т. е. отдельные значимые проявления ДСТ, имеющие самостоятельное значение для жизни и прогноза пациента. Установление указанных фенотипов совершенно необходимо для дальнейшего прогресса в этой отрасли научных знаний.
Подразумевалось, что диагностика наследственных нарушений соединительной ткани будет происходить c помощью согласительных критериев, предложенных для СМ [15], СЭД [16], несовершенного остеогенеза [17], каждый из которых имеет от 4 до 13 подтипов, а также молекулярно-генетического анализа. Однако применение согласительных критериев достаточно трудоемко, и во время визита пациента в поликлинику к врачу-терапевту, ревматологу и даже генетику практически невозможно сличить фенотип пациента с имеющимися признаками каждого подтипа известных моногенных синдромов в связи с ограниченностью времени. Использование же молекулярно-генетического тестирования взрослого пациента не оплачивается из фонда обязательного медицинского страхования, а для большинства пациентов слишком дорого, поэтому также не проводится. Получается, что в подавляющем большинстве случаев используется термин ДСТ без возможности дифференциации.
Таким образом, из клинической практики и научно-исследовательских работ практически исчезли пациенты с диагнозами «синдром Марфана», «синдром Элерса — Данло», но появилось большое количество пациентов с недифференцированной ДСТ. Отсутствие стремления к клинической и молекулярно-генетической верификации ДСТ тормозит продуктивное развитие этой области научных знаний с анализом и осмыслением фактов в этом направлении.
Для иллюстрации инертности в постановке диагноза и привычных заблуждений врачей в отношении недифференцированной ДСТ приводим следующее клиническое наблюдение пациентки с хроническим болевым синдромом, установление у которой моногенного наследственного заболевания произошло в 65 лет, несмотря на то, что болела она с рождения, и в нескольких поколениях семьи были аналогичные больные родственники.
Содержание статьи
Клиническое наблюдение
Пациентка В., 65 лет. Направлена ревматологом на кафедру поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ Минздрава России для консультации в связи с выраженным хроническим болевым синдромом и невозможностью использования нестероидных противовоспалительных средств (НПВС) в связи с крапивницей и отеком Квинке на многие препараты. Жалобы на боль в ногах, усиливающуюся при ходьбе, боли в поясничном отделе позвоночника, боли в различных частях тела, усиливающиеся при небольшом надавливании, нарушения функции тазовых органов (задержка мочи при наполненном мочевом пузыре, постоянные запоры).
Анамнез morbi. Считает себя больной с рождения: родилась с дисплазией и двусторонним вывихом тазобедренных суставов. В 6 лет (1966 г.) проведена операция прямого вправления головок бедренных костей обоих тазобедренных суставов, наложен гипс, в котором находилась в течение 10 мес. Оперативное лечение вывиха суставов имело отрицательную динамику, в том числе из-за последующей обездвиженности в течение 10 мес.: невозможности передвижения из-за атрофии мышц и рецидива вывихов тазобедренных суставов. Определена инвалидность. В 1967 г. в связи с неудачными последствиями предыдущей операции проведена фиксация головок бедренных костей штифтами, а 1968 г. — удаление штифтов. Функция передвижения восстановлена частично: оставались боли и ограничения движения в тазобедренных суставах. В 2001 г. (41 год) в июне, а затем в ноябре были проведены операции эндопротезирования обоих тазобедренных суставов. Наблюдалась у терапевтов, ревматологов, неврологов, неоднократно консультирована различными специалистами, устанавливался диагноз «недифференцированная ДСТ» как фоновое заболевание. Однако, со слов пациентки, подчеркивалось, что инвалидизация и ее множественные болевые проблемы с ДСТ не связаны. Стойкий болевой синдром в ногах и позвоночнике, нарушение походки, тазовые нарушения беспокоили до настоящего времени, по поводу чего пациентка проходила курсы амбулаторного и стационарного лечения, постоянно наблюдалась у ревматолога и невролога.
Анамнез vitae. Туберкулез, наличие вируса иммунодефицита человека, гепатиты отрицает. Аллергологический анамнез отягощен: на лидокаин, пенициллины, цефалоспорины, витамины группы B, ингибиторы АПФ, β-адреноблокаторы, ибупрофен, диклофенак, нимесулид отмечает аллергию в виде крапивницы или отека Квинке. Выявлена сенсибилизация к домашней пыли, шерсти животных, лесной землянике.
Наблюдается по поводу гипертонической болезни у терапевта, получает антигипертензивные препараты верапамил по 40 мг 3 раза в день и лозартан 50 мг 1 раз в день с положительным эффектом.
Кроме указанных выше операций, отмечает следующие: в 1980 г. — по поводу послеродового мастита слева; в 2007 г. — герниопластика бедренной грыжи с осложнением — тромбоз бедренной вены; в 2007 г. — полипэктомия кишечника; в 2024 г. (август) — фундопликация по Ниссену при резистентной к лечению гастроэзофагеальной рефлюксной болезни (ГЭРБ). Отмечены низкоинтенсивные переломы костей предплечья при падениях с высоты собственного роста и переломы тел позвонков ретроспективно.
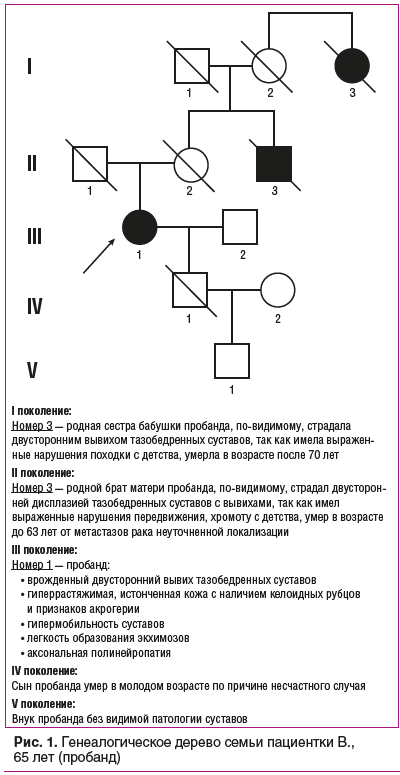
Семейный анамнез представлен на рисунке 1. Родной брат матери пробанда, по-видимому, страдал двусторонней дисплазией тазобедренных суставов с вывихами, так как имел выраженные нарушения передвижения, хромоту с детства, умер в возрасте до 63 лет от метастазов рака неуточненной локализации. Родная сестра бабушки по материнской линии, по-видимому, страдала двусторонним вывихом тазобедренных суставов, так как имела выраженные нарушения походки с детства, умерла в возрасте старше 70 лет. Сын пробанда не имел вывихов и дисплазии тазобедренных суставов, погиб в молодом возрасте (несчастный случай). Единственный внук пробанда (18 лет) не имеет видимой патологии суставов с нарушением походки.
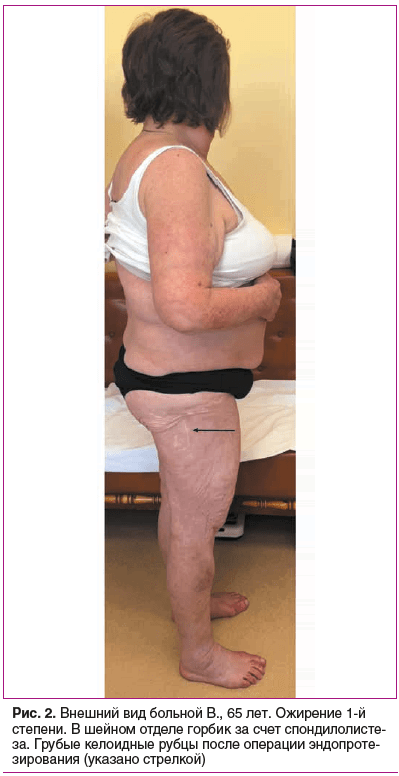
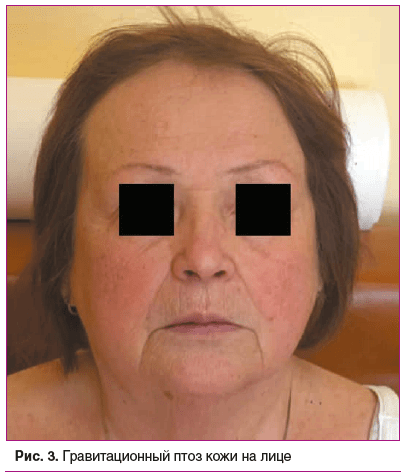
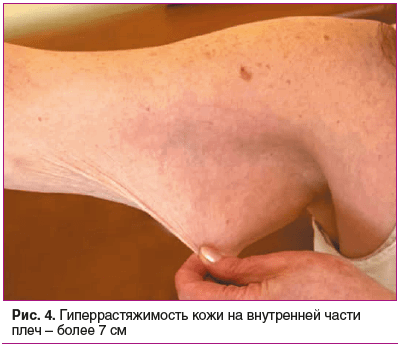
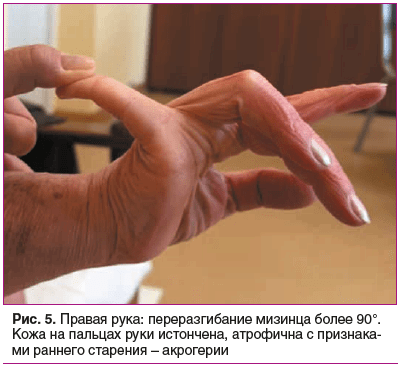
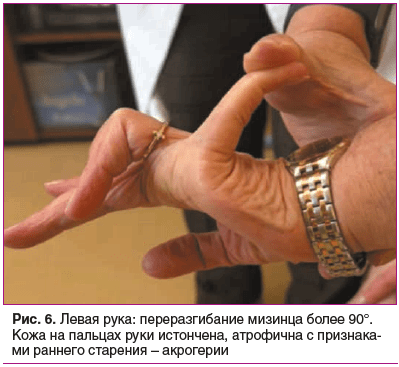
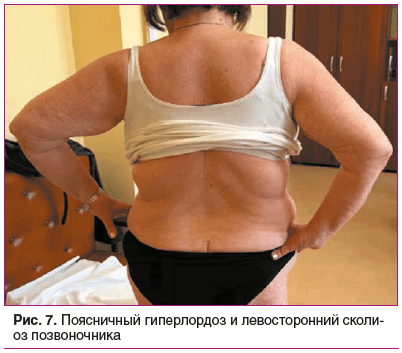
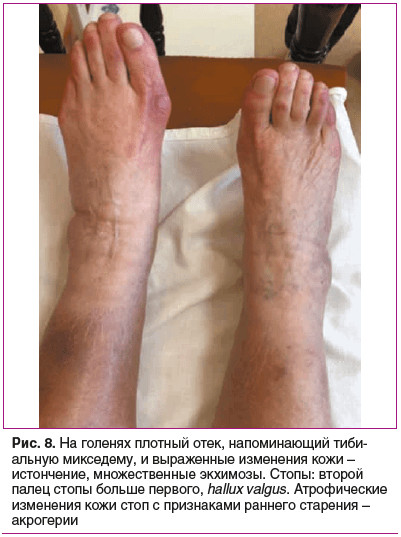
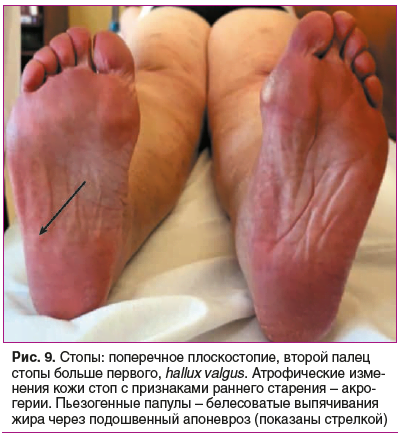
Status prаеsens. Состояние удовлетворительное, сознание ясное, положение активное (рис. 2). Рост 152,5 см, масса тела 76 кг, индекс массы тела (ИМТ) 32,9 кг/м2 (ожирение 1-й степени). Кожа бледно-розовая, умеренной влажности. Обращает внимание гиперрастяжимость и гравитационный птоз кожи на лице (рис. 3), на внутренней части плеч выраженный избыток кожи за счет гиперрастяжимости (рис. 4). На кистях кожа истонченная, сухая — признаки раннего старения (акрогерии) (рис. 5, 6). Лимфоузлы подчелюстные, подмышечные не пальпируются. Ограничение объема движений в тазобедренных суставах (эндопротезы). Послеоперационные рубцы после эндопротезирования келоидного типа с обеих сторон (см. рис. 2). Увеличение подвижности в мелких суставах кистей и средних суставах (локтевых), счет Бейтона — Хорана [1] 6 баллов (см. рис. 5, 6). Грудная клетка — килевидная деформация манубрио-стернального типа, эмфизематозная. В шейном отделе — горбик за счет спондилолистеза (см. рис. 2). Поясничный гиперлордоз и левосторонний сколиоз позвоночника (рис. 7). Дыхание везикулярное, равномерно ослабленное, хрипов нет. Тоны сердца приглушены, ритмичные, I тон на верхушке ослаблен, акцент II тона на аорте, на сосудах шеи шумов нет. Артериальное давление (АД) на правой руке 145/76 мм рт. ст., на левой руке — 142/65 мм рт. ст. (на фоне приема утром верапамила 40 мг и лозартана 50 мг). Пульс 62–66 в 1 мин. Живот при пальпации мягкий, безболезненный. Чувствительность при поколачивании в правом подреберье по сравнению с левым. Пальпируется подкожное мягко-эластическое образование — моллюскоподобная опухоль. На голенях плотный отек, напоминающий тибиальную микседему, и выраженные трофические изменения кожи — истончение, множественные экхимозы (рис. 8). На стопах отеков нет, истонченная складчатая кожа с признаками раннего старения (акрогерия), определяется поперечное плоскостопие, hallux valgus, в районе пяток пьезогенные папулы (рис. 9).
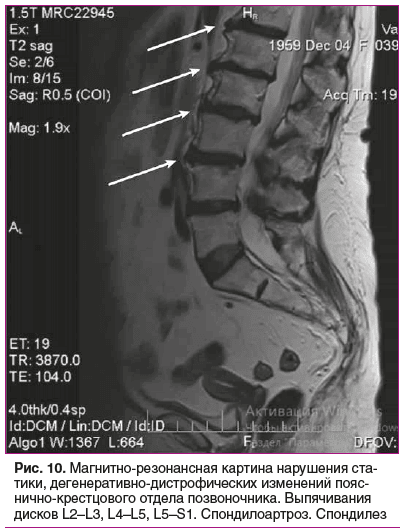
Данные инструментальных методов исследования. Магнитно-резонансная томография (МРТ) пояснично-крестцового отдела позвоночника (рис. 10): множественные протрузии межпозвонковых дисков в пояснично-крестцовом отделе позвоночника, заострения тел позвонков с краевыми костными разрастаниями по передней и боковым поверхностям тел L1-S1-позвонков. МР-картина нарушения статики, дегенеративно-дистрофических изменений пояснично-крестцового отдела позвоночника. Выпячивания дисков L2–L3, L4–L5, L5–S1. Спондилоартроз. Спондилез.
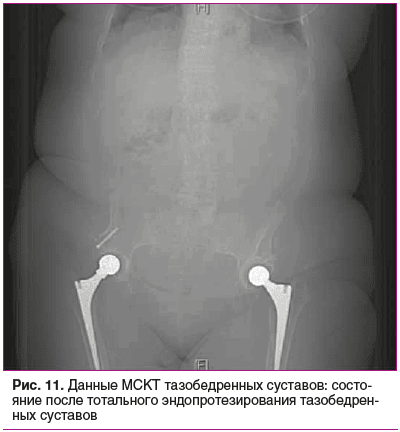
Мультиспиральная компьютерная томография (МСКТ) тазобедренных суставов (рис. 11): состояние после тотального эндопротезирования тазобедренных суставов.
Электронейромиография (ЭНМГ) нижних конечностей: признаки аксонального поражения моторных волокон малоберцового нерва с обеих сторон (с учетом сохранности проведения по сенсорным волокнам вероятен корешковый или спинальный уровень поражения). Получены признаки демиелинизирующего поражения моторных и сенсорных волокон нервов нижних конечностей по полиневральному типу. ЭНМГ верхних конечностей: признаки демиелинизирующего поражения сенсорных волокон локтевого нерва с обеих сторон в дистальных отделах.
Остеоденситометрия: остеопения — Т-критерий 1,7 в сочетании с переломами костей предплечий и позвонков.
В соответствии с критериями Международного консорциума 2017 г. [18] клинически установлены признаки (двусторонний врожденный вывих тазобедренных суставов, гиперрастяжимая, истонченная кожа с келоидными рубцами, признаки акрогерии, гипермобильность мелких и средних суставов, а также демиелинизирующее поражение нервов при ЭНМГ), свидетельствующие в пользу СЭД, возможно артрохалазийного типа или классически-подобного типа.
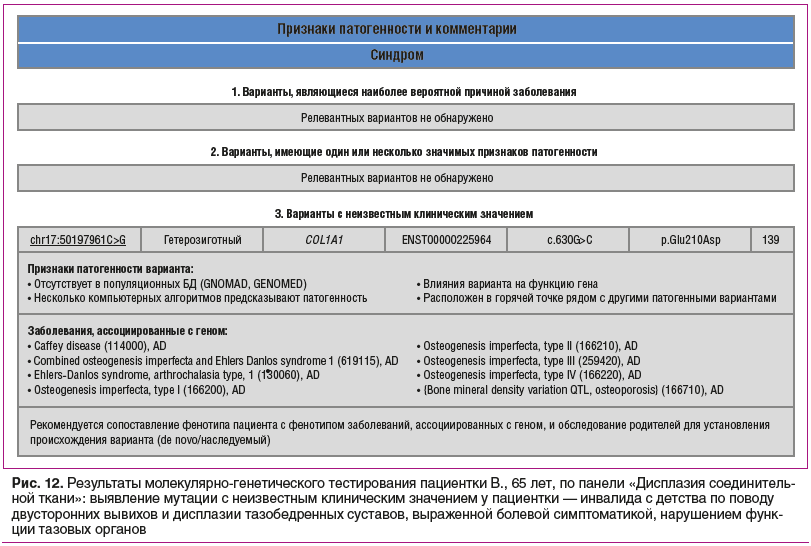
При молекулярно-генетическом обследовании с использованием панели «Заболевания соединительной ткани» (рис. 12) были обнаружены новые варианты мутаций в гене коллагена I типа А1 с неизвестными клиническими значениями патогенности, возможно, ассоциированными с болезнью Каффи (исключена клинически) или комбинация СЭД и несовершенного остеогенеза, или СЭД артрохалазийного типа. С учетом клинических данных наиболее вероятен СЭД артрохалазийного типа, так как этот тип, кроме вывихов тазобедренных суставов, сопровождается снижением минеральной плотности костей с возможными низкоинтенсивными переломами, а также аксональной нейропатией, имеющимися у пациентки [18]. Нарушения в системе гемостаза также характерны для пациентов с СЭД разных типов. Хронические болевые синдромы патогномоничны для СЭД и СМ [19].
Диагноз. Синдром Элерса — Данло артрохалазийного типа с врожденным двусторонним вывихом бедер и двусторонним эндопротезированием в 2001 г., двусторонним коксартрозом, R-стадия 4, функциональная недостаточность сустава III, дистальной аксональной и демие-линизирующей полинейропатией, легким тетрапарезом, гипермобильностью мелких и средних суставов (6 баллов по Бейтону — Хорану в 65 лет), гиперрастяжимостью, ранимостью, атрофией кожи на конечностях — акрогерией. Дегенеративно-дистрофические изменения пояснично-крестцового отдела позвоночника (L1-S1), множественные протрузии межпозвонковых дисков в пояснично-крестцовом отделе позвоночника L2–L3, L4–L5, L5–S1. Спондилоартроз. Спондилез. Хронический болевой синдром. Синдром хронической тазовой боли с нарушением функции тазовых органов (задержка мочеиспускания и дефекации при отсутствии рефлексов). Манубриостернальный тип килевидной деформации грудной клетки, гиперлордоз и сколиоз влево поясничного отдела позвоночника, поперечное плоскостопие, hallux valgus, рецидивирующая бедренная грыжа (герниопластика в 2007 г.), моллюскоподобная опухоль передней брюшной стенки, пьезогенные папулы пяток. Резистентная к терапии ГЭРБ, частично корригированная операцией фундопликации по Ниссену в 2024 г. Остеопения (Т-критерий 1,7), патологические переломы костей предплечья справа и тел позвонков. Тромбоцитопатия с нарушениями гемостаза (наклонность к геморрагиям и повторные тромбозы, спонтанные или после операций). Гипертоническая болезнь 2-й степени, I стадии, риск 3 (высокий). Целевой уровень АД не достигнут. Хроническая обструктивная болезнь легких. Ожирение 1-й степени (ИМТ 32,9 кг/м2). Множественная аллергия на лекарства (новокаин, лидокаин, витамины группы В, пенициллины, цефалоспорины, сульфаниламиды, ингибиторы АПФ, β-адреноблокаторы, ибупрофен) — крапивница или отек Квинке.
В связи с непереносимостью НПВС и невозможностью быстрого купирования болевых ощущений проведено информирование больной, предложены немедикаментозные средства для снижения массы тела за счет снижения калорийности питания, аэробной активности и силовых упражнений. Проведен подбор и разучивание ежедневной гимнастики, подбор стелек при поперечном плоскостопии, предложены ортезы на коленные суставы в моменты физической активности. Предложены методы гидротерапии в отделении реабилитации, плавание в бассейне, использование трости. Назначена патогенетическая терапия симптоматическими средствами замедленного действия (Symptomatic Slow Acting Drugs for Osteoarthritis — SYSADOA) препаратом хондроитина сульфата и глюкозамина [20]. По согласованию с ревматологом проведена терапия остеопороза золедроновой кислотой с положительным эффектом: снижение боли в поясничном отделе позвоночника через 1 мес. после введения. По поводу некорригированной артериальной гипертензии увеличена доза лозартана до 100 мг/сут, верапамил оставлен по 40 мг 3 раза в день. На последующих приемах АД в пределах 121–129/76–80 мм рт. ст.
На фоне приема препарата хондроитина сульфата и глюкозамина через 25 дней отмечено снижение болевых ощущений в ногах по визуально-аналоговой шкале с 6 до 4 баллов. Вероятнее всего, сочетанное применение золедроновой кислоты и хондропротекторов дало положительный результат. Проведена мотивация к длительному приему патогенетической терапии не менее 6 мес. в год.
Обсуждение
Настоящее клиническое наблюдение демонстрирует присущую пациентам с ДСТ элерсоподобного фенотипа полиморбидность, низкий порог болевой чувствительности с множественными хроническими болевыми синдромами и неповторяющееся сочетание клинических диспластических признаков, которое часто называют «фенотипической протяженностью». Необходимо отметить, что затушевывание своевременной диагностики термином «недифференцированная ДСТ» приводит к снижению возможности постановки правильного синдромального диагноза.
В каталоге наследственных болезней[1] СЭД артрохалазийного типа 1, обозначаемый аббревиатурой EDSARTH1, описан как вызываемый гетерозиготной мутацией в гене COL1A1 (120150) на хромосоме 17q21 [21, 22]. Известно, что несколько форм несовершенного остеогенеза, например OI1, 166200, также вызываются мутацией в гене COL1A1. Артрохалазийный тип отличается от других типов СЭД частотой врожденного вывиха бедра и выраженной подвижностью суставов с повторяющимися подвывихами и минимальными изменениями кожи [22]. Генетическая гетерогенность СЭД артрохалазийного типа EDSARTH2 (617821), вызванная мутацией в гене COL1A2 (120160), описана в нескольких клинических наблюдениях с подтверждением генетического дефекта, эти исследования представлены в каталоге OMIM [21, 22]. Однако мутации, полученной в ходе генетического анализа у нашей пациентки, ранее описано не было, по данным каталога OMIM. Генетическая лаборатория, проводившая исследование, также не обнаружила указанной мутации в популяционных базах GNOMAD и GENOMED (рис. 12).
Необходимость тщательного клинического обследования и наблюдения пациента с признаками ДСТ и свое-временной верификацией генетического дефекта синтеза коллагена I типа дает возможность предсказать инвалидизирующие или фатальные осложнения и, возможно, предотвратить их.
Заключение
Клиническое наблюдение семьи с СЭД артрохалазийного типа иллюстрирует типичные клинические диспластические признаки, приводящие к инвалидизации, что само по себе должно исключать диагноз «недифференцированной ДСТ», и требует от врачей первичного звена, особенно ревматологов, осведомленности о необходимости тщательного поиска причин полиморбидности и низкого порога болевой чувствительности с множественными болевыми жалобами, а также о возможностях современной патогенетической терапии болевых синдромов у пациентов с элерсоподобным фенотипом.
[1] OMIM®. An Online Catalog of Human Genes and Genetic Disorders.2025. (Electronic resource.) URL: https://www.omim.org/ (access date: 14.07.2025).
Информация с rmj.ru




