Ключевые слова: сахарный диабет 2 типа, тестостерон, заместительная терапия, метаболический синдром, инсулинорезистентность, Андрогель.
Для цитирования: Демидова Т.Ю., Скуридина Д.В. Роль заместительной терапии тестостероном при сахарном диабете 2 типа // РМЖ. 2018. №11(II). С. 110-115
Содержание статьи
- 1 Role of testosterone replacement therapy in type 2 diabetes mellitus
- 2 Введение
- 3 Этиология гипогонадизма при сахарном диабете 2 типа
- 4 Диагностика и дифференциальная диагностика гипогонадизма при СД 2 типа
- 5 Заместительная терапия тестостероном
- 6 Тактика назначения ТЗТ у пациентов с СД 2 типа
- 7 Мониторинг при ТЗТ у пациентов с СД 2 типа
- 8 Заключение
Role of testosterone replacement therapy in type 2 diabetes mellitus
T.Yu. Demidova, D.V. Skuridina
Pirogov Russian National Research Medical University, Moscow
As the large-scale Russian epidemiological study NATION has shown, the actual number of patients with type 2 diabetes mellitus (DM2) in Russia is at least 8–9 million people (about 6% of the population). Hypogonadism in men is a clinical and biochemical syndrome associated with a low level of testosterone, as well as insensitivity of the receptor apparatus to androgens. It was shown that testosterone levels in men with DM2 are lower than in healthy people by an average of 2.5 nmol/L, and the prevalence of hypogonadism DM2 patients is higher than in the general population by 50%. Therefore, it is now recommended for all patients with DM2 and obesity to determine the level of testosterone and to decide on the appointment of testosterone replacement therapy (TRT), one of the modern representatives of which is gel Androgel. Since testosterone takes an active part in the regulation of fat and carbohydrate metabolism, the question of improving the parameters of carbohydrate and fat metabolism against the background of TRT in men with DM2 and confirmed hypogonadism remains topical.
Key words: type 2 diabetes, testosterone, substitution therapy, metabolic syndrome, insulin resistance, Androgel.
For citation: Demidova T.Yu., Skuridina D.V. Role of testosterone replacement therapy in type 2 diabetes mellitus // RMJ. 2018. № 11(II). P. 110–115.
В статье рассмотрены возможности заместительной терапии тестостероном при сахарном диабете 2 типа. Показано, что всем пациентам с СД 2 типа и ожирением рекомендуется определять уровень тестостерона и решать вопрос о назначении тестостерон-заместительной терапии
Введение
Сахарный диабет (СД) 2 типа — нарушение углеводного обмена, вызванное преимущественно инсулинорезистентностью и относительной инсулиновой недостаточностью или преимущественным нарушением секреции инсулина с инсулинорезистентностью или без нее. Как показало масштабное российское эпидемиологическое исследование NATION, реальная численность пациентов с СД 2 типа в РФ составляет не менее 8–9 млн человек (около 6% населения). Гипогонадизм у мужчин — это клинический и биохимический синдром, связанный с низким уровнем тестостерона, а также нечувствительностью рецепторного аппарата к андрогенам. Было показано, что показатели тестостерона у мужчин с СД 2 типа ниже, чем у здоровых, в среднем на 2,5 нмоль/л, а распространенность гипогонадизма при СД 2 типа выше, чем в общей популяции, на 50% [1].
СД 2 типа в подавляющем большинстве случаев развивается у лиц среднего и пожилого возраста. В процессе старения физиологически снижается и уровень тестостерона, что может быть ассоциировано с развитием СД 2 типа [2, 3]. Установлено, что у мужчин с гипогонадизмом часто отмечается метаболический синдром, компонентами которого являются абдоминальное (висцеральное) ожирение, артериальная гипертензия, дислипидемия, инсулинорезистентность и нарушение углеводного обмена [4, 5]. При этом само по себе висцеральное ожирение, так часто сопутствующее пациентам с СД 2 типа,
может приводить к снижению уровня тестостерона [6]. Таким образом, на фоне уже имеющегося СД 2 типа нередко развивается гипогонадизм.
Этиология гипогонадизма при сахарном диабете 2 типа
Различают первичный (гипергонадотропный) и вторичный (гипогонадотропный) гипогонадизм. Первичный обусловлен изменениями в яичках, а вторичный — нарушением гонадотропин-продуцирующей функции гипофиза. Для мужчин с СД 2 типа характерно развитие смешанного гипогонадизма, при котором нарушаются механизмы отрицательной обратной связи между выработкой тестостерона в яичках и гонадотропинов в гипофизе [1, 7]. У пациентов с СД 2 типа наблюдаются снижение пула клеток Лейдига и их чувствительности к гонадотропинам в яичках, ишемические тестикулярные изменения, уменьшение выброса лютеинизирующего гормона (ЛГ), увеличение активности ароматазы жировой ткани. Таким образом, при СД 2 типа присутствуют компоненты как первичного, так и вторичного гипогонадизма [8]. Однако важно отметить, что гипогонадизм, развивающийся на фоне метаболических нарушений, потенциально обратим при их устранении, в отличие от истинно первичных и вторичных форм [9, 10].
Диагностика и дифференциальная диагностика гипогонадизма при СД 2 типа
Гипогонадизм подтверждается при выявлении клинических симптомов, обусловленных дефицитом андрогенов в организме, в сочетании со стойким снижением уровня тестостерона (необходим как минимум двукратный анализ) [7, 11, 12]. Но клинические признаки гипогонадизма при СД 2 типа могут быть скрыты по причине физиологической фенотипической вариабельности. Частота возникновения большинства симптомов возрастает по мере снижения уровня тестостерона [7, 13]. Клиническими симптомами гипогонадизма могут быть: снижение либидо и эректильной функции, мужское бесплодие, гинекомастия, перепады настроения, повышенная утомляемость и раздражительность, нарушения сна, потеря жизненной энергии, приливы, снижение когнитивных способностей, переломы при небольшой травме вследствие остеопороза, уменьшение безжирового компонента массы тела и мышечной силы, висцеральное ожирение, метаболический синдром [1]. Безусловно, эти симптомы довольно неспецифичны, и большинством авторов рекомендуется ориентироваться на 3 основных признака: снижение либидо и сексуальной активности, снижение числа утренних эрекций и снижение адекватных эрекций [7, 14–16].
При этом необходимо исключить развитие данных симптомов по причине других сопутствующих заболеваний или приема лекарственных препаратов (например, неселективных бета-адреноблокаторов, антагонистов альдостерона) [7]. Сама по себе декомпенсация углеводного обмена в ряде случаев приводит к снижению уровня тестостерона [17]. Поэтому, решая вопрос о необходимости ТЗТ, следует проводить коррекцию противодиабетической терапии, направленную на достижение целевых показателей углеводного обмена. В то же время ряд зарубежных и отечественных исследований показывает, что коррекция дефицита тестостерона при СД позволяет быстрее достичь целевых уровней гликированного гемоглобина на фоне проведения стандартной терапии СД [18–21].
Следует помнить, что на фоне СД наряду с гипогонадизмом причинами нарушения половой функции могут являться нейропатия и васкулопатия, а снижение либидо может быть психогенным [22]. Таким образом, при диагностике гипогонадизма пациент с СД 2 типа должен быть обследован командой специалистов: эндокринологом, урологом, кардиологом, терапевтом и психологом [10, 22].
Лабораторная диагностика гипогонадизма включает в себя определение в крови уровня общего тестостерона, ЛГ, тиреотропного гормона (ТТГ) и пролактина. Пороговым значением, разделяющим нормальное состояние и потенциальный дефицит тестостерона, рекомендуется считать 12,1 нмоль/л для общего тестостерона в сыворотке крови [7]. При уровне общего тестостерона от 8 до 12 нмоль/л целесообразно определить уровень глобулина, связывающего половые стероиды, и альбумина сыворотки, с последующим расчетом уровня свободного тестостерона, нижняя граница нормы которого составляет 225–250 пмоль/л, но большинство авторов предлагают 243 пмоль/л. Определение сывороточного уровня ЛГ имеет значение для дифференциации первичной и вторичной форм гипогонадизма, а также выявления его субклинической формы [7]. Определение уровня пролактина и ТТГ в сыворотке крови необходимо, поскольку клиническая картина гиперпролактинемии и гипотиреоза может частично совпадать с проявлениями гипогонадизма при СД 2 типа [23, 24].
Физикальное обследование на момент диагностики и в динамике включает в себя оценку индекса массы тела, окружности талии, роста волос на теле, грудных желез и органов мошонки, размеров и консистенции яичек при помощи орхидометра или УЗИ, обследование полового члена и предстательной железы [7, 10].
Заместительная терапия тестостероном
По данным А. Haider et al. и ряда других исследователей, ТЗТ у мужчин, имеющих гипогонадизм, предиабет и дислипидемию, улучшала показатели углеводного и липидного спектра крови, снижала инсулинорезистентность и висцеральное ожирение, что сопровождалось снижением сердечно-сосудистых рисков [34–37]. F. Strollo et al. показали, что восстановление уровня тестостерона до физиологического у пожилых мужчин с возрастным гипогонадизмом, имеющих ожирение и нарушение гликемии натощак, приводит к улучшению соматических и метаболических показателей [34]. Целый ряд исследований продемонстрировал улучшение компенсации СД 2 типа на фоне терапии препаратами тестостерона, что подтверждалось снижением уровня гликированного гемоглобина и показателей инсулинорезистентности [38–40]. Так, в исследовании TIMES
с использованием трансдермального геля тестостерона у 220 мужчин с гипогонадизмом и СД 2 типа и/или метаболическим синдромом в течение 12 мес. было показано снижение индекса HOMA-IR на 15,2% уже через 6 мес. К 9-му мес. наблюдения у пациентов с диабетом уровень гликированного гемоглобина (HbA1c) был ниже в среднем на 0,46% по сравнению с таковым в группе плацебо. В группе пациентов с метаболическим синдромом ТЗТ привела к достоверно более выраженному снижению от исходных значений уровней общего холестерина и холестерина липопротеинов низкой плотности (ЛПНП), чем плацебо. При этом между группами не было зафиксировано значимых различий по частоте нежелательных явлений, большинство были легкими или умеренными. Таким образом, терапия короткодействующим тестостероном продемонстрировала благоприятные эффекты в отношении инсулинорезистентности и дислипидемии у пациентов с метаболическим синдромом и/или СД [40].
Метаанализ K.-J. Wang et al. 2014 г. включил 5 рандомизированных контролируемых исследований, посвященных изучению показателей глюкозы, липидов и содержанию жировой ткани. В исследованиях принимал участие всего 351 человек, а средняя продолжительность наблюдения составила 6,5 мес. Авторы продемонстрировали, что применение тестостерона приводило к снижению уровня глюкозы в плазме и инсулина сыворотки натощак, уровня HbA1c в среднем на 0,87%, триглицеридов — на 0,35%. Данный метаанализ показал, что ТЗТ может улучшать показатели гликемического контроля и снижать уровни триглицеридов у мужчин с гипогонадизмом и СД 2 типа [41].
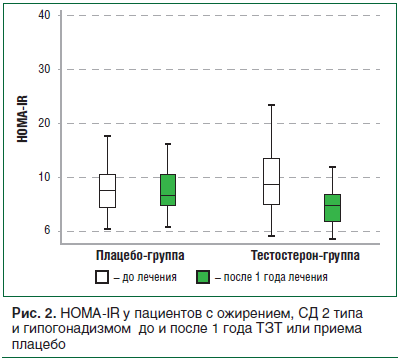
По данным двойного слепого рандомизированного плацебо-контролируемого клинического исследования 50 мужчин (40–70 лет с СД 2 типа, ожирением
и гипогонадизмом), применение ундеканоата тестостерона (по 1000 мг в/м каждые 10 нед.) через 12 мес. привело к снижению HOMA-IR на 4,64±4,25 (p
HbA1c — на 0,94±0,88% (p
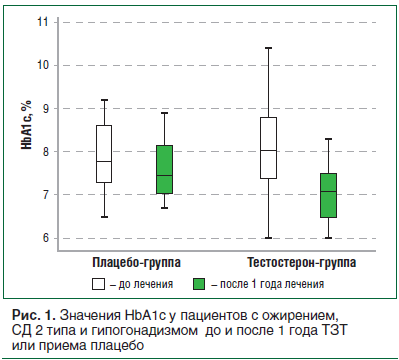
Кроме того, оценка эндотелия сосудов методом поток-опосредованной дилатации (FMD) показала увеличение FMD на 2,40±4,16% (p=0,005), что свидетельствовало об улучшении эндотелиальной функции на фоне ТЗТ (рис. 3) [42].
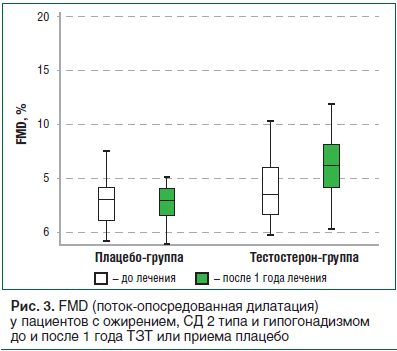
Но необходимо отметить, что применение инъекционных (масляных) форм тестостерона может приводить к супрафизиологическим пикам и резким колебаниям в настроении и либидо, а при СД увеличивает риск развития местных инфекционных осложнений. Кроме того, в отношении тестостерона ундеканоата зарегистрированы единичные эпизоды тромбоэмболии мелких ветвей легочной артерии непосредственно после инъекции [7].
Возвращаясь к положительным эффектам терапии тестостероном, важно отметить, что ТЗТ достоверно улучшает либидо, эректильную функцию и ответ на терапию ингибиторами фосфодиэстеразы 5-го типа, которые часто применяются при лечении эректильной дисфункции на фоне СД [43, 44].
Таким образом, важная роль терапии тестостероном при СД 2 типа и необходимость ее своевременного назначения неоспоримы, однако необходимо оценить наличие противопоказаний и рассмотреть возможные варианты лечения, их преимущества и недостатки.
Тактика назначения ТЗТ у пациентов с СД 2 типа
Безусловно, всем пациентам с СД 2 типа должна быть назначена комплексная терапия для достижения целевых показателей гликемии, артериального давления и липидного профиля. При выраженной декомпенсации углеводного обмена возможно транзиторное снижение уровня тестостерона, поэтому необходима его повторная оценка после нормализации гликемии [17]. Однако в литературе не представлены четкие данные, демонстрирующие конкретный уровень HbA1c, при котором необходимо сначала приступить к коррекции углеводного обмена, и только при достижении целевого уровня этого показателя оценивать андрогенный статус мужчины и при необходимости проводить лечение гипогонадизма. По мнению ряда российских экспертов, у пациента с СД и гипогонадизмом (за исключением случаев гипергонадотропного гипогонадизма) при уровне гликированного гемоглобина более 8% следует сначала достичь нормализации углеводного обмена и индивидуальных целевых значений гликемии, а далее провести повторную диагностику гипогонадизма [1]. При значениях гликированного гемоглобина более 8%, как известно, требуются незамедлительная интенсификация лечения, назначение комбинированных противодиабетических препаратов, у многих обсуждается перевод на инсулинотерапию, что потребует подбора адекватных доз и режимов. Кроме того, при столь выраженной гипергликемии ухудшается функция многих органов-мишеней, могут стремительно прогрессировать осложнения на уровне сердца и почек, что также потребует первоочередного вмешательства [2].
При подтверждении гипогонадизма цели его лечения — восстановление нормального физиологического уровня тестостерона и облегчение клинических симптомов (улучшение качества жизни, самочувствия, сексуальной функции), более того, снижение жировой массы тела, улучшение показателей углеводного обмена [45]. Тактика лечения и выбор андрогенной терапии определяются формой заболевания, наличием факторов риска и планами пациента на рождение детей. При желании пациента иметь детей терапия тестостероном не рассматривается, и пациент должен быть направлен на репродуктивную реабилитацию к урологу-андрологу.
При отсутствии необходимости в сохранении репродуктивной функции ТЗТ при отсутствии противопоказаний считается безопасной и эффективной [10]. Перечень противопоказаний к терапии тестостероном (представленный в рекомендациях Российской ассоциации эндокринологов):
рак предстательной железы;
рак грудной железы у мужчин;
необходимость репродуктивной реабилитации;
гематокрит >54%;
тяжелая хроническая сердечная недостаточность класса IV по классификации Нью- Йоркской кардиологической ассоциации (NYHA).
Существующие в мире препараты тестостерона различаются по способу введения и фармакокинетическим особенностям (табл. 1).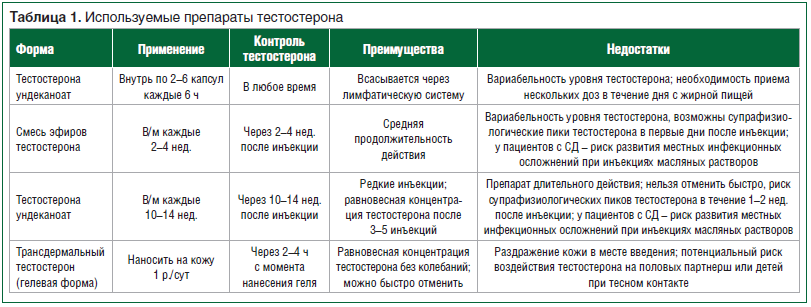
Подбор конкретного препарата должен осуществляться врачом и пациентом совместно. На этапе инициации терапии у пациентов с СД большинство авторов рекомендуют отдать предпочтение препаратам короткого действия (трансдермальный гель, например, Андрогель), что позволяет при развитии любых нежелательных симптомов сразу же приостановить лечение. Кроме того, назначение короткодействующих препаратов тестостерона с подбором индивидуальной дозы может рассматриваться у пациентов с СД и в случае невозможности добиться целевых показателей гликемии, поскольку именно короткодействующие формы максимально позволяют сохранить циркадный физиологический ритм секреции тестостерона и тем самым свести к минимуму риск подавления гонадотропной функции гипофиза и сперматогенеза [1].
В период лечения рекомендуется осуществлять периодический контроль концентрации тестостерона в сыворотке крови с целью минимизации побочных эффектов, связанных с лечением. Данных об определении целевого уровня сывороточного тестостерона на фоне ТЗТ пока недостаточно. Эксперты рекомендуют восстанавливать уровень тестостерона до средненормальных значений, что, как правило, бывает достаточным для нивелирования различных клинических проявлений андрогенного дефицита [7]. При этом следует избегать супрафизиологических значений тестостерона в крови, особенно у людей пожилого и старческого возраста с сопутствующей патологией. Оптимальная схема мониторинга сывороточного уровня тестостерона зависит от используемой лекарственной формы [10].
Важно отметить, что пожилой возраст пациента не является противопоказанием к началу терапии препаратами тестостерона, и лечение может проводиться пожизненно [1]. Терапия тестостероном сама по себе не повышает риск развития рака предстательной железы и рака грудной железы [46, 47]. Кроме того, в настоящее время отсутствуют и доказательства того, что препараты тестостерона увеличивают риск доброкачественной гиперплазии простаты и/или способствуют ухудшению нарушенного мочеиспускания [27]. По данным G. Corona et al., метаанализ плацебо-контролируемых рандомизированных клинических исследований эффектов тестостерона в отношении сердечно-сосудистой системы с участием почти 5500 пациентов не выявил увеличение риска развития сердечно-сосудистых заболеваний (ССЗ) на фоне терапии тестостероном [48].
Другой метаанализ (Fernández-Balsells M.M. et al.) показал более высокую частоту высокого гематокрита на фоне лечения тестостероном, но без каких-либо клинически неблагоприятных событий [49]. Наблюдательное исследование RHYME (Реестр гипогонадизма у мужчин), проведенное в 6 европейских странах у мужчин с гипогонадизмом в течение 2 лет, показало, что риск кардиоваскулярных событий у пациентов на фоне ТЗТ не превышал таковой у пациентов, не получавших лечение [50]. При этом пациенты с эритроцитозом и тяжелой сердечной недостаточностью (СН) (класс III–IV по NYHA) относятся к группе крайне высокого риска осложнений со стороны сердечно-сосудистой системы, поэтому терапия препаратами тестостерона у них может быть инициирована только после разрешения застойной СН [7].
Пациенты с СД 2 типа в подавляющем большинстве случаев имеют крайне высокий сердечно-сосудистый риск, особенно лица пожилого и старческого возраста. Поэтому ряд экспертов рекомендует отдавать предпочтение препаратам именно короткого действия перед препаратами длительного [1].
Мониторинг при ТЗТ у пациентов с СД 2 типа
Контрольное обследование пациентов после назначения тестостерона осуществляется каждые 3 мес. в течение 1-го года, далее — ежегодно (табл. 2).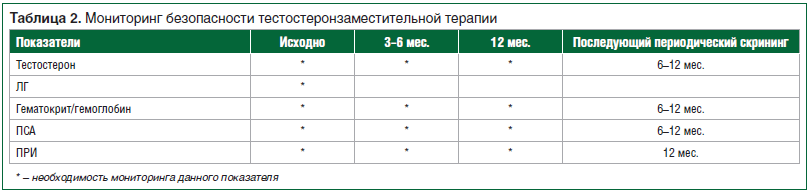
Рекомендуются контроль уровня тестостерона, показателей гематокрита/гемоглобина, уровня простатического специфического антигена (ПСА) и проведение пальцевого ректального исследования (ПРИ) [1].
Для оценки клинических симптомов и качества жизни в динамике, а также для мониторинга эффективности проводимого лечения могут использоваться опросники симптомов дефицита андрогенов (например, AMS) [7, 10]. Как правило, улучшение либидо может возникать уже через
3 нед. лечения, стойкий эффект (или фаза плато) достигается обычно на 6-й нед. Для положительной динамики эректильной и эякуляторной функции может понадобиться до полугода, мышечной силы и имеющегося остеопороза — до 1 года. Показатели углеводного обмена улучшаются в период от 3 до 12 мес. [27].
При возникновении эритроцитоза (повышение гематокрита >54%) следует проводить коррекцию терапии [1, 7].
Предварительно необходимо убедиться в достаточном потреблении жидкости пациентом. В случаях использования трансдермальной формы тестостерона снижение дозы препарата, как правило, бывает достаточным, а при использовании инъекционных форм возможна их замена на трансдермальную форму либо отмена с дальнейшей оценкой гематокрита через 3 мес., за которые обычно происходит их нормализация [1, 7].
При обнаружении новых пальпируемых образований в простате при ПРИ или при повышении уровня ПСА на 1,4 нг/мл и более от исходного значения необходимо применять дополнительные методы исследования предстательной железы (УЗИ, биопсия) [1, 7]. При отрицательных результатах биопсии в отношении злокачественного процесса терапию тестостероном можно продолжить.
При отсутствии макрососудистых осложнений проведение ЭКГ и консультация кардиолога показаны, как и всем пациентам с СД 2 типа, не реже 1 раза в год. При уже имеющихся ССЗ пациенты должны быть обследованы кардиологом до начала лечения, а на протяжении всего периода ТЗТ необходим тщательный мониторинг состояния сердечно-сосудистой системы [1, 7]. В то же время в нескольких десятках исследований представлены убедительные доказательные данные, свидетельствующие в пользу увеличения риска сердечно-сосудистых осложнений и атеросклероза при снижении уровня тестостерона, а также в пользу снижения сердечно-сосудистого риска на фоне ТЗТ [51].
Заключение
У мужчин с гипогонадизмом ТЗТ оказывает благоприятное влияние на снижение жировой массы тела, улучшает гликемический и липидный профиль. Однако не следует рассматривать назначение тестостерона как основное средство лечения СД и ССЗ. Успешная нормализация массы тела в сочетании с оптимизацией гликемического контроля — это первостепенный подход с целью нормализации уровня тестостерона у пациентов с СД 2 типа и ожирением. К сожалению, не всегда такой подход оказывается достаточным, и в настоящее время нет убедительных данных о возможности полного восстановления уровня тестостерона даже на фоне нормализации массы тела и гликемии. Таким образом, андрогенная терапия, одним из современных препаратов для которой является гель Андрогель, при отсутствии противопоказаний абсолютно рекомендована пациентам с СД 2 типа и подтвержденным гипогонадизмом.
Литература
1. Дедов И. И., Мельниченко Г. А., Шестакова М. В. и др. Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин с сахарным диабетом // Ожирение и метаболизм. 2017. Т. 14, № . 4. C. 87 [Dedov I. I. Mel’nichenko G.A., Shestakova M. V. i dr. Rekomendacii po diagnostike i lecheniyu deficita testosterona (gipogonadizma) u muzhchin s saharnym diabetom // Ozhirenie i metabolizm. 2017. T. 14, № 4. S. 87 (in Russain)].
2. Дедов И. И., Шестакова М. В., Майоров А. Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом // Сахарный диабет. 2017. Т. 20. № 1S. C. 1–121 [Dedov I.I., Shestakova M. V., Mayorov A. Y. i dr. Algoritmy specializirovannoj medicinskoj pomoshchi bol’nym saharnym diabetom // Saharnyj diabet. 2017. T. 20. № 1S. S. 1–121 (in Russian)]. DOI: 10.14341/DM20171S8.
3. Trinick T. R., Feneley M. R., Welford H., Carruthers M. International web survey shows high prevalence of symptomatic testosterone deficiency in men // The Aging Male. 2010. Vol. 14 (1). P. 10–15. DOI: 10.3109/13685538.2010.511325.
4. Tan W. S., Ng C. J., Khoo Е.-М. et al. The triad of erectile dysfunction, testosterone deficiency syndrome and metabolic syndrome: findings from a multi-ethnic Asian men study (The Subang Men’s Health Study) // The Aging Male. 2011. Vol. 14 (4). P. 231–236. DOI: 10.3109/13685538.2011.597463.
5. Tsujimura A., Miyagawa Y., Takezawa K. et al. Is Low Testosterone Concentration a Risk Factor for Metabolic Syndrome in Healthy Middle-aged Men? // Urology. 2013. Vol. 82 (4). P. 814–819. DOI: 10.1016/j.urology.2013.06.023.
6. Antonio L., Wu F. C.W., O’Neill T.W. et al. Associations Between Sex Steroids and the Development of Metabolic Syndrome: A Longitudinal Study in European Men // J. Clin. Endocr. Metab. 2015. Vol. 100 (4). P. 1396–1404. DOI: 10.1210/jc.2014–4184.
7. Bhasin S., Brito J. P., Cunningham G. R. et al. Testosteronetherapy in men with hypogonadism: an Endocrinesociety clinical practice guideline // J. Clin. Endocrinol. Metab. 2018. Vol. 103. P. 1–30.
8. Kumar M., Dutta D., Anne B. et al. Testosterone levels and type 2 diabetes in men: current knowledge and clinical implications // Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 2014. Vol. 481. DOI: 10.2147/dmso.s50777.
9. Дедов И. И., Мельниченко Г. А., Роживанов Р. В., Курбатов Д. Г. Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин. Проект // Проблемы эндокринологии. 2015. Т. 61, № 5. C. 60–71 [Dedov I.I., Mel’nichenko G.A., Rozhivanov R. V., Kurbatov D. G. Rekomendacii po diagnostike i lecheniyu deficita testosterona (gipogonadizma) u muzhchin. Proekt // Problemy ehndokrinologii. 2015. T. 61, № 5. S. 60–71 (in Russian)]. DOI: 10.14341/probl201561560–71.
10. Дедов И. И., Мельниченко Г. А., Роживанов Р. В., Курбатов Д. Г. Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин // Проблемы эндокринологии. 2016. Т. 62, № 6. С. 78–80 [Dedov I.I., Melnichenko G. A., Rozhivanov R. V., Kurbatov D. G. Rekomendacii po diagnostike i lecheniyu deficita testosterona (gipogonadizma) u muzhchin // Problemy ehndokrinologii. 2016. T. 62, № 6. S. 78–80 (in Russian)]. DOI: 10.14341/probl201662678–80.
11. Rosner W., Vesper H. Toward Excellence in Testosterone Testing: A Consensus Statement // J. Clin. Endocr. Metab. 2010. Vol. 95 (10). P. 4542–4548. DOI: 10.1210/jc.2010–1314.
12. Bhasin S., Pencina M., Jasuja G. K. et al. Reference Ranges for Testosterone in Men Generated Using Liquid Chromatography Tandem Mass Spectrometry in a Community-Based Sample of Healthy Nonobese Young Men in the Framingham Heart Study and Applied to Three Geographically Distinct Cohorts // J. Clin. Endocr. Metab. 2011. Vol. 96 (8). P. 2430–2439. DOI: 10.1210/jc.2010–3012.
13. Zitzmann M., Faber S., Nieschlag E. Association of Specific Symptoms and Metabolic Risks with Serum Testosterone in Older Men // J. Clin. Endocr. Metab. 2006. Vol. 91 (11). P. 4335–4343. DOI: 10.1210/jc.2006–0401.
14. Wu F. C.W., Tajar A., Beynon J. M. et al. Identification of Late-Onset Hypogonadism in Middle-Aged and Elderly Men // N. Engl. J. Med. 2010. Vol. 363 (2). P. 123–135. DOI: 10.1056/NEJMoa0911101.
15. Lejeune H., Huyghe É., Droupy S. Diminution du désir sexuel et déficit en testosterone chez l’homme // Prog. Urol. 2013. Vol. 23 (9). P. 621–628. DOI: 10.1016/j.purol.2013.01.019.
16. Lunenfeld B., Arver S., Moncada I. et al. How to help the aging male? Current approaches to hypogonadism in primary care // The Aging Male. 2012. Vol. 15 (4). P. 187–197. DOI: 10.3109/13685538.2012.729110.
17. Ho C.-H., Jaw F.-S., Wu C.-C. et al. The Prevalence and the Risk Factors of Testosterone Deficiency in Newly Diagnosed and Previously Known Type 2 Diabetic Men // The Journal of Sexual Medicine. 2015. Vol. 12 (2). P. 389–397. DOI: 10.1111/jsm.12777.
18. Heufelder A. E., Saad F., Bunck M. C., Gooren L. Fifty‐two — Week Treatment With Diet and Exercise Plus Transdermal Testosterone Reverses the Metabolic Syndrome and Improves Glycemic Control in Men With Newly Diagnosed Type 2 Diabetes and Subnormal Plasma Testosterone // Journal of Andrology. 2009. Vol. 30 (6). P. 726–733.
19. Тестостерон — от сексуальности к метаболическому контролю / под ред. Когана М. И., Воробьева С. В., Хрипуна И. А. и др. Ростов-на-Дону: Феникс. 2017. 239 с. [Testosteron — ot seksual’nosti k metabolicheskomu kontrolju / pod red. Kogana M. I., Vorob’eva S.V., Hripuna I. A. i dr. Rostov-na-Donu: Feniks. 2017. 239 s. (in Russian)].
20. UK Prospective Diabetes Study (UKPDS) // Lancet. 1998. Vol. 352 (9131). Р. 837–853.
21. Francomano D., Ilacqua A., Bruzziches R. et al. Effects of 5-year treatment with testosterone undecanoate on lower urinary tract symptoms in obese men with hypogonadism and metabolic syndrome // Urology. 2014. Vol. 83 (1). P. 167–174.
22. Урологические и андрологические заболевания при сахарном диабете. В кн.: Сахарный диабет и репродуктивная система / под ред. Дедова И. И., Шестаковой М. В. М., 2016. С. 135–148 [Urologicheskie i andrologicheskie zabolevanija pri saharnom diabete. V kn.: Saharnyj diabet i reproduktivnaja sistema / pod red. Dedova I. I., Shestakovoj M. V. M., 2016. S. 135–148 (in Russian)].
23. Vermeulen A. Hormonal cut-offs of partial androgen deficiency: a survey of androgen assays // J. Endocrinol. Invest. 2005. Vol. 28 (3 Suppl.). P. 28–31.
24. Bremner A. P., Feddema P., Leedman P. J. et al. Age-Related Changes in Thyroid Function: A Longitudinal Study of a Community-Based Cohort // J. Clin. Endocr. Metab. 2012. Vol. 97 (5). P. 1554–1562. DOI: 10.1210/jc.2011–3020.
25. Muraleedharan V., Marsh H., Kapoor D. et al. Testosterone deficiency is associated with increased risk of mortality and testosterone replacement improves survival in men with type 2 diabetes // European Journal of Endocrinology. 2013. Vol. 169 (6). P. 725–733. DOI: 10.1530/eje-13–0321.
26. Hackett G., Heald A. H., Sinclair A. et al. Serum testosterone, testosterone replacement therapy and all-cause mortality in men with type 2 diabetes: retrospective consideration of the impact of PDE5 inhibitors and statins // Int. J. Clin. Pract. 2016. Vol. 70 (3). P. 244–253. DOI: 10.1111/ijcp.12779.
27. Saad F., Gooren L., Haider A., Yassin A. An Exploratory Study of the Effects of 12 Month Administration of the Novel Long-Acting Testosterone Undecanoate on Measures of Sexual Function and the Metabolic Syndrome // Arch. Androl. 2009. Vol. 53 (6). P. 353–357. DOI: 10.1080/01485010701730880.
28. Haider A., Gooren L. J.G., Padungtod P., Saad F. Improvement of the Metabolic Syndrome and of Non-alcoholic Liver Steatosis upon Treatment of Hypogonadal Elderly Men with Parenteral Testosterone Undecanoate // Experimental and Clinical Endocrinology and Diabetes. 2009. Vol. 118 (03). P. 167–171. DOI: 10.1055/s-0029–1202774.
29. Haider A., Saad F., Doros G., Gooren L. Hypogonadal obese men with and without diabetes mellitus type 2 lose weight and show improvement in cardiovascular risk factors when treated with testosterone: An observational study // Obes. Res. Clin. Pract. 2014. Vol. 8 (4). e339-e349. DOI: 10.1016/j.orcp.2013.10.005.
30. Saad F., Haider A., Doros G., Traish A. Long-term treatment of hypogonadal men with testosterone produces substantial and sustained weight loss // Obesity. 2013. Vol. 21 (10). P. 1975–1981. DOI: 10.1002/oby.20407.
31. Yassin A. A., Doros G. Testosterone therapy in hypogonadal men results in sustained and clinically meaningful weight loss // Clinical Obesity. 2013. Vol. 3 (3–4). P. 73–83. DOI: 10.1111/cob.12022.
32. Francomano D., Ilacqua A., Bruzziches R. et al. Effects of 5-Year Treatment With Testosterone Undecanoate on Lower Urinary Tract Symptoms in Obese Men With Hypogonadism and Metabolic Syndrome // Urology. 2014. Vol. 83 (1). P. 167–174. DOI: 10.1016/j.urology.2013.08.019.
33. Corona G., Monami M., Rastrelli G. et al. Type 2 diabetes mellitus and testosterone: a meta-analysis study // Int. J. Androl. 2011. Vol. 34 (6pt1). P. 528–540. DOI: 10.1111/j.1365–2605.2010.01117.x.
34. Haider A., Yassin A., Doros G., Saad F. Effects of Long-Term Testosterone Therapy on Patients with “Diabesity”: Results of Observational Studies of Pooled Analyses in Obese Hypogonadal Men with Type 2 Diabetes // Int. J. Endocrinol. 2014. Vol. 2014. P. 1–15. DOI: 10.1155/2014/683515.
35. Kapoor D. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes // European Journal of Endocrinology. 2006. Vol. 154 (6). P. 899–906. DOI: 10.1530/eje.1.02166.
36. Aversa A., Bruzziches R., Francomano D. et al. Effects of Testosterone Undecanoate on Cardiovascular Risk Factors and Atherosclerosis in Middle-Aged Men with Late-Onset Hypogonadism and Metabolic Syndrome: Results from a 24-month, Randomized, Double-Blind, Placebo-Controlled Study // The Journal of Sexual Medicine. 2010. Vol. 7 (10). P. 3495–3503. DOI: 10.1111/j.1743–6109.2010.01931.x.
37. Strollo F., Strollo G., Morè M. et al. Low-intermediate dose testosterone replacement therapy by different pharmaceutical preparations improves frailty score in elderly hypogonadal hyperglycaemic patients // The Aging Male. 2013. Vol. 16 (2). P. 33–37. DOI: 10.3109/13685538.2013.773305.
38. Heufelder A. E., Saad F., Bunck M. C., Gooren L. Fifty-two-Week Treatment With Diet and Exercise Plus Transdermal Testosterone Reverses the Metabolic Syndrome and Improves Glycemic Control in Men With Newly Diagnosed Type 2 Diabetes and Subnormal Plasma Testosterone // J. Androl. 2009. Vol. 30 (6). P. 726–733. DOI: 10.2164/jandrol.108.007005.
39. Hackett G., Cole N., Bhartia M. et al. The response to testosterone undecanoate in men with type 2 diabetes is dependent on achieving threshold serum levels (the BLAST study) // Int. J. Clin. Pract. 2014. Vol. 68 (2). P. 203–215. DOI: 10.1111/ijcp.12235.
40. Jones T. H., Arver S., Behre H. M. et al. Testosterone Replacement in Hypogonadal Men With Type 2 Diabetes and/or Metabolic Syndrome (the TIMES2 Study) // Diabetes Care. 2011. Vol. 34 (4). P. 828–837. DOI: 10.2337/dc10–1233.
41. Wang K.– J., Li H., Cai X. et al. Metabolic effects of testosterone replacement therapy on hypogonadal men with type 2 diabetes mellitus: a systematic review and meta-analysis of randomized controlled trials // Asian Journal of Andrology. 2014. Vol. 16 (1). P. 146. DOI: 10.4103/1008–682x.122346.
42. Groti K., Žuran I., Antonič B. et al. The impact of testosterone replacement therapy on glycemic control, vascular function, and components of the metabolic syndrome in obese hypogonadal men with type 2 diabetes // The Aging Male. 2018. P. 1–12.
43. Aversa A., Francomano D., Lenzi A. Does testosterone supplementation increase PDE5-inhibitor responses in difficult-to-treat erectile dysfunction patients? // Expert. Opin. Pharmacother. 2015. Vol. 16 (5). P. 625–628. DOI: 10.1517/14656566.2015.1011124.
44. Zitzmann M., Mattern A., Hanisch J. et al. IPASS: A Study on the Tolerability and Effectiveness of Injectable Testosterone Undecanoate for the Treatment of Male Hypogonadism in a Worldwide Sample of 1,438 Men // The Journal of Sexual Medicine. 2013. Vol. 10 (2). P. 579–588. DOI: 10.1111/j.1743–6109.2012.02853.x.
45. Lunenfeld B., Mskhalaya G., Zitzmann M. et al. Recommendations on the diagnosis, treatment and monitoring of hypogonadism in men // The Aging Male. 2015. Vol. 18 (1). P. 5–15. DOI: 10.3109/13685538.2015.1004049.
46. Medras M., Alicja F., Pawel J. et al. Breast cancer and long-term hormonal treatment of male hypogonadism // Breast Cancer Res. Treat. 2006. Vol. 96 (3). P. 263–265. DOI: 10.1007/s10549–005–9074-y.
47. Fernández-Balsells M.M., Murad M. H., Lane M. et al. Adverse Effects of Testosterone Therapy in Adult Men: A Systematic Review and Meta-Analysis // J. Clin. Endocr. Metab. 2010. Vol. 95 (6). P. 2560–2575. DOI: 10.1210/jc.2009–2575.
48. Corona G., Maseroli E., Rastrelli G. et al. Cardiovascular risk associated with testosterone boosting medications: a systematic review and meta-analysis // Expert. Opin. Drug. Saf. 2014. Vol. 13 (10). P. 1327–1351. DOI: 10.1517/14740338.2014.950653.
49. Fernández-Balsells M.M., Murad M. H., Lane M. et al. Adverse Effects of Testosterone Therapy in Adult Men: A Systematic Review and Meta-Analysis // J. Clin. Endocr. Metab. 2010. Vol. 95 (6). P. 2560–2575. DOI: 10.1210/jc.2009–2575.
50. Maggi M., Wu F. C., Jones T. H. et al. Testosterone treatment is not associated with increased risk of adverse cardiovascular events: results from the Registry of Hypogonadism in Men (RHYME) // International journal of clinical practice. 2016. Vol. 70 (10). P. 843–852.
51. Morgentaler A., Miner M. M., Caliber M. et al. Testosterone therapy and cardiovascular risk: advances and controversies // Mayo Clinic Proceedings. Elsevier. 2015. Vol. 90 (2). P. 22–251.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru




