Современные представления о микробиоте
Термин «микробиота», определяющий микробиоценоз отдельных органов и систем организма человека, генетического материала и взаимоотношений внутри экологической ниши в определенный период на определенной географической территории, используется учеными с середины прошлого века [1]. Однако только в последние 20 лет благодаря развитию новейших методов молекулярного анализа (геномики, транскриптомики, протеомики, метаболомики, микробиомики) стало возможным активное всестороннее изучение микробиоты [2, 3]. Именно на этом этапе начался процесс формирования принципиально нового взгляда на микробиоценоз с позиций клинической медицины.
Совокупность геномов микробиоты обозначается термином «микробиом», который используется для описания сущности микробных признаков (функций), кодируемых микробиотой [4].
Фундаментальные исследования микробиоты ведутся с 2007 г., когда были инициированы такие крупнейшие авторитетные проекты, как MetaHIT (Metagenome of Human Intestinal Tract — Метагеном кишечника человека) в Европе и HMP (Human Microbiome Project — Проект человеческого микробиома) в США. Результаты исследований, проведенных в рамках этих проектов, опубликованные в журнале Nature, значительно расширили представления научного сообщества о составе и функциях микробиоты.
В различных биотопах человеческого организма обитает порядка 1015 микроорганизмов, из них идентифицировано более 10 тыс. видов и до 70 тыс. штаммов. Около 15–16% микроорганизмов приходится на ротоглотку; на урогенитальный тракт — 9%, исключая вагинальный отдел, который заселен довольно слабо (2%); на кожные покровы — 12%. На долю различных отделов желудочно-кишечного тракта (ЖКТ) приходится основная часть (70%) микрофлоры. Экосистема толстой кишки наиболее разнообразна и наиболее интенсивно изучена. Соответственно и метаболический потенциал кишечной микрофлоры сконцентрирован преимущественно в толстой кишке, определяя ее функциональное значение для организма человека [5, 6].
Кишечная микробиота характеризуется видовым разнообразием, стабильностью и функциональной избыточностью [7, 8].
В настоящее время не только установлены основные типы (филумы) бактерий, заселяющих кишечник (Actinobacteria, Bacteroidetes, Cyanobacteria, Firmicutes, Fusobacteria, Lentisphaerae, Proteobacteria, Spirochaetes, Synergistetes, Verrucomicrobia, Euryarchaeota), но и выявлены доминирующие группы (фирмикуты, бактероиды, актинобактерии и протеобактерии), составляющие 80–99% микробиоты кишечника здоровых лиц [8]. При этом доказано, что на настоящий момент четко категорировать состав микробиоты невозможно [9].
Однако функционально-ориентированный подход к изучению микробиоты, нацеленный в первую очередь на метаболическую активность бактерий, позволил создать концепцию филометаболического (филофункционального) ядра, объединившего эволюционно стабильные виды микроорганизмов, выполняющие основные функции:
метаболические;
антитоксические, защитные, иммунные;
антимутагенные, антиканцерогенные [5, 8, 10].
Важно отметить, что в состав филометаболического ядра вошли бактерии, продуцирующие бутират, пропионат, ацетат (короткоцепочечные жирные кислоты — КЖК), утилизирующие водород, метаболизирующие желчные кислоты, холин, витамины и некоторые противовоспалительные, антимикробные, иммуностимулирующие соединения [8, 11, 12].
Содержание статьи
- 1 Некоторые эффекты низкомолекулярных метаболитов кишечной микрофлоры
- 2 Микробиота и иммунитет
- 3 Болезни разные — микроэкологические нарушения стереотипные
- 4 Лечебная коррекция нарушений микробиоценоза кишечника
- 5 Роль пищевых волокон в коррекции нарушений микробиоценоза кишечника и поддержании эубиоза
- 6 Роль пищевых волокон в усилении иммунитета и профилактике гриппа
- 7 Заключение
Некоторые эффекты низкомолекулярных метаболитов кишечной микрофлоры
Низкомолекулярные метаболиты кишечной микрофлоры, в первую очередь КЖК, обладают следующими физиологическими эффектами местного и системного уровня в отношении организма хозяина:
энергообеспечение эпителия;
антибактериальный эффект;
регуляция пролиферации и дифференцировки эпителия;
поставка субстратов глюконеогенеза;
поставка субстратов липогенеза;
блокировка адгезии патогенов к эпителию;
активация фагоцитоза;
регулировка моторной активности кишечника;
поставка субстратов для синтеза коферментов;
усиление местного иммунитета;
поддержание ионного обмена [13].
Следовательно, метаболический путь связывает микробиоту кишечника с нервной (вагус и интрамуральная нервная система), эндокринной (кортизол), иммунной (цитокины) системами макроорганизма. Так, например, КЖК (бутират и пропионат) способны модулировать активность головного мозга, увеличивая секрецию пептида YY, который замедляет моторику кишечника и усиливает поглощение питательных веществ и энергии [14, 15].
Микробиота и иммунитет
Еще одним важнейшим эффектом жизнедеятельности микробиоты является стимулирующее воздействие на локальный иммунитет, в основном за счет продукции секреторного IgА. КЖК, лактат и некоторые другие метаболиты способны ингибировать рост сальмонелл, дизентерийных шигелл и многих грибов. Блокируя своими адгезинами рецепторы эпителиоцитов, они препятствуют адгезии патогенной микрофлоры к эпителию и обладают способностью индуцировать хемотаксис бактерий.
Также в научном сообществе обсуждается вопрос об участии микрофлоры в противовирусной защите организма человека. Микробиота обладает способностью перехвата и выведения вирусов благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина. При этом взаимодействие с иммунной системой носит двунаправленный характер: с одной стороны, микробиота влияет на развитие иммунной системы, опосредует активацию иммунных клеток, продукцию цитокинов и пролиферацию Т-лимфоцитов за счет метаболизма КЖК, с другой стороны, иммунная система регулирует колонизацию и численность видов микрофлоры и реакцию на комменсальные бактерии [16, 17].
Зарубежными исследователями описана роль КЖК в дифференцировке Т-клеток как в эффекторные, так и в регуляторные, связанные с иммунитетом или иммунной толерантностью в зависимости от иммунологической среды. Предполагается, что КЖК являются важными регуляторами функции Т-клеток. Показано влияние КЖК на экспансию/генерацию Тreg-клеток через GPCR-рецепторы и их (бутирата и, в меньшей степени, пропионата) способность ингибировать деацетилазы гистонов (Histone deacetylase, HDAC). Ингибиторы HDAC широко используются для лечения рака. Следовательно, КЖК могут профилактировать рак и модулировать иммунный гомеостаз [18].
Поскольку микробиота выполняет многочисленные функции местного и системного уровня, крайне важно поддерживать ее стабильность на протяжении всей жизни. Независимо от индивидуальных различий в составе кишечной микробиоты кишечный микробиоценоз у каждого человека функционирует как взаимосвязанная экосистема и метаболический орган, обеспечивающий необходимое количество и профиль важнейших низкомолекулярных метаболитов, основными из которых являются КЖК. Уровень и соотношение КЖК являются важными параметрами кишечного гомео-
стаза, который должен поддерживаться в заданном диапазоне: ацетат: пропионат: бутират = 60:20:18 [19–21].
Болезни разные — микроэкологические нарушения стереотипные
С момента осмысления места и роли микробиоценозов в полноценной жизни человека начинается качественно новый этап в понимании патогенеза многих заболеваний, а также подходов к их диагностике, лечению и профилактике.
Нормальный состав кишечной микрофлоры может быть только при нормальном физиологическом состоянии организма. Под влиянием многочисленных ятрогенных воздействий, стрессовых ситуаций, факторов питания, инфекционных заболеваний и др. происходят патологические изменения в организме, в результате чего изменяются состав и свойства кишечной микрофлоры, могут быть нарушены ее локальные и системные функции.
В настоящее время в научной литературе показан переход от эубиоза к формированию дисбиоза с развитием кишечных и внекишечных заболеваний, расширяется спектр патологий, связанных с нарушением микробиоценоза кишечника. В первую очередь, это функциональные органические заболевания ЖКТ (синдром раздраженного кишечника (СРК), воспалительные заболевания кишечника, дивертикулярная болезнь и др.). Во-вторых, заболевания печени, желчного пузыря, метаболические заболевания, в частности неалкогольная жировая болезнь печени (НАЖБП). Кроме того, выделяют ряд гематологических, мочеполовых, кардиологических, ревматологических, неврологических расстройств, ассоциированных с нарушениями кишечной микрофло-
ры [22–24]. Осмысление патогенеза патологических состояний осуществляется с позиций понимания участия микробиоты в метаболическом обеспечении и регуляции функций макроорганизма (метаболический и регуляторный дисбиоз).
В недавних исследованиях российских ученых показано, что КЖК (их концентрации в кишечнике (кал, биоптаты слизистой оболочки), крови (сыворотка, плазма), моче или выдыхаемом воздухе либо метаболомные (метаболические) профили исследуемых субстратов) могут служить биомаркерами так называемого метаболического дисбиоза [21]. Опубликованы данные о содержании и профиле КЖК в фекалиях и сыворотке крови в норме и при заболеваниях ЖКТ. В результате проведенных исследований выявлены характерные (специфические) изменения КЖК в различных биологических субстратах у больных СРК (с запором и диареей), язвенным колитом, раком толстой кишки, заболеваниями бронхолегочной системы, ожирением, метаболическим синдромом и НАЖБП [15, 19, 25–27].
Лечебная коррекция нарушений микробиоценоза кишечника
Комплекс лечебно-профилактических мероприятий при нарушении микробиоценоза кишечника складывается из: 1) диетической коррекции; 2) лечения патологии, приведшей к его развитию; 3) деконтаминации условно-патогенной флоры (в основном невсасывающимися кишечными антибиотиками, а также энтеросорбентами, культурами бактерий, обладающими антагонистической активностью, и др.); 4) восстановления эубиоза; 5) поддерживающей терапии основного заболевания и профилактики нарушений микробиоценоза кишечника (в период ремиссии).
Здесь важно отметить, что, несмотря на то, что возникающие нарушения микробиоценоза кишечника, с точки зрения современной науки, рассматриваются как следствие основной патологии, важно понимать, что эти нарушения могут сами приводить к развитию заболевания и в дальнейшем, в свою очередь, становятся факторами его прогрессирования, запуская целый каскад новых патологических процессов.
В целях восстановления микробиоценоза и обеспечения нормального функционирования ЖКТ в медицинской практике применяют разнообразные по составу и механизму действия пробиотики, пребиотики и метабиотики [5, 15, 28–33]. Необходимо отметить, что из 700 зарегистрированных в настоящее время пробиотиков только 30 обладают научно обоснованной доказательной базой их эффективности. Решая достаточно широкий круг задач, пробиотики предназначены для курсового применения. Класс метабиотиков по сути является естественным продолжением пробиотической концепции, но позволяет приблизиться к решению основной проблемы развития заболеваний — устранению дефицита низкомолекулярных соединений, обязательно присутствующих в биологических жидкостях и тканях макроорганизма (устранению метаболического дисбиоза).
При этом для стимуляции роста и метаболической активности собственной кишечной микробиоты представляется целесообразным использовать и назначать пациентам пребиотики.
Роль пищевых волокон в коррекции нарушений микробиоценоза кишечника и поддержании эубиоза
Среди представителей пребиотиков лидирующее место принадлежит натуральным пищевым волокнам (ПВ) — частично или полностью неперевариваемым компонентам пищи, которые избирательно стимулируют рост и метаболическую активность одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечной микробиоты [34].
ПВ обладают целым рядом физико-химических эффектов в отношении организма человека. При прохождении по кишечнику ПВ формируют матрикс фиброзного и аморфного характера по типу «молекулярного сита», обладающего водоудерживающей способностью, катионообменными и адсорбционными свойствами, чувствительностью к бактериальной ферментации в толстой кишке. Наличие в ПВ карбоксильных и гидроксильных групп способствует также ионному обмену. В совокупности данные свойства ПВ способствуют ускоренному кишечному транзиту, увеличению влажности и массы фекалий и снижению напряжения кишечной стенки. В желудке же под влиянием ПВ замедляется эвакуация пищи, что создает более длительное чувство насыщения, ограничивает потребление высокоэнергизированной пищи и способствует снижению массы тела [5].
Дополнительно к усилению насыщения и улучшению работы кишечника и ослаблению нарушений, связанных с ней, таких, например, как запор, включение ПВ в пищу связано с профилактикой серьезных хронических заболеваний, в частности ожирения, метаболического синдрома, сахарного диабета, сердечно-сосудистых заболеваний
(за счет снижения уровня холестерина в крови), рака ободочной и прямой кишки (за счет разбавления потенциальных канцерогенов и уменьшения времени их контакта со слизистой оболочкой кишечника) [35].
В результате микробного метаболизма в толстой кишке образуются КЖК, углекислый газ, водород, вода. Углекислый газ преимущественно преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты, в первую очередь КЖК, утилизируются организмом хозяина. Нормальная микрофлора толстой кишки, перерабатывая ПВ, производит КЖК с минимальным количеством их изоформ [34].
В России и за рубежом уже достаточно продолжительное время с успехом применяется препарат ПВ псиллиум, действующим веществом которого является оболочка семян подорожника.
Недавно на российском рынке появилась новая БАД под торговым наименованием «Оптифайбер», представляющая собой экстракт плодов циамопсиса четырехкрыльникового. Это 100% растворимое ПВ, вырабатываемое путем частичного гидролиза. Химическая структура данного полисахарида обеспечивает более медленное брожение и, следовательно, лучшую переносимость средства,
т. к. быстрое брожение сопряжено с повышенным газообразованием и вздутием живота [35, 36].
Частично гидролизованные ПВ (ЧГПВ) циамопсиса полностью растворяются в горячей и холодной воде, не изменяя текстуру и вкус продукта. При этом сохраняется стабильность ПВ при различных уровнях pH, устойчивость к нагреванию, кислоте, соли, высокому давлению и действию пищеварительных ферментов, что отвечает основным требованиям, предъявляемым к пребиотикам. К тому же ЧГПВ циамопсиса имеют низкую молекулярную массу и вязкость, т. е. данное соединение не образует гель, а остается жидким, что делает его более подходящим для применения в пищевых продуктах и напитках [35, 37, 38]. Безопасность использования продукта обеспечивается исключительно натуральным составом. Он не содержит сахар, лактозу, глютен, генно-модифицированные организмы, подсластители, красители, ароматизаторы и консерванты, поэтому может применяться в течение длительного времени с целью дополнения рациона клетчаткой [39].
Механизм действия ЧГПВ циамопсиса реализуется следующим образом: ПВ медленно ферментируются микроорганизмами в толстой кишке, при этом вырабатываются КЖК, являющиеся конечными продуктами ферментации и источником энергии колоноцитов. КЖК, в свою очередь, увеличивают поглощение жидкости и натрия в толстой кишке, что проявляется в нормализации консистенции стула, а также улучшают моторику кишечника, обеспечивая его регулярную работу (рис. 1) [38].
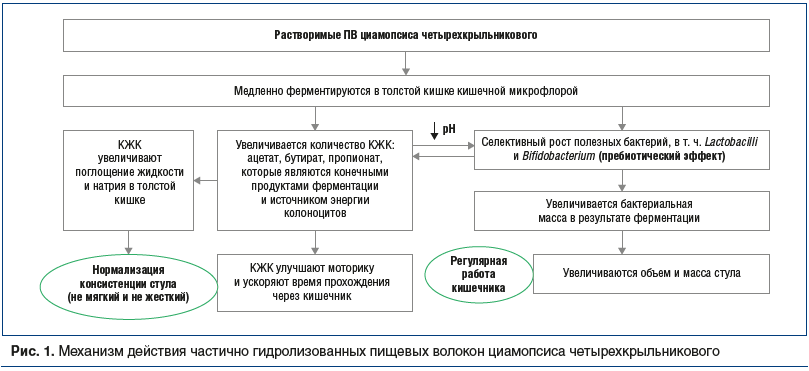
Исследование М. Velazquez et al. (2000) [40] показало, что применение содержащихся в составе Оптифайбера ЧГВП приводит к 9-кратному увеличению продукции КЖК у пациентов с хроническим запором, при этом достигается нормализация их процентного содержания (ацетат: пропионат : бутират — 68,4% : 19,8% : 20,7%).
ЧГПВ циамопсиса имеют высокий профиль доказанной клинической эффективности. Многочисленные исследования, в т. ч. рандомизированные двойные плацебо-контролируемые, достоверно доказывают положительное влияние циамопсиса на консистенцию и регулярность стула, уменьшение абдоминальной боли при СРК, снижение газообразования и вздутия живота, а также подтверждают его пребиотический эффект [35, 37, 38, 40–43].
Так, метаанализ, проведенный М.Р. Kapoor et al., включал 15 исследований, в т. ч. 4 рандомизированных клинических исследования, в результате которых подтверждается, что прием ЧГПВ циамопсиса четырехкрыльникового способствует нормализации стула и увеличивает частоту дефекации на 25% (1 раз в 41 ч) по сравнению с контрольной группой (1 раз в 55 ч) [37]. В исследовании S. Giaccari et al. установлено, что у пациентов, принимающих ЧГПВ циамопсиса в суточной дозировке 5 г/сут, восстанавливается регулярная работа кишечника через 3–4 нед. приема [44]. В этом же исследовании, включавшем 133 пациента с СРК, показано, что прием ЧГПВ циамопсиса достоверно снижает газообразование, вздутие живота и абдоминальную боль. В другом клиническом исследовании 39 пациентов с хроническим запором наблюдалось достоверное снижение натуживания при дефекации на 60%, улучшение показателей кала в 2 раза по Бристольской шкале, улучшение перистальтики в 3 раза и снижение выраженности абдоминальной боли и вздутия живота в 2 раза после терапии ЧГПВ циамопсиса в течение 4 нед. [40]. В отношении пребиотического эффекта ЧГПВ циамопсиса также проводился ряд доказательных исследований, в результате которых было показано, что прием циамопсиса в дозе 10 г/сут в течение 3 нед. практически в 2 раза увеличивает количество полезных видов бактерий (Lactobacillus, Bifidobacterium spp.) по сравнению с исходным уровнем [45, 46]. М. Velazquez et al. проводили следующее сравнительное исследование с участием пациентов с хроническими запорами: 1-я группа получала инулин, 2-я группа — псиллиум, 3-я группа — ЧГПВ циамопсиса четырехкрыльникового. Через 24 ч оценивались количество и профиль КЖК. Доказано, что ЧГПВ циамопсиса увеличивают продукцию КЖК в 9 раз по сравнению с исходным уровнем (54,6±0,7 мг/мл), что почти вдвое превосходит результаты, полученные в группах псиллиума и инулина [47].
Роль пищевых волокон в усилении иммунитета и профилактике гриппа
Новейшие исследования японских ученых доказывают эффективность ЧГПВ циамопсиса для профилактики риска возникновения гриппа. Так, ретроспективный анализ с участием 996 пациентов со средним возрастом 80 лет (высокая группа риска), проведенный С. Takahashi в период с апреля 2017 г. по март 2019 г., показал, что в группе ПВ (5 г/сут) никто не заболел гриппом, в то время как в группе сравнения (без ПВ) заболеваемость составила 10,4% [48].
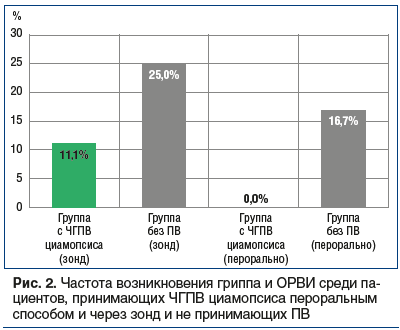
В другом ретроспективном анализе 96 пациентов в период с декабря 2018 г. по март 2019 г. доказано, что распространенность гриппа была значительно ниже в группе пациентов, принимавших ЧГПВ циамопсиса четырехкрыльникового как через зонд, так и пероральным способом, чем в группе сравнения без приема ПВ. Среди пациентов, получавших питание через зонд, частота заболеваемости гриппом была в 2 раза ниже, выздоровление проходило достоверно быстрее и без осложнений. В группе пациентов, получавших пероральное питание и ЧГПВ циамопсиса, гриппом и ОРВИ не заболел никто (рис. 2) [49].
Австралийскими учеными в 2018 г. было проведено исследование на мышах. Опубликованные данные этого исследования показывают, что применение ПВ может защитить от тяжелой инфекции гриппа, уменьшая повреждение тканей и повышая адаптивный противовирусный иммунитет. Авторами подчеркивается двойная роль КЖК: путем понижения чрезмерных реакций врожденного иммунитета, повышения тканезащитных механизмов и стимулирования специфической приспособительной невосприимчивости может создаваться иммунный баланс, который в конечном счете защищает от заболевания [50].
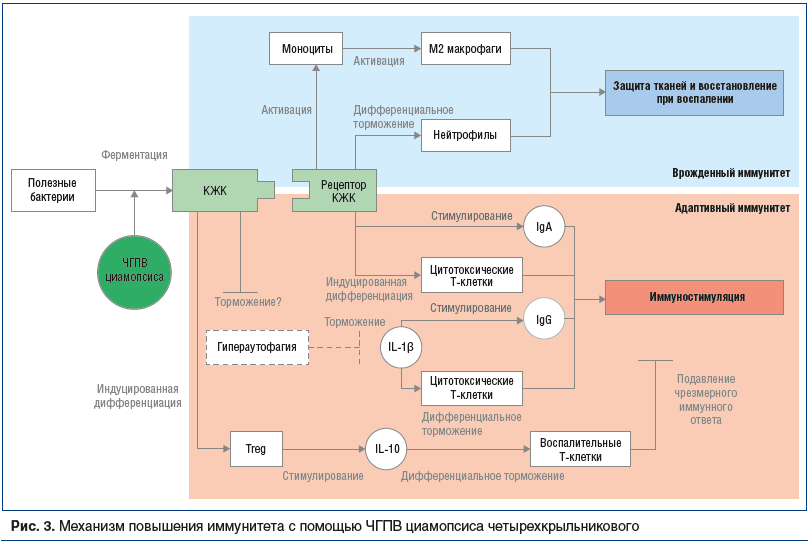
Следовательно, применение ЧГПВ циамопсиса благодаря повышению количества и метаболической активности кишечной микробиоты способствует стимуляции врожденного и адаптивного иммунитета, защите и восстановлению тканей при воспалении, а также подавлению чрезмерного иммунного ответа (рис. 3) [48, 49].
Заключение
На современном этапе развития науки не вызывает сомнений теснейшая взаимосвязь между микробиотой различных эпитопов человеческого организма и функционированием отдельных органов и систем, а также всего организма в целом. Дисбиоз кишечника влияет на тяжесть течения и частоту рецидивов многих заболеваний ЖКТ, включая СРК, язвенный колит, участвует в патогенезе новообразований толстой кишки. Широко обсуждается роль нарушений микробиоты в развитии метаболических заболеваний, ряда аутоиммунных нарушений, аутизма. Представленный объем достоверных клинических данных свидетельствует о том, что применение пребиотиков, в частности ПВ, для коррекции нарушений кишечной микробиоты является перспективным направлением лечения и профилактики различных заболеваний. В свою очередь, ЧГПВ циамопсиса (Оптифайбер) благодаря таким эффектам, как регуляция работы кишечника, снижение выраженности абдоминальной боли, уменьшение газообразования, вздутия живота, повышение количества и метаболической активности резидентной микрофлоры кишечника способствует восстановлению и поддержанию кишечного эубиоза, нормализации консистенции и частоты стула, купированию симптомов СРК, повышает устойчивость иммунитета к различным инфекциям, в частности гриппу. Последнее имеет крайне важное значение в связи с неутихающей пандемией новой коронавирусной инфекции. Данное средство не имеет существенных побочных эффектов и может применяться с целью дополнения рациона необходимым количеством ПВ длительно.
Благодарность
Автор и редакция благодарят компанию ООО «Атриум Инновейшенс РУС» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
.
Информация с rmj.ru





