Введение
Ревматоидный артрит (РА) относится к наиболее частым воспалительным заболеваниям суставов, приводящим к стойкой инвалидизации и ранней смерти больных [1].
РА является одним из наиболее тяжелых иммуновоспалительных заболеваний человека, что определяет большое медицинское и социально-экономическое значение этой патологии [2]. Распространенность РА среди взрослого населения в разных географических зонах мира колеблется от 0,5% до 2% [2]. По данным официальной статистики, в России зарегистрировано около 300 тыс. пациентов с РА, а по данным российского эпидемиологического исследования, РА страдает около 0,61% от общей популяции [3].
Одним из частых проявлений РА является болевой синдром, который значительно ухудшает качество жизни таких пациентов [4, 5].
Международная ассоциация по изучению боли приводит следующее распределение 530 болевых синдромов по их локализации вне зависимости от этиологии: генерализованные болевые синдромы — 36, боли в области шеи и головы — 66, боли в руках — 35, боли в области грудного и шейного отделов позвоночника — 154, боли в поясничной, сакральной и копчиковой области — 136, боли в туловище — 85, боли в ногах — 18 [6]. Наиболее частой локализацией болевого синдрома является спина [7].
В патогенезе формирования болевого синдрома ключевую роль играют биогенные амины (гистамин, серотонин), активные полипептиды (галанин, вазоактивный интестинальный полипептид, нейропептид Y) и белки (кинины, калликреины, активация системы комплемента, лейкоцитарные факторы и пр.), а также продукты каскада арахидоновой кислоты [8].
В связи с вышесказанным в клинические рекомендации по лечению РА входит обширный перечень лекарственных препаратов, оказывающих влияние на ключевые звенья патогенеза болевого синдрома: нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды и базисные противовоспалительные препараты [9].
Несмотря на широкий арсенал медикаментозных средств, призванных облегчить хроническую боль у пациентов с РА, многие из них продолжают испытывать интенсивные суставные боли [10]. Данные литературных обзоров наглядно демонстрируют, что снижение двигательной активности и формирование ограничительного поведения являются предикторами прогрессирования суставного синдрома при РА и возрастания степени психической дезадаптации пациентов вне зависимости от тяжести заболевания [11].
Хотя в рандомизированных плацебо-контролируемых исследованиях и клинической практике НПВП чаще назначаются перорально, в настоящее время наблюдается тенденция к более широкому использованию парентеральных форм НПВП. Теоретическим обоснованием применения парентеральных форм НПВП является более высокая биодоступность по сравнению с пероральными формами. Это особенно важно при назначении рекомендуемых в настоящее время высоких доз НПВП [12].
В рамках регистрации препарата АМБЕНИУМ® парентерал, содержащего фенилбутазон + [лидокаин], было проведено клиническое исследование «Открытое сравнительное рандомизированное исследование в параллельных группах эффективности и безопасности препарата АМБЕНИУМ® парентерал, раствор для внутримышечного введения, в сравнении с препаратом диклофенак натрия, раствор для внутримышечного введения 75 мг, в купировании острой боли в нижней части спины» (разрешение на проведение исследования: № 256 от 14.04.2016).
Целью данного исследования являлась сравнительная оценка анальгезирующего эффекта препаратов АМБЕНИУМ® парентерал (исследуемый препарат, ИП) и диклофенак натрия (препарат сравнения, ПС) у пациентов с острой болью в нижней части спины.
К первичным задачам исследования относилась сравнительная оценка анальгезирующего эффекта препаратов у пациентов с острой болью в нижней части спины и оценка безопасности терапии.
Материал и методы
Исследование являлось открытым сравнительным рандомизированным исследованием в параллельных группах. Для участия в нем до начала любых процедур, предусмотренных протоколом, было получено письменное информированное согласие пациента на участие в исследовании. Протокол исследования был одобрен советом по этике при Министерстве здравоохранения Российской Федерации (протокол № 119 от 16.02.2016), а также комитетом по вопросам этики при ООО «НИЦ Эко-безопасность» (протокол заседания комитета по вопросам этики № 5 от 09.06.2016).
В исследование было включено 164 пациента мужского и женского пола в возрасте от 18 до 72 лет с диагнозом острой боли в нижней части спины (код по МКБ-10 M54.5 Боль внизу спины) с интенсивностью болевого синдрома не менее 80 баллов по визуально-аналоговой шкале (ВАШ). Из результатов сравнительной оценки демографических и антропометрических характеристик пациентов видно, что статистически значимых различий между группами обнаружено не было.
162 пациента завершили участие в исследовании по его графику, 2 пациента — досрочно по причине отказа от дальнейшего участия в исследовании. Использовалась открытая сравнительная рандомизированная схема исследования в параллельных группах, при которой каждый пациент включался в одну из исследуемых групп в зависимости от назначенного ему препарата.
Порядок обследования пациента с болью в спине на скрининге предполагал: анализ данных анамнеза и жалоб пациента; физикальный осмотр пациента и измерение показателей основных жизненных функций; неврологический осмотр; регистрацию электрокардиограммы (ЭКГ) в 12 отведениях; интерпретацию результатов дополнительных инструментальных исследований (рентгенография, и/или компьютерная томография, и/или магнитно-резонансная томография позвоночника; лабораторные анализы (общие анализы мочи и крови, биохимическое исследование крови).
Качественные характеристики болевого синдрома оценивались при помощи опросника боли МакГилла, позволяющего определить сенсорные, аффективно-эмоциональные и количественные составляющие болевого состояния пациента [13]. Высчитывались два основных показателя: разница интенсивности боли (РИБ) (сумма порядковых номеров, сверху вниз выбранных слов в классах или их среднеарифметическая величина) и число выбранных дескрипторов (ЧВД) — сумма выбранных слов.
Выраженность боли оценивалась в покое путем анкетирования пациентов по 100-балльной ВАШ, в соответствии с которой отсутствие боли принималось за 0, максимально выраженный болевой синдром — за 100.
Определение времени наступления анальгезирующего эффекта оценивалось через 20 мин, 1, 2, 4, 6, 8, 12 и 24 ч после введения исследуемых препаратов на основании субъективного отчета пациента о полном исчезновении боли или уменьшении боли на 75% и более по ВАШ.
Также оценивалась общая эффективность терапии пациентом по истечении 24 ч после введения препаратов по 4-балльной шкале: очень хорошо, хорошо, плохо, очень плохо; динамика боли по опроснику МакГилла.
Исследуемый препарат АМБЕНИУМ® парентерал (МНН: фенилбутазон + [лидокаин]), раствор для внутримышечного введения, зарегистрирован на территории РФ с 15.01.2020 (ЛП-006040). 1 ампула содержит 400 мг фенилбутазона натрия и 4 мг лидокаина гидрохлорида моногидрата. Препарат вводился внутримышечно однократно медленно в ягодичную мышцу. Фенилбутазон является неселективным ингибитором циклооксигеназ ЦОГ-1 и ЦОГ-2 и обладает противовоспалительным, анальгезирующим, жаропонижающим действием. Кроме того, фенилбутазон обладает урикозурическим действием, а также незначительно выраженным легким анаболическим и спазмолитическим эффектами [14]. После внутримышечной инъекции препарата фенилбутазон быстро высвобождается из места инъекции в системный кровоток. Период полувыведения составляет от 50 до 100 ч и может значительно увеличиваться при нарушенной функции печени и почек. Метаболизм фенилбутазона происходит в результате окисления и глюкуронизации в печени. Главным метаболитом является фармакологически активный оксифенбутазон. Прочие метаболиты обладают меньшей противовоспалительной активностью. Связывание с белками плазмы крови составляет 99%, что существенно при возможных лекарственных взаимодействиях фенилбутазона. Элиминация неизмененного активного вещества, а также его метаболитов происходит как через почки (около 70%), так и с желчью через кишечник (около 30%) [14].
В состав ИП также входит лидокаина гидрохлорида моногидрат, профиль эффективности и безопасности которого достаточно изучен.
Препарат сравнения диклофенак натрия (1 ампула — 75 мг диклофенака натрия) вводился внутримышечно однократно медленно в ягодичную мышцу в дозе 75 мг. Лечение пациентов проводилось в соответствии с практическими рекомендациями по ведению боли в спине [15], согласно которым считается необходимым назначение НПВП в совокупности с миорелаксантами для купирования боли в спине.
Пациентам в обязательном порядке был запрещен прием любых обезболивающих препаратов в пролонгированной форме в течение 24 ч, предшествующих введению ИП/ПС; в любой другой лекарственной форме — в течение 12 ч.
Математико-статистический анализ результатов осуществлялся с использованием пакетов Microsoft Excel (2010) с надстройкой AtteStat и Statistica 10.0 (США). Полученные данные подвергались статистической обработке на соответствие закону нормального распределения с использованием критерия Шапиро — Уилка W. Если W статистика признавалась значимой, то гипотеза о нормальном распределении значений переменной отвергалась. В соответствии с полученными результатами анализа типа распределения осуществлялось представление данных описательной статистики — меры центральной тенденции, показатели разброса, частота, доверительные интервалы (ДИ). Для оценки различий количественных данных, не подчинявшихся нормальному закону распределения, и переменных, измеренных в ранговой шкале, между группами (ИП ↔ ПС) использовался U-тест Манна — Уитни. Для сравнения количественных данных, подчинявшихся закону нормального распределения, рассчитывался t-критерий Стьюдента для независимых выборок. При сравнении качественных показателей (долей) и оценки достоверности обнаруженных различий в частоте их появления использовался точный критерий Фишера. Величина ошибки для подтверждения нулевой гипотезы не должна была превышать 0,05 (при р<0,05 нулевая гипотеза отклонялась, при р>0,05 — принималась).
Результаты исследования
Оценка переносимости
В ходе исследования была установлена хорошая общая и локальная переносимость препарата АМБЕНИУМ® парентерал. Суммарно у пациентов из обеих групп было зарегистрировано 14 нежелательных явлений (НЯ) легкой степени тяжести, связь с препаратом для всех НЯ была оценена как «маловероятная». В группе ИП было зарегистрировано 9 (64,3%) НЯ, в группе ПС отмечено 5 (35,7%) НЯ.
НЯ в группе ИП были связаны преимущественно с отклонениями при физикальном осмотре. В 8 из 9 случаев была отмечена брадикардия неуточненная (R00.1) и только в 1 случае НЯ было связано с путем введения препарата — гиперемия (R23.2) в месте инъекции препарата. В группе ПС НЯ также были связаны в большинстве случаев с отклонениями при физикальном осмотре — в 4 из 5 случаев была отмечена брадикардия неуточненная (R00.1) и лишь в 1 случае была зарегистрирована головная боль (R51).
При оценке исхода НЯ установлено, что количество НЯ с исходом «выздоровление/разрешение» составило 14%, с исходом «нет сведений» — 86%. Все действия, предпринятые при возникновении НЯ, отнесены к категории «отсутствие действий».
Сравнение относительной частоты (доли) НЯ после введения препаратов показало отсутствие значимых различий (р=0,402) между исследуемыми группами.
Также в ходе исследования не было выявлено достоверных различий гематологических, биохимических, ЭКГ-показателей и показателей мочевыделительной системы у пациентов исследуемых групп.
Динамика выраженности боли по ВАШ
С целью оценки первичной конечной точки эффективности на первом этапе для каждого пациента исследуемых групп были рассчитаны значения РИБ по ВАШ в каждой точке через 20 мин (0,33 ч), 1, 2, 4, 6, 8, 12 и 24 ч после введения препаратов по формуле:
РИБt = ИБ0 — ИБt,
где ИБ0 — интенсивность боли перед введением препарата (точка -00:05); ИБt — интенсивность боли в каждой точке после введения препарата.
Затем для каждого пациента рассчитали взвешенную во времени сумму баллов разницы интенсивности боли по ВАШ (СРИБВ), характеризующую индивидуальную эффективность терапии за 24 ч лечения, по формуле:
СРИБВ = Ј (РИБt×Рt),
где Рt — временная разница, ч (время, прошедшее с момента предыдущего наблюдения).
На завершающем этапе для каждой группы на основе индивидуальных показателей СРИБВ рассчитывали средние изменения интенсивности боли по ВАШ, соответственно μИП=1694,407 и μПС=1373,299, величину их клинически значимых различий (Δ=321,108), а также границы одностороннего 95% ДИ для разности значений. Анализ данных показал, что нижняя граница одностороннего 95% ДИ для разности значений μИП и μПС составила 196,861 мм, что превышало величину клинически значимых различий — 10 мм. Представленные результаты позволили принять альтернативную гипотезу: терапия с применением препарата АМБЕНИУМ® парентерал не хуже терапии препаратом диклофенак натрия в купировании острой боли в нижней части спины на величину клинически значимых различий — 10 мм (Δ).
Дополнительно проведенный анализ с использованием критерия Стьюдента для независимых групп показал, что среднее изменение интенсивности боли по ВАШ в группе ИП статистически значимо (p<0,001) превышало аналогичный показатель для группы ПС. Аналогичные результаты были получены с использованием непараметрического U-теста Манна — Уитни (p<0,001).
Интенсивность боли по ВАШ через 2 ч
после введения препаратов
Анализ характеристики вторичной конечной точки эффективности — интенсивность боли по ВАШ через 2 ч после введения препаратов — показал, что медиана интенсивности боли по ВАШ через 2 ч после введения ИП была статистически значимо ниже (p=0,003), Me=40,0 (95% ДИ 40,0–50,0), чем после введения ПС, Me=50,0 (95% ДИ 50,0–60,0). Полученные данные свидетельствовали о не меньшей эффективности ИП в сравнении с ПС по показателю интенсивность боли через 2 ч после введения препарата.
Определение времени наступления анальгезирующего эффекта
Время наступления анальгезирующего эффекта оценивали при субъективном отчете о полном исчезновении боли или уменьшении боли на 75% и более по ВАШ 0–100. Оценку проводили через 20 мин, 1, 2, 4, 8, 12 и 24 ч после введения препаратов. При этом для анализа использовали наиболее раннюю после введения препарата временную точку, удовлетворяющую критериям исчезновения (уменьшения) боли. В качестве показателя эффективности использовали медиану времени наступления анальгезирующего эффекта (ВНАЭ), долю пациентов, удовлетворяющих критериям исчезновения (уменьшения) боли в каждой временной точке, и долю лиц, не достигших анальгезирующего эффекта за изучаемый период, — точку более 24 ч (табл. 1).
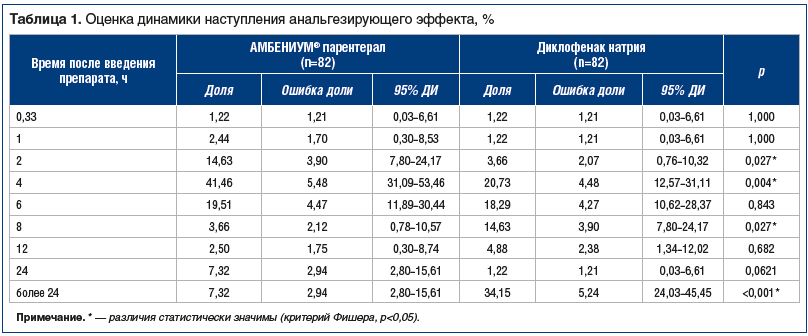
Анализ показал, что анальгезирующий эффект после введения препарата АМБЕНИУМ® парентерал наступал статистически значимо (p=0,013) раньше (на 2 ч по медиане (95% ДИ 4,0–4,0)), чем после введения препарата диклофенак натрия (95% ДИ 6,0–6,0).
Также необходимо отметить и большую эффективность ИП в качестве анальгетика. Так, количество пациентов, у которых не наблюдали полного исчезновения боли или уменьшения боли на 75% и более по ВАШ за исследуемый временной промежуток (точка более 24 ч), составило 6 человек (7,32%) против 28 обследуемых лиц (34,15%) в группе ПС. Представленные параметры статистически значимо (р<0,001) различались более чем в 4,5 раза.
Полученные данные свидетельствовали о не меньшей эффективности ИП в сравнении с ПС по показателю ВНАЭ.
Общая эффективность терапии
Пациенты также оценивали общую эффективность терапии через 24 ч после введения ИП/ПС по 4-балльной шкале: очень хорошо (4 балла), хорошо (3 балла), плохо (2 балла), очень плохо (1 балл).
Анализ показал, что большая часть ранжированных значений оценки эффективности терапии в группе ИП находилась на уровне 4 баллов (очень хорошо) (95% ДИ 3–4) и статистически значимо (p<0,001) отличалась от группы ПС, в которой значение медианы балльных оценок находилось на уровне 3 баллов (хорошо) (95% ДИ 2–3).
Оценка динамики боли по опроснику МакГилла
Динамику характера боли (качественных характеристик боли) оценивали с использованием опросника МакГилла. В таблице 2 представлена динамика обобщенных значений (медианы) показателя РИБ после введения ИП и ПС.
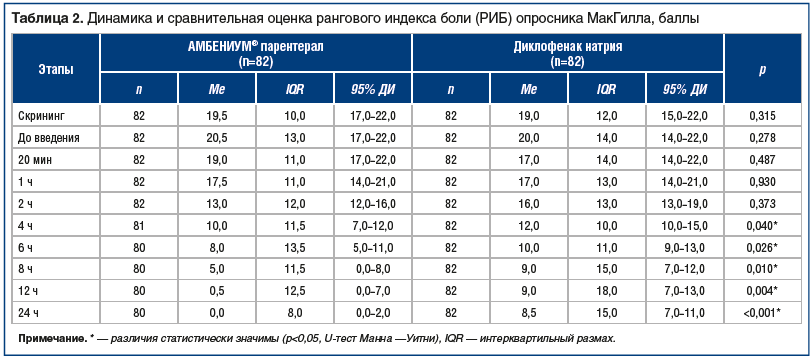
Анализ динамики РИБ показал, что исходные значения индекса боли (скрининг и данные до введения препарата) в исследуемых группах были практически идентичны. После введения препаратов, начиная с первой точки обследования, наблюдали общую тенденцию к снижению РИБ, которая была более выражена в группе ИП, при этом медиана данного показателя в точке 24 ч была равна нулю (95% ДИ 0–2,0). В то же время в группе ПС медиана РИБ в точке 24 ч составляла 8,5 балла (95% ДИ 7,0–11,0). Следует отметить, что статистически значимую разницу по уровню показателя РИБ между исследуемыми группами наблюдали с 4 ч после введения и до окончания обследования. Данный факт может указывать на более высокую эффективность ИП в сравнении с ПС.
При оценке динамики обобщенных значений (медианы) показателя ЧВД была отмечена общая тенденция к снижению данного показателя, при этом после введения ИП она была отмечена через 1 ч после введения и через 20 мин после введения ПС. В точке 24 ч в группе пациентов, получавших ИП, медиана показателя ЧВД была равна нулю, а в группе пациентов, которым вводили ПС, — 5,0 баллов. Статистически значимую разницу по уровню показателя ЧВД между исследуемыми группами также наблюдали, начиная с 4-го ч после введения препаратов и до окончания обследования.
Заключение
По результатам проведенного исследования установлены достаточные эффективность и безопасность препарата АМБЕНИУМ® парентерал в сравнении с диклофенаком натрия у пациентов с острой болью в нижней части спины. При этом анальгетический эффект после внутримышечного введения препарата АМБЕНИУМ® парентерал формировался через 1 ч и длился в течение 24 ч после его введения. При определении тактики обезболивающей медикаментозной терапии у пациентов с болью в нижней части спины, в т. ч. страдающих РА, лечащему врачу необходимо обращать внимание на характер жалоб пациента и проводить оценку болевого синдром по ВАШ. При интенсивности болевого синдрома более 80 баллов по ВАШ предпочтение следует отдавать парентеральным формам НПВП.
Благодарность
Редакция благодарит компанию «ЭйчБиЭм Фарма с.р.о.» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru






