В статье представлены результаты исследования, посвященного оценке протективных свойства мультипробиотического средства на фоне антибактериальной терапии у детей старше 3 лет с острой респираторной инфекцией
Содержание статьи
Введение
Широкое применение антибактериальных препаратов в клинической практике началось в середине ХХ в., что привело к изменению основных взглядов на терапию инфекционных заболеваний и существенно увеличило продолжительность жизни человека. Однако за последние 10 лет использование антибиотиков увеличилось во всем мире на 36%, что провоцирует рост антибиотикорезистентности и целого ряда нежелательных эффектов, одним из которых является диарея [1–3]. По данным различных эпидемиологических наблюдений, в среднем антибиотик-ассоциированная диарея (ААД) развивается у 5–30% лиц, получающих антибиотик [4, 5]. Понятие ААД включает в себя учащение стула от 3 раз в день в течение 2 дней подряд во время лечения или в период от 2 до 6 нед. после начала лечения антибиотиками при отсутствии других причин [6]. Важно, что прием антибиотиков и вызванные ими нарушения микробиоты имеют отдаленные последствия: избыточный вес, синдром раздраженного кишечника, аллергические заболевания [7].
Одним из основных механизмов развития диареи на фоне применения антибиотиков является избыточный рост бактерий в результате подавления облигатной интестинальной микрофлоры кишечника [8] наряду с собственными побочными эффектами антибиотиков [9] и осмотической диареей в результате нарушения метаболизма желчных кислот и углеводов в кишечнике [10].
На сегодняшний день общепризнано профилактическое назначение пре- и пробиотиков. На основании исследований, проведенных в 2015 г. экспертной группой, для профилактики AAД рекомендовано использовать Saccharomyces boulardii, Lactobacillus GG и комбинацию Lactobacillus casei DN114 G01, Lactobacillus bulgaricus, Streptococcus thermophilus [11].
Несмотря на имеющиеся в литературе данные, изучение механизмов и характера изменения микробиома кишечника при ААД не теряет своей актуальности. Одним из наиболее точных методов оценки на сегодняшний день является секвенирование генома микробного сообщества [12]. Идентификация микроорганизмов с применением традиционных микробиологических методов показывает принадлежность исследуемых культур бактерий к 17 родам и 20 видам, а при идентификации методом секвенирования ДНК по фрагменту гена 16S рРНК этих же культур удается установить их принадлежность уже ко всем известным на данный момент родам и видам [13, 14]. Метод секвенирования ДНК по генам 16S рРНК с 2008 г. признан «золотым стандартом» идентификации микроорганизмов, что позволяет его активно использовать [13].
По мнению ряда исследователей, мультипробиотики имеют преимущества перед другими препаратами в связи с широким спектром действия, включающим иммунобиологический эффект, активацию антиэндотоксинового звена защиты, повышение неспецифической резистентности организма, стимуляцию функциональной деятельности желудочно-кишечного тракта [15, 16].
Одним из пробиотических средств, применяемых для профилактики и лечения ААД у детей, является Бак-Сет® Форте. В состав Бак-Сет® Форте входит 14 видов живых пробиотических бактерий в высоких концентрациях: L. casei, L. plantarum, L. rhamnosus, B. bifidum, B. breve, B. longum, L. acidophilus, L. lactis, St. thermophilus, B. infantis, L. bulgaricus, L. helveticus, L. salivarius, L. fermentum, что позволяет им достигать толстого кишечника без потери активности и жизнеспособности. Результаты исследования кислотоустойчивости пробиотических штаммов при pH=2 в течение двух часов подтвердили их высокую жизнеспособность. Щадящая технология производства — фильтрация вместо центрифугирования с последующей лиофилизацией позволяет избежать разрушения оболочки бактерий, что повышает их выживаемость и устойчивость в кислой среде.
Преимущества мультипробиотического комплекса в коррекции микроэкологических нарушений в педиатрической практике показаны в ряде клинических исследований при остром гастроэнтерите, атопическом дерматите, запорах у детей [17, 18]. У детей с инфекцией, вызванной Helicobacter pylori, изучали эффективность мультипробиотика, добавленного к стандартной схеме антибактериальной терапии (АБТ). Скорость элиминации H. pylori была достоверно выше (р=0,04) в группе терапии с дополнительным применением мультипробиотика (90 против 69%). У детей, получавших вместе со стандартной терапией мультипробиотик, отмечался более низкий уровень тошноты и рвоты (р=0,02), а также диареи (р=0,039) в отсутствие серьезных нежелательных явлений [19].
Учитывая вышеизложенное, авторы провели исследование, целью которого явилась оценка протективных свойств мультипробиотического препарата в отношении развития желудочно-кишечных расстройств и нарушения микро-биоценоза на фоне АБТ у детей старше 3 лет, больных ОРИ.
В задачи исследования входило: определение частоты развития и выраженности желудочно-кишечных расстройств, а также изменений в динамике кишечного микробиоценоза (микробиоты) у детей от 3 до 7 лет, больных ОРИ и получающих АБТ, в зависимости от подключения к терапии мультипробиотического препарата.
Материал и методы
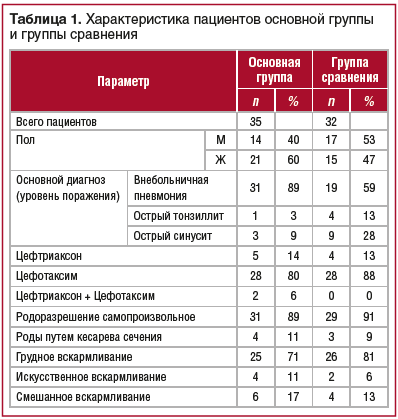
В исследовании приняли участие 67 детей обоего пола в возрасте от 3 до 7 лет, поступивших в стационар детского инфекционного отделения ГАУЗ МО «Химкинская областная больница» на 1–3-и сут заболевания ОРИ. Пациенты были разделены на 2 группы. В основную группу вошли 35 детей, получавших АБТ и пробиотик Бак-Сет® Форте; в группу сравнения — 32 ребенка, получавших только АБТ. Определяли частоту дефекации, оценивали консистенцию и форму кала по Бристольской шкале в трех точках: в первый день проведения АБТ; в день окончания АБТ (7±2 дня от начала терапии); через 14 дней после окончания АБТ (21±2 дня от начала терапии). При отсутствии стула использовали глицериновые свечи. Сравниваемые группы статистически были сходны по полу, характеру вскармливания, заболеванию (ОРИ), назначенному антибиотическому препарату, частоте стула, его оценке по Бристольской шкале, возрасту и факту использования глицериновой свечки, а также микробиотным характеристикам в точке 1 (табл. 1). Статистический анализ проводили путем попарного сравнения всех 3 временных точек. Образцы кала, собранные в 1, 2 и 3-ю временные точки, были заморожены и исследованы методом секвенирования гена 16S рРНК. Ретроспективно в каждой группе проводили сравнение изменений микробного сообщества по изменению альфа- и бета-разнообразия, произошедшему в результате терапии, изменений относительной представленности бактериальных таксонов и изменений метаболических путей и модулей микробиоты.
Альфа-разнообразие оценивали с помощью индекса Шеннона. Для сравнения образцов, взятых в одной временной точке, применяли критерий Манна — Уитни. Для сравнения образцов одной группы, взятых в разных временных точках, использовался критерий Вилкоксона. Для сравнения изменений альфа-разнообразия между двумя группами пациентов применялся метод анализа ковариаций ANCOVA.
Бета-разнообразие определяли с помощью метрики UniFrac. Расстояние рассчитано на прореженных до 5000 ридов образцах. Результаты визуализировали с помощью «метода главных координат» PCoA (Principal Coordinate Analysis). Различия между группами в одной и той же временной точке и различия между разными временными точками для одной и той же группы оценивали с помощью функции adonis в среде R. Для того чтобы выяснить, у какой группы сильнее поменялся состав микробиоты в ходе лечения, для каждого участника определяли степень различия между микробиомом в трех точках. С помощью критерия Манна — Уитни сравнивали полученные значения между экспериментальной группой и группой сравнения.
Анализ относительной представленности каждого детектированного бактериального таксона и функционального состава (относительной представленности групп генов и путей) проводили с помощью пакета ALDEx2 [20] в среде R. Для каждого исходного образца методом Монте-Карло были случайно сгенерированы 128 образцов из мультиномиального распределения Дирихле с добавлением 1/2 псевдоотсчета (pseudocount). К этим образцам применяли clr-преобразование (centered log-ratio). Для сравнения образцов, взятых в одной временной точке, применялся критерий Уэлча. Для образцов из разных временных групп — парный критерий Стьюдента, для сравнения изменений между экспериментальной группой и группой сравнения — ANCOVA. Полученные значения р были усреднены для каждой итерации генерирования. Для контроля общего уровня значимости применяли поправку Бенджамини — Хохберга на множественное сравнение — отдельно на каждом таксономическом уровне. В анализе участвовали только те таксоны, которые были представлены более чем в 15 образцах.
Для сопоставления возраста и оценки по Бристольской шкале использовали критерий Вилкоксона, для всех остальных немикробиотных факторов — критерий Фишера. Порог значимости был установлен на уровне 0,05. Поправка на множественное сравнение была сделана по методу Бенджамини — Хохберга.
Результаты исследования
При обследовании у 50 пациентов (74,6%) диагностирована внебольничная пневмония, у 5 (7%) — острый тонзиллит, у 12 (18%) — острый синусит. Течение заболевания у всех пациентов имело среднюю степень тяжести. Большинство пациентов — 56 (83,5%) — получали цефотаксим, 9 пациентов (13,4%) — цефтриаксон, у 2 детей в ходе терапии проведена смена антибактериального препарата с цефотаксима на цефтриаксон. Длительность АБТ составила от 5 до 10 дней. Сравниваемые группы были сопоставимы по основным анализируемым характеристикам до начала терапии (см. табл. 1),
а также были статистически проверены на сопоставимость по частоте стула, его оценке по Бристольской шкале, возрасту и факту использования глицериновой свечки, а также характеристикам микробиоты в точке 1.
Результаты анализа альфа- и бета-разнообразия представлены в таблице 2.

Следует заметить, что на момент включения в исследование основная группа и группа сравнения были сопоставимы по клиническим данным и составу микробиоты.
До начала АБТ ни у одного из наблюдаемых детей кратность стула не превышала 2 р./сут. Перед выпиской из стационара учащение стула (максимально до 5 р./сут) было зафиксировано у 7 пациентов (20%) основной группы и у 20 (62,5%) — группы сравнения. Через 21±2 дня от начала терапии у большинства наблюдаемых пациентов произошла нормализация частоты стула. Только у 9 детей (28%), не получавших терапию пробиотиками, и у 2 детей (5,7%) основной группы сохранялся учащенный стул до 3 р./сут максимально.
За время наблюдения был зафиксирован характер кала от 1-го до 6-го вида (7-й вид не встречался ни в одной группе). Для удобства оценки мы определяли кал с 1-го по 3-й вид как склонность к запорам, 4-й вид считали физиологическим вариантом, 5-й и 6-й вид — тенденцией к диарее. Полученные данные представлены графически на рисунке 1.
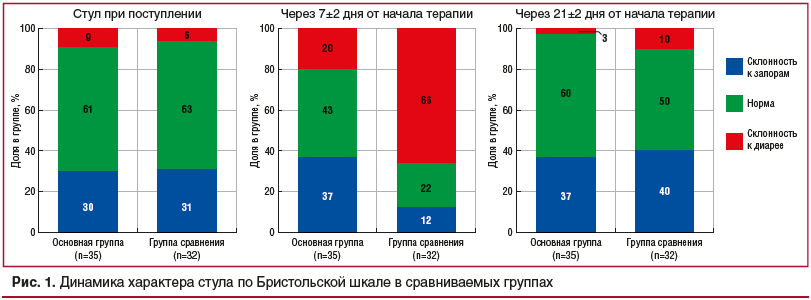
В основной группе не было обнаружено статистически значимых изменений кала по Бристольской шкале (p>0,05, парный тест Вилкоксона). В группе сравнения наблюдалось значимое увеличение баллов по Бристольской шкале через 7±2 дня от начала терапии (p=0,0127, парный тест Вилкоксона) и спад к первоначальным значениям к 21±2 дня от начала терапии (p=0,0127 при сравнении в точках t1 и t2, p=0,3040 при сравнении в точках t1 и t3).
Межгрупповое сравнение изменений консистенции кала показало, что повышение балла по Бристольской шкале в основной группе от момента включения в исследование к моменту окончания АБТ значимо меньше, чем в группе сравнения (среднее изменение баллов 1,0909 в основной группе и 0,2083 в группе сравнения, тест Манна — Уитни, p=0,0193). Снижение балла к среднему дню 21±2 от начала заболевания также значимо больше в основной группе, чем в группе сравнения (p=0,0044).
Важно отметить, что в процессе исследования ни у одного пациента основной группы не было отмечено побочных реакций на фоне применения мультипробиотического препарата.
Таким образом, в ходе проведенного исследования показано, что на фоне терапии в основной группе, получавшей мультипробиотик, не наблюдалось значимых изменений в консистенции кала, в то время как в группе сравнения в процессе приема антибиотика консистенция кала статистически значимо сместилась в область умеренной диареи.
Полученные результаты позволяют предположить, что прием мультипробиотика Бак-Сет® Форте способствует поддержанию стабильности консистенции кала в ходе антибиотикотерапии и в период восстановления после нее.
Изменение альфа-разнообразия в ходе терапии
В основной группе наблюдалось значимое увеличение альфа-разнообразия в период после окончания приема антибиотиков (от точки 2 к точке 3) (парный тест Вилкоксона, p=0,0039 в основной группе исследования). Однако эти изменения не отличались значимо от изменений в группе сравнения (ANCOVA, p=0,1633). В третьей точке альфа-разнообразие возвращалось к первоначальным значениям (p=0,2097). В группе сравнения не было найдено значимых изменений ни в одной из пар точек (рис. 2).
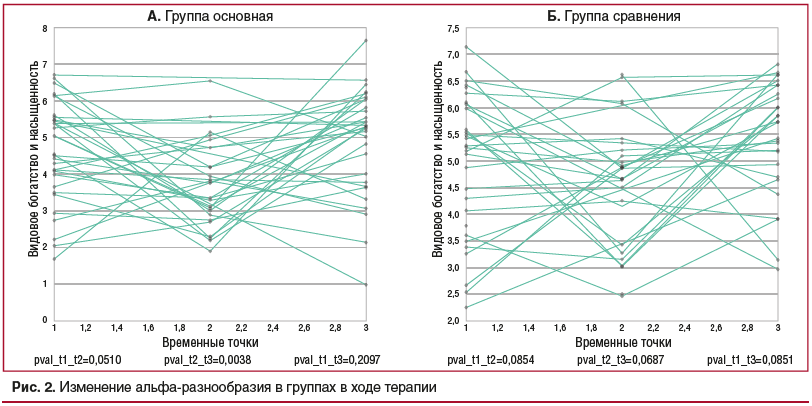
Таким образом, в основной группе, получавшей мультипробиотик с 1-го дня АБТ и еще в течение 14 дней после ее окончания, наблюдалось повышение богатства микробиоты (альфа-разнообразия) в течение периода после окончания антибиотикотерапии с достижением его значений до начала терапии. В группе сравнения таких изменений нами не зафиксировано.
Следует отметить, что степень отклонения альфа-разнообразия у пациентов была в целом небольшой во всех точках в обеих группах.
Изменение состава микробиоты в целом
Для сравнения динамики изменения состава микробиоты в сравниваемых группах в целом было вычислено бета-разнообразие (мера попарного различия; по метрике weighted UniFrac) между образцами: при поступлении до начала терапии и при выписке (через 7±2 дня от начала терапии); при поступлении до начала терапии и через 21±2 дня от начала терапии (через 14±2 дня после окончания АБТ).
Изменение состава микробиоты приведено на рисунке 3.
При сравнении полученных расстояний для сравниваемых групп с помощью теста Манна — Уитни значимых различий не обнаружено.
Важно подчеркнуть, что при анализе бета-разнообразия установлено, что ни в одной из сравниваемых групп ни в ходе АБТ, ни в период восстановления не наблюдалось значимых изменений общего состава микробиоты.
Если говорить о представленности родов Bifidobacterium и Lactobacillus в микробиоте участников, то в начале исследования их содержание было сопоставимым в трех группах. Доля Lactobacillus значимо не изменялась на протяжении всего периода наблюдения. Доля же Bifidobacterium на момент окончания АБТ в группе Бак-Сет® Форте была значимо выше, чем в группе сравнения (ANCOVA, p=0,0356) и не отличалась от таковой в группе здорового контроля. Это свидетельствует о том, что прием препарата Бак-Сет® Форте не только способствует поддержанию альфа-разнообразия кишечной микробиоты, но и влияет на соотношение видов бактерий, сохраняя нормальное количество бифидобактерий в кишечной микробиоте в ходе антибактериальной терапии.
Заключение
Таким образом, добавление мультипробиотика к АБТ протективно влияет на частоту развития желудочно-кишечных расстройств, позволяет нивелировать негативное влияние на микробиом. Данный факт установлен клинически и подтвержден с помощью инновационного метода секвенирования гена 16S рРНК образцов кала. Выявленные позитивные факты, а также отсутствие побочных реакций и хорошая переносимость препарата Бак-Сет® Форте позволяют рекомендовать его к широкому применению в педиатрической практике, особенно у детей, получающих АБТ, для эффективной профилактики нарушений желудочно-кишечного тракта и микробиома.
Информация с rmj.ru