Введение
Надпочечник содержит корковое и мозговое вещество, которое происходит из разных зародышевых листков. Таким образом, большинство первичных новообразований возникают либо из клеток коры, либо из хромаффинных клеток мозгового вещества, и опухоли надпочечников, образованные более чем одним типом клеток, встречаются редко. Даже если в надпочечнике сосуществуют два типа клеток, чаще всего образуются две отдельные опухоли. Поражения коры и мозгового вещества, сосуществующие в одной опухоли с образованием кортикомедуллярных смешанных опухолей надпочечников, встречаются довольно редко [1]. Поскольку количество случаев остается ограниченным, а исследований по этому вопросу проведено мало, механизм возникновения опухоли остается неясным [2]. На сегодняшний день в литературе описано менее 40 опухолей данного типа. Кортикомедуллярные смешанные опухоли надпочечников могут быть инциденталомами или гормонально активными образованиями, иметь различную клиническую картину в виде артериальной гипертензии, проявлений гиперкортицизма. Чаще всего они встречаются у женщин, большинство из них доброкачественные, с благоприятным прогнозом. В литературе описано ограниченное количество случаев злокачественных кортикомедуллярных опухолей надпочечников [3].
Содержание статьи
Клиническое наблюдение
Пациентка 53 лет обратилась к эндокринологу с жалобами на учащенное сердцебиение до 120 уд/мин в течение 1 года, головные боли, эпизодическое повышение артериального давления (АД) максимально до 169/120 мм рт. ст., подтвержденное результатами суточного мониторирования АД, также в течение 2 лет имели место частые эпизоды повышенной потливости в вечернее время суток, эмоциональная лабильность.
Согласно лабораторным данным: уровень свободного метанефрина в моче составил 62,55 мкг/сут (7,69–33,33 мкг/сут), уровень свободного норметанефрина в моче — 81,84 мкг/сут (7,91–35,18 мкг/сут), уровень хромогранина А — 31,859 мкг/л (0–100 мкг/л). При проведении пробы с 1 мг дексаметазона отсутствовало адекватное подавление кортизола крови, равное 74,7 нмоль/л, при нормальном уровне адренокортикотропного гормона (АКТГ) — 33,84 пг/мл (7,2–63,3 пг/мл). Уровень ренина составил 3,0 мкМЕ/мл (3,08–77,51 мкМЕ/мл), альдостерона плазмы крови — 32,1 пг/мл (25–315 пг/мл).
При проведении мультиспиральной компьютерной томографии (МСКТ) с контрастированием выявлено округ-лое неоднородное образование левого надпочечника размерами 20×17 мм, плотность в нативную фазу — 14 HU. С учетом вышеизложенных данных установлен диагноз «феохромоцитома левого надпочечника». На догоспитальном этапе инициирована терапия α-адреноблокаторами, отмененная в последующем ввиду развития гипотонии до 89/50 мм рт. ст. на фоне минимальных доз доксазозина (0,5 мг/сут). По данным позитронно-эмиссионной компьютерной томографии (ПЭТ/КТ) с 18F-DOPA всего тела подтверждено образование левого надпочечника с четкими контурами, неправильной формы, размерами 20×18×34 мм, до +26 HU, характеризующееся гиперметаболизмом DOPA, SUV 11,63.
С учетом отсутствия подавления секреции кортизола крови при проведении пробы с 1 мг дексаметазона повторно оценены: уровень АКТГ утром — 27,15 пг/мл (7,20–63,30 пг/мл), уровень кортизола крови вечером — 272,30 нмоль/л (64,00–327,00 нмоль/л), что свидетельствовало о сохранном циркадном ритме секреции кортизола. Выполнена проба с 2 мг дексаметазона — адекватного подавления продукции кортизола крови получено не было. Уровень кортизола крови составил 76,74 нмоль/л. Таким образом, появилось подозрение на эктопическую АКТГ-продукцию выявленным образованием левого надпочечника, что повышало риск развития надпочечниковой недостаточности в послеоперационном периоде. В дальнейшем выполнена лапароскопическая левосторонняя адреналэктомия. В послеоперационном периоде данных за развитие надпочечниковой недостаточности получено не было, уровень кортизола крови на 3-е сутки составил 269,7 нмоль/л и находился в пределах референсных значений (171,00–536,00 нмоль/л), АД было в пределах нормы. Пациентка выписана в удовлетворительном состоянии под наблюдение эндокринолога.
Выполнено гистологическое исследование операционного материала надпочечников. Макроскопическое описание: надпочечник с окружающей жировой клетчаткой размерами 5,8×2,4×2,1 см, массой 16,0 г. На разрезе определяется опухоль с четкими границами размерами 4,0×2,2×1,6 см, часть которой представлена серо-коричневой тканью, часть — ярко-оранжевой тканью. Граница между двумя компонентами опухоли неровная, нечеткая. Опухоль хорошо отграничена от фоновой ткани надпочечника, за пределы последнего не распространяется. Микроскопическое описание с указанием дополнительных методов исследований: в ткани надпочечника определяется четко отграниченная опухоль, представленная двумя несвязанными между собой компонентами. Первый представлен крупными клетками с вложенным паттерном роста, построен из слабополиморфных клеток с эозинофильной пенистой цитоплазмой и овальными светлыми ядрами (см. рисунок). Митотической активности опухоли, некрозов и кровоизлияний не определяется. Опухоль не распространяется за пределы капсулы, сосудистой инвазии не определяется. Второй компонент опухоли имеет солидное и вложенное строение, построен из ярко-эозинофильных и слабоэозинофильных клеток с центрально расположенными округлыми ядрами с гомогенной конденсацией хроматина. Опухоль не распространяется за пределы капсулы, фокусов некрозов и кровоизлияний не обнаружено, митотическая активность не определяется. Лимфоваскулярной инвазии нет.
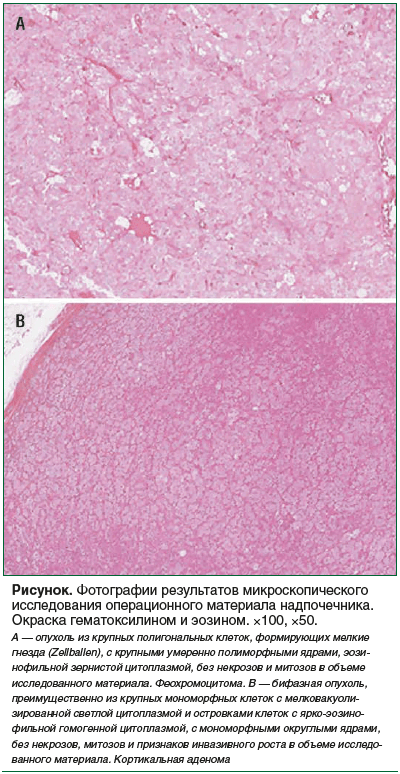
При иммуногистохимическом исследовании (ИГХИ): первый компонент опухоли имеет иммунофенотип: Syn «+», ChrA «+», MelanA «-». Второй компонент: Syn «-», ChrA «-», MelanA «+». ИГХИ продемонстрировало очаговую положительную (10% опухолевых клеток) экспрессию АКТГ тканью феохромоцитомы. Таким образом, патоморфологически верифицирована кортикомедуллярная опухоль надпочечника: феохромоцитома (GAPP 0 баллов, PASS 0 баллов) в сочетании с кортикальной аденомой (Weiss 0 баллов).
Для исключения феохромоцитомы в рамках генетического синдрома было проведено обследование для исключения множественной эндокринной неоплазии 2-го типа. Данных за медуллярный рак щитовидной железы не получено — уровень кальцитонина составил 1,92 пг/мл (5,17–9,82 пг/мл). Уровень паратиреоидного гормона (ПТГ) — 91,13 пг/мл (15–65 пг/мл), кальция ионизированного — 1,39 ммоль/л (1,11–1,29 ммоль/л), кальция общего — 2,65 ммоль/л (2,15–2,65 ммоль/л), кальция, скорректированного на альбумин, — 2,43 ммоль/л, фосфора неорганического — 1,42 ммоль/л (0,81–1,45 ммоль/л). Уровень кальция мочи за сутки составил 9,05 ммоль/сут (2,50–8,00 ммоль/сут). Концентрация 25-гидроксихолекальциферола в сыворотке крови была 43,20 нг/мл (30–100 нг/мл). С учетом повышенного уровня кальция и ПТГ при нормальном уровне 25-гидроксихолекальциферола проведено обследование с целью поиска аденомы околощитовидной железы. По данным ультразвукового исследования: область паращитовидных желез без патологических изменений. Выполнена МСКТ шеи с контрастированием, по результатам которой выявлено образование округлой формы, с достаточно четкими ровными контурами, размерами 1,0×0,5×1,1 см, располагающееся по заднему контуру каудальных отделов правой доли щитовидной железы, локально прилегая к ней. Плотность образования в нативе до +61 HU, накапливает контрастное вещество до +93 HU, при отсроченном сканировании меньше плотности щитовидной железы на 45 HU (+67 HU). Дополнительно по медиальному контуру средних отделов правой доли щитовидной железы (плотно прилегает к ней) выявлено узловое образование округлой формы, с достаточно четкими ровными контурами, плотностью до +81 HU, накапливающее контрастное вещество до 141 HU, при отсроченном сканировании меньше плотности щитовидной железы на 14 HU (+111 HU), размерами 0,4×0,35×0,5 см. По результатам обследования сложилось представление о наличии аденомы верхней правой и нижней правой околощитовидных желез. Для уточнения множественного характера поражения околощитовидных желез, исключения эктопически расположенных аденом рекомендовано проведение ПЭТ/КТ с 11С-холином в плановом порядке. Диагностированный первичный гиперпаратиреоз носил манифестный характер и клинически проявлялся в виде эритематозной гастродуоденопатии и дуоденогастрального рефлюкса.
Результаты молекулярно-генетического исследования (метод секвенирования по Сэнгеру) — выявлен вариант неопределенного значения в гене ATP2B3 (СhrX:152830536, rs1557017728, NM 021949.4:c.G3317A:p.Arg1106Gln) в гетерозиготном состоянии. Мутации генов, которые обусловливают наследственные катехоламинпродуцирующие феохромоцитомы (RET, VHL, NF1, SDHD, SDHC, SDHB), не выявлены.
Обсуждение
Смешанные кортикомедуллярные опухоли надпочечников встречаются редко. На сегодняшний день в литературе описано менее 40 случаев смешанных кортикомедуллярных опухолей надпочечников, имеются единичные описания случаев секреции этими опухолями АКТГ [3]. АКТГ-эктопированный синдром при феохромоцитоме — достаточно редкое явление, которое может привести к тяжелым проявлениям гиперкортицизма, гипокалиемии и летальному исходу [4]. В представленном клиническом наблюдении проявлений гиперкортицизма, электролитных нарушений выявлено не было. Пациентка отмечала лабильную артериальную гипертензию, тахикардию, потливость. Образование надпочечника было выявлено случайно при плановом обследовании. С учетом разнообразия клинической картины смешанных кортикомедуллярных опухолей надпочечников необходимо проведение полного гормонального обследования в рамках протокола по инциденталомам надпочечников [5]. Уникальной особенностью описанного случая является наличие как опухолевых клеток, характерных для феохромоцитомы, так и опухолевых клеток коркового слоя согласно представленным результатам гистологического и ИГХ-исследований, что и позволило классифицировать удаленное новообразование как кортикомедуллярную опухоль смешанного строения. Также, согласно данным ИГХИ, обнаружена экспрессия АКТГ в 10% опухолевых клеток. Известно, что первой линией терапии гормонально активных образований надпочечника является хирургическое лечение с соответствующей предоперационной подготовкой. Ввиду необходимости хирургической коррекции актуально в очередной раз подчеркнуть важность осведомленности клиницистов в отношении тактики ведения феохромоцитомы — тщательной предоперационной подготовки α-адреноблокаторами во избежание развития катехоламинового криза в интраоперационном периоде [6]. В случае АКТГ-эктопии, с учетом рисков развития надпочечниковой недостаточности в послеоперационном периоде, необходим контроль витальных параметров, утреннего уровня кортизола крови с целью своевременной коррекции надпочечниковой недостаточности при ее развитии.
С учетом сочетания феохромоцитомы с впервые выявленным первичным гиперпаратиреозом было проведено генетическое обследование пациентки для исключения синдрома множественной неоплазии 2-го типа. При комплексной генетической оценке на феохромоцитому и врожденный синдром неоплазий не выявлено типичных генетических мутаций, был обнаружен не-определенный вариант нуклеотидной последовательности в гетерозиготном состоянии в гене ATP2B3 с неуточненной клинической значимостью, который тем не менее может иметь отношение к фенотипу пациентки в случае получения дополнительных подтверждающих данных.
Заключение
С учетом чрезвычайно редкой природы подобной опухоли мы имеем ограниченное представление о ее долгосрочном клиническом течении. Согласно данным литературы на сегодняшний день смешанные кортикомедуллярные опухоли имеют преимущественно доброкачественное клиническое течение без случаев метастазирования. Однако ввиду ограниченности данных литературы рекомендуется долгосрочное наблюдение. Эктопическая секреция АКТГ и/или кортиколиберина опухолью может изменить проявление феохромоцитомы, что еще больше усложняет диагностику. Часто такие феохромоцитомы проявляются как синдром Кушинга с развитием тяжелых осложнений в случае отсутствия своевременной диагностики и надлежащего лечения. В связи с этим еще раз необходимо подчеркнуть важность полного гормонального обследования у больных с инциденталомами надпочечников согласно клиническим рекомендациям.
Информация с rmj.ru

