Введение
Все лекарственные препараты, поступающие в организм, проходят последовательные этапы биотрансформации (детоксикации), что повышает гидрофильность поступивших соединений и способствует их выведению. Одним из ферментов второй фазы биотрансформации ксенобиотиков является глутатион-S-трансфераза (glutathione S-transferase, GSТ), имеющая семь основных классов. Ферменты GSТ классов μ (мю) (GSТМ) и θ (тета) (GSТТ) наиболее изучены в отношении взаимосвязи их активности с развитием некоторых заболеваний. Гены ферментов (GSТТ1, GSТМ1) расположены на хромосоме 1 (1р13.3) и хромосоме 22 (22q11.2). В популяциях встречаются делеции участков генов (нулевой генотип), приводящие к потере экспрессии и активности ферментов, что повышает риск возникновения различных заболеваний [1]. Так, показано неблагоприятное влияние мутаций аллелей генов GSТТ1 и GSТМ1 на течение бронхиальной астмы [2], ишемической болезни сeрдцa у курильщиков [3] и даже устойчивости к физичeским нагрузкам [4].
Установлено, что наиболее значимым для развития онкологической патологии является нарушение функции GSTT1, GSTM1, при этом возможными факторами риска развития онкогенеза рассматриваются однонуклeотидные полиморфизмы [5]. В некоторых работах показано, что GSTM1/*0 оказывает влияние на развитие рака легких [6]. Установлена связь нулевых генотипов GSTT1 и GSTM1 с раком мочевого пузыря, первичным раком печени и пищевода [7].
Особый интерес представляет влияние полиморфизмов на предрасположенность к развитию гемобластозов. Изучению этого вопроса посвящен ряд работ как российских исследователей, так и зарубежных. Так, установлена связь между полиморфными вариантами GSТТ1, GSТМ1 и особенностями клинического течения острого лейкоза [8], хронического миелоидного лейкоза [9, 10]. Есть работы, установившие взаимосвязь наличия нулевого генотипа GSТМ1 и повышенного риска развития острого лимфобластного и острого миелоидного лейкозов у детей [11, 12]. Также российскими исследователями показано, что наличие полиморфизмов в генах биотрансформации может вносить как вклад в формирование острых лейкозов, так и влиять на частоту и особенности рецидивов [13]. В работах В.А. Овсепян и соавт. [14] на примере европеоидной группы детей России при изучении воздействия полиморфизмов генов GSТМ1 на риск развития классических миелопролиферативных заболеваний не было установлено их влияния, но при гомозиготном носительстве нулевого аллеля GSТТ1 отмечался повышенный риск их развития. Нулевой генотип GSТМ1 ассоциирован с повышенным риском развития острого миелоидного лейкоза у жителей Восточной Азии, но среди европеоидов риски развития лейкоза выше у лиц с нулевым генотипом GSTT1 [15]. Вместе с тем установлены и известны этнические особенности в распространенности генетических полиморфизмов GSТ. Частота нулевого генотипа GSTM1 выше у людей азиатской и европеоидной расы по сравнению с людьми негроидной расы [16], а в популяции юго-восточной Мексики она составляет до 31%; в турецкой популяции изменчивость полиморфизмов GSTТ1 и GSTМ1 аналогична полученным данным в популяциях Центральной Азии, Европы и Ближнего Востока [17, 18]. Имеются различия в частоте генотипов GSTM1 и GSTT1 между коренными этносами и русскими в Северной Сибири [19], однако между русской и бурятской этнической группами статистически значимых отличий не выявлено [20]. Таким образом, наличие этнической, межпопуляционной вариабельности частот аллелей генов детоксикации и ограниченное количество исследований, в том числе на территории Восточно-Сибирского региона, определили цель данной работы.
Цель исследования: изучить особенности генетических полиморфизмов GSTТ1 и GSTМ1 у детей Восточно-Сибирского региона и их возможную ассоциацию с развитием острых лейкозов.
Содержание статьи
Материал и методы
В исследовании приняли участие 82 ребенка, больных острым лимфобластным лейкозом (основная группа), находившихся на обследовании и лечении в онкогематологическом отделении ГБУЗ ИГОДКБ. Группу контроля составили 227 здоровых студентов медицинского колледжа. Все обследуемые принадлежали к этнической группе русских. Группы были сопоставимы по полу. Средний возраст пациентов основной группы составил 5,59±4,57 года, контрольной группы — 19,6±1,6 года. Контрольная группа здоровых добровольцев была выбрана в связи с достоверным отсутствием у них гемобластоза и иного онкогематологического заболевания ранее. Проведение настоящего исследования одобрено локальным этическим комитетом ФГБOУ ВO ИГMУ Минздрава России (протокол № 3 от 2018 г.).
Определение делеционных полиморфизмов в генах глутaтион-S-трансфераз GSTT1 и GSTM1 человека осуществлялось с помощью набора реагентов «AмплиСенс® GSTT1/GSTM1-EPh» (Россия) методом полимеразной цепной реакции (ПЦР) с электрофоретической детекцией продуктов амплификации в агарозном геле. Молекулярно-генетические исследования проводились на базе «НИИБМТ ИГМУ». Материалом для проведения ПЦР послужили пробы ДНК, выделенные из образцов буккального эпителия. Образцы взяты после получения информированного согласия добровольца или его законного представителя. Для экстракции ДНК использовали комплект реагентов «РИБО-преп» («АмплиСенс», Россия), рекомендованный ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, в соответствии с инструкцией. Выделенную ДНК хранили при температуре -70 °С и непосредственно использовали для постановки ПЦР с электрофоретической детекцией на амплификаторе «БИС» (Россия). C пробами ДНК проводили реакцию амплификации фрагментов генов GSTT1 и GSTM1, содержащих делеционные полиморфизмы, при помощи специфических праймеров и фермента Тaq-полимеразы. В качестве внутреннего контроля использовали ген aльбумина (ALB) (после амплификации фрагмент присутствовал всегда). Приготовление реакционных смесей проводили согласно инструкции к набору реагентов. Общий объем реакционной смеси составил 25 мкл, включая объем пробы ДНК 10 мкл. Программа амплификации включала этапы: удерживание температуры 95 °С — 5 мин, циклирование 1: 95 °С — 15 с, 60 °С — 15 с, 72 °С — 20 с, число циклов — 45; циклирование 2: 72 °С — 2 мин, число циклов — 1. Анализ продуктов амплификации проводили разделением фрагментов ДНК в агарозном геле в соответствии с инструкцией к используемому комплекту реагентов. Разделение фрагментов проводили в агарозном геле толщиной около 0,6 см с концентрацией агарозы 1,7%. Количество продукта амплификации, вносимого в лунку, — 5 мкл. В каждом ряду дорожек геля обязательно присутствовал положительный контроль ПЦР (К+) и маркер молекулярных масс ДНК. Интерпретацию результатов ПЦР-исследования проводили по наличию или отсутствию на электрофореграмме специфических полос aмплифицированной ДНК. Длина специфических полос амплифицированных фрагментов ДНК составляла: GSТТ1 — 459 п.н., GSТМ1 — 219 п.н., АLB — 350 п.н. Интерпретация результатов анализа полиморфизма в генах GSTT1 и GSTM1 проводилась по отсутствию (-) и/или наличию (+) в дорожке полосы:
-
-459 п.н. и +350 п.н. — делеция в гене GSТТ1 в гомозиготном состоянии.
-
+459 п.н. и +350 п.н. — не обнаружено делеции в гене GSТТ1 в гомозиготном состоянии.
-
-219 п.н. и +350 п.н. — делеция в гене GSТМ1 в гомозиготном состоянии.
-
+219 п.н. и +350 п.н. — не обнаружено делеции в гене GSТМ1 в гомозиготном состоянии.
В дорожке, сooтветствующей положительному контролю этапа ПЦP (К+), + трех на уровне 459, 350 и 219 п.н.
Полоса 350 п.н. должна быть во всех пробах, содержащих ДНК человека.
Результаты ПЦР-исследования считались статистически значимыми, если были получены правильные результаты для положительного и отрицательного контроля амплификации и отрицательного контроля экстракции ДНК.
Статистический анализ проведен с помощью языка программирования R для статистической обработки данных и работы с графикой [21]. Различия в распределении частот генотипов GSTT1 и GSTM1 в группах оценивали согласно критерию χ2 при уровне значимости p<0,05. Согласно сочетаниям делеций и их распределению в исследуемых группах определяли отношение шансов (ОШ) и его 95% доверительный интервал (95% ДИ). Значимость различий оценивали согласно точному критерию Фишера при уровне значимости p<0,05. Точный критерий Фишера был выбран в связи с количеством случаев в группе (менее 5).
Результаты и обсуждение
Генетический полиморфизм GSТ класса тета включает два аллеля — функционально активный GSTT1-active и делеционный (нулевой) GSTT1-null, связанные с отсутствием у гомозигот или снижением активности фермента у гетерозиготных носителей. Установлено, что частота встречаемости функционально активного генотипа являлась преобладающей как у пациентов с лейкозом, так и у здоровых представителей группы контроля: 82,9 и 80,18% соответственно Делеция GSTT1 была редкой в обеих группах и составляла в основной группе 17,07%, в группе контроля — 19,82% (табл. 1).
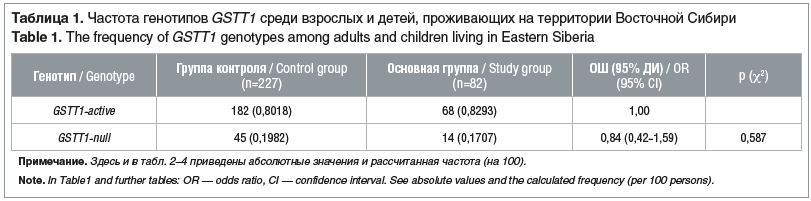
При расчете ОШ развития заболевания острым лейкозом у детей в зависимости от делеций GSTT1 статистически значимых отличий нами получено не было (pχ2>0,05). В то же время в популяции Саудовской Аравии нулевой генотип GSTT1 достоверно чаще выявлен при хроническом миелоидном лейкозе, в то время как при изучении полиморфизмов GSTM1 таких данных получено не было [22]. Также значимую ассоциацию между развитием острого лейкоза и аллелями GSTT1 получили в этнической группе жителей Узбекистана [23]. Есть сведения, что нулевые генотипы GSTT1 связаны с повышенным риском лейкозов у коренных жителей Восточной Азии, установлены комбинированные дефекты двух генов — с повышенным риском развития лейкозов у индейцев [24].
Известно, что нулевой генотип GSTM1 распространен преимущественно среди европеоидов (до 60,9%) и монголоидов (до 58%) [25]. При анализе полученных нами данных оказалось, что функционально активный и делеционный аллели GSTM1 встречались одинаково часто в обеих группах: GSTM1-active — с частотой 46,34% при лейкозах и 50,66% — у здоровых обследуемых. Частота встречаемости делеции GSTМ1 в основной группе составила 53,66%, в группе контроля — 49,34% (табл. 2).
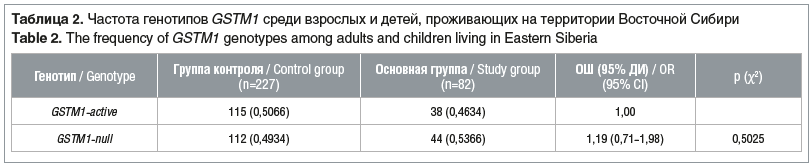
Полученные результаты совпадают с проведенными ранее исследованиями среди коренных жителей Восточной Сибири: в работах Е.В. Беляевой и соавт. [20] показано, что делеционный генотип GSTM1 у русской этнической группы встречается в 44,7% случаев. Это характеризует изучаемую нами популяцию как генетически стабильную и сопоставимую по статистической выборке. Согласно полученным расчетам, шансы развития заболевания лейкозом при гомозиготной делеции гена GSTM1 не имеет статистической значимости (pχ2>0,05).
Было показано, что нулевой генотип GSTM1 ассоциируется с меньшим риском развития острого лейкоза у аргентинских детей (ОШ 0,31, р=0,013) [26]. В других исследованиях установлена статистически значимая ассоциация между нулевым генотипом GSTM1 и повышенным риском острого миелоидного и лимфобластного лейкоза у детей [27, 12]. В ряде работ на примере жителей Восточной Азии и европейских жителей доказан риск развития острого миелоидного лейкоза при наличии нулевых генотипов сразу двух полиморфных генов GSTT1 и GSTM1 [15]. В связи с этим нами проведен анализ по сочетанному распределению функциональных и нулевых генотипов в изучаемых группах (табл. 3).
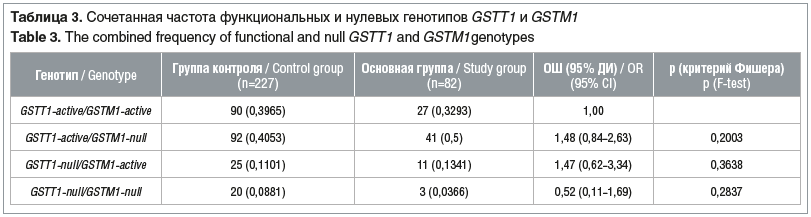
При расчете оказалось, что частота встречаемости сочетания делеций в обоих генах составляла 3,66% в группе больных и 8,81% в группе контроля. Делеция только в гене GSTT1 встречалась в 13,41% случаев в основной группе и 11,01% — в группе контроля, делеция только в гене GSTM1 — соответственно в 50,0 и 40,53% случаев. Гомозиготные генотипы, определяющие нормальную работу ферментов, встречались в 32,93 и 39,65% случаев. При анализе сочетаний гомозиготных делеций в генах GSTT1 и GSTM1 статистически значимых различий между группами здоровых и пациентов с острыми лейкозами не выявлено (p>0,05).
Определенный научный интерес представляет сравнение полученных данных с мировыми данными в различных популяциях (табл. 4).
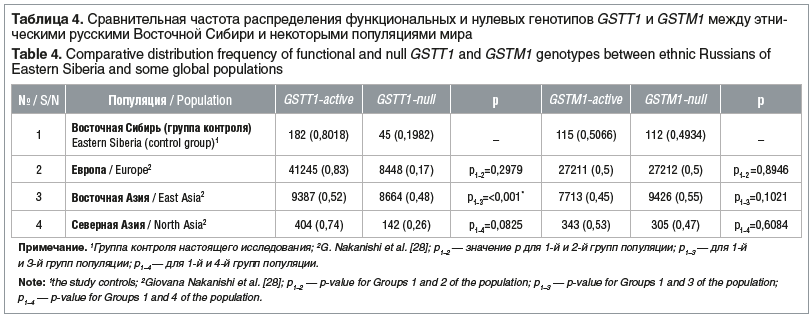
При сравнении данных распределения нулевого генотипа GSTT1 среди здоровых жителей выявлены значимые различия: 19,8% для популяции Восточной Сибири и 48% — для Восточной Азии (χ2=70,21, df=1, p<0,001). Частота нулевого генотипа в популяциях Европы, Северной Азии и Восточной Сибири приблизительно одинаковая и составляет 17, 26 и 19,8% соответственно, в отношении показателей генотипа GSTM1 значимых различий с популяциями Европы, Восточной и Северной Азии нами не выявлено (p>0,05) [28].
Считаем, что противоречивые данные по ассоциации риска развития заболеваний лейкозами с генотипами GSTM1 и GSTT1 могут быть связаны с этническими факторами и в связи с этим необходимо дальнейшее изучение для расчета как риска заболевания, так и возможной фармакогенетической терапии.
Выводы
-
Частота встречаемости функционального генотипа GSTT1 у европеоидной этнической группы Восточно-Сибирского региона преобладает и составляет 80,18% в общей популяции и 82,93% у пациентов с острыми лимфобластными лейкозами.
-
Частота делеций в гене GSTM1 (GSTM1-null) одинакова в группах здоровых и детей с острыми лимфобластными лейкозами.
-
Распространенность делеции в гене GSTT1 (GSTТ1-null) в популяции жителей Восточной Азии существенно выше в сравнении с территорией Сибири, что обусловлено этническим составом населения.
-
Делеции генов GSTM1 и GSTT1 не ассоциированы с риском развития острого лимфобластного лейкоза у детей европеоидной этнической группы Восточно-Сибирского региона.
Сведения об авторах:
Съемщикова Юлия Павловна — к.м.н., доцент кафедры педиатрии и детской хирургии ДПО ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; ORCID iD 0000-0001-9049-0450
Степаненко Лилия Александровна — к.м.н., ассистент кафедры детских болезней и детских инфекций ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; ORCID iD 0000-0002-5792-7283
Перетолчина Надежда Павловна — старший преподаватель кафедры медицинской биологии ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; ORCID iD 0000-0001-9426-5197
Бокова Татьяна Алексеевна — д.м.н., доцент, в.н.с., руководитель отделения педиатрии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; профессор кафедры педиатрии с инфекционными болезнями у детей ФДПО ИНОПР ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-6428-7424
Барзунова Татьяна Владимировна — ассистент кафедры педиатрии и детской хирургии ДПО ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; ORCID iD 0000-0002-2799-5680
Козлов Юрий Андреевич — д.м.н., член-корр. РАМН, заведующий кафедрой педиатрии и детской хирургии ДПО ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; главный врач ГБУЗ ИГОДКБ; 664022, Россия, г. Иркутск, б-р Гагарина, 4; ORCID iD 0000-0003-2313-897X
Малов Сергей Игоревич — д.м.н., проректор по научной работе, доцент кафедры инфекционных болезней ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; ORCID iD 0000-0002-3135-4616
Толмачева Ольга Петровна — врач-гематолог, онколог отделения онкогематологии ГБУЗ ИГОДКБ; 664022, Россия, г. Иркутск, б-р Гагарина, д. 4; ORCID iD 0000-0003-0472-7605
Умнова Светлана Юрьевна — врач-онколог, гематолог отделения онкогематологии ГБУЗ ИГОДКБ; 664022, Россия, г. Иркутск, б-р Гагарина, д. 4; ORCID iD 0000-0002-2876-76280
Биляк Юлия Сергеевна — врач-онколог отделения онкогематологии ГБУЗ ИГОДКБ; 664022, Россия, г. Иркутск, б-р Гагарина, д. 4; ORCID iD 0009-0008-1190-5477
Ованесян Светлана Викторовна — врач-гематолог, онколог отделения онкогематологии ГБУЗ ИГОДКБ; 664022, Россия, г. Иркутск, б-р Гагарина, д. 4; ORCID iD 0009-0002-3050-3808
Малов Игорь Владимирович — д.м.н., профессор, заведующий кафедрой инфекционных болезней ФГБОУ ВО ИГМУ Минздрава России; 664003, Россия, г. Иркутск, ул. Красного Восстания, д. 1; ORCID iD 0000-0002-0122-4618
Контактная информация: Съемщикова Юлия Павловна, e-mail: jsemshikova@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.03.2024.
Поступила после рецензирования 02.04.2024.
Принята в печать 25.04.2024.
About the authors:
Yulia P. S’emshchikova — C. Sc. (Med.), Assistant Professor of the Department of Pediatrics and Pediatric Surgery, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; ORCID iD 0000-0001-9049-0450
Liliya A. Stepanenko — C. Sc. (Med.), Teaching Assistant of the Department of Pediatric Diseases and Infections, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; ORCID iD 0000-0002-5792-7283
Nadezhda P. Peretolchina — Senior Teacher of the Department of Medical Biology, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; ORCID iD 0000-0001-9426-5197
Tatiyana A. Bokova — Dr. Sc. (Med.), Assistant Professor, Leading Researcher, Head of the Department of Pediatrics, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; Professor of the Department of Pediatrics and Pediatric Infections, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-6428-7424
Tatiyana V. Barzunova — Teaching Assistant of the Department of Pediatrics and Pediatric Surgery, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; ORCID iD 0000-0002-2799-5680
Yurii A. Kozlov — Dr. Sc. (Med.), Associate Member of the Russian Academy of Medical Sciences, Head of the Department of Pediatrics and Pediatric Surgery, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; Chief Medical Officer, Irkutsk State Regional Children’s Clinical Hospital; 4, Gagarin blvd., Irkutsk, 664022, Russian Federation; ORCID iD 0000-0003-2313-897X
Sergey I. Malov — Dr. Sc. (Med.), Vice Rector for Research, Assistant Professor of the Department of Infectious Diseases, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; ORCID iD 0000-0002-3135-4616
Olga P. Tolmacheva — hematologist, oncologist of the Department of Oncohematology, Irkutsk State Regional Children’s Clinical Hospital; 4, Gagarin blvd., Irkutsk, 664022, Russian Federation; ORCID iD 0000-0003-0472-7605
Svetlana Yu. Umnova — oncologist, hematologist of the Department of Oncohematology, Irkutsk State Regional Children’s Clinical Hospital; 4, Gagarin blvd., Irkutsk, 664022, Russian Federation; ORCID iD 0000-0002-2876-76280
Yulia S. Bilyak — oncologist of the Department of Oncohematology, Irkutsk State Regional Children’s Clinical Hospital; 4, Gagarin blvd., Irkutsk, 664022, Russian Federation; ORCID iD 0009-0008-1190-5477
Svetlana V. Ovanesyan — hematologist, oncologist of the Department of Oncohematology, Irkutsk State Regional Children’s Clinical Hospital; 4, Gagarin blvd., Irkutsk, 664022, Russian Federation; ORCID iD 0009-0002-3050-3808
Igor V. Malov — Dr. Sc. (Med.), Professor, Head of the Department of Infectious Diseases, Irkutsk State Medical University; 1, Krasnogo Vosstaniya str., Irkutsk, 664003, Russian Federation; ORCID iD 0000-0002-0122-4618
Contact information: Yulia P. S’emshchikova, e-mail: jsemshikova@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 07.03.2024.
Revised 02.04.2024.
Accepted 25.04.2024.
Информация с rmj.ru



