Содержание статьи
Введение
Бронхиальная астма (БА) — сложное гетерогенное хроническое воспалительное заболевание, имеющее высокую распространенность среди всех возрастных групп. По крайней мере 360 млн людей во всем мире страдают БА [1]. В Российской Федерации, по данным эпидемиологического исследования, распространенность БА среди взрослых составляет 6,9%, а среди детей и подростков — около 10% [2].
За последние десятилетия на порядок выросла доля пациентов с контролируемым течением БА: с 5% в 1999 г. (AIRE) до 55% в 2014 г. (REALISE) [3]. Эта положительная тенденция связана прежде всего с развитием фармакотерапии БА, внедрением протоколов лечения в клиническую практику и увеличением числа больных, получающих базисную терапию препаратами ингаляционных глюкокортикостероидов (ИГКС), комбинаций ИГКС с β2-агонистами длительного действия (ДДБА). Однако при этом остается значительной доля пациентов, у которых не достигается контроль БА даже в условиях контролируемых клинических исследований [4]. По данным исследования REALISE, около 45% пациентов имели неконтролируемую астму, а 44% нуждались в применении системных глюкокортикостероидов в течение последнего года, 24% обращались за неотложной медицинской помощью и 12% были госпитализированы по поводу обострений БА в течение предыдущего года [5]. Среди этой категории особый интерес представляют пациенты с тяжелой БА, которые составляют небольшую (5–10%), но сложную группу больных, зачастую рефрактерных к традиционной терапии, с высокой частотой обострений (в 20 раз чаще, чем при легкой и средней степени тяжести БА), госпитализаций, незапланированных визитов к врачу (в 15 раз чаще), обращений за медицинской помощью [3]. Тяжелая БА поглощает 50% всех экономических затрат, выделяемых на заболевание в целом [3]. Только сохраняющееся отсутствие контроля после устранения факторов, влияющих на достижение контроля (коррекция терапии, техника ингаляции, исключение других диагнозов, повышение приверженности лечению), говорит о действительно тяжелой БА. Сниженный ответ на ИГКС часто встречается у пациентов с различными фенотипами [4, 6]. Считается, что примерно 25% больных БА не отвечают на действие ИГКС [7]. Опубликованы данные о возможных нежелательных эффектах, связанных с приемом ИГКС: инфекциях (пневмонии, кандидоз голосовых связок и полости рта, туберкулез, микобактериоз), системных эффектах ИГКС (остеопороз, катаракта и глаукома, надпочечниковая недостаточность), локальных эффектах ИГКС (дисфония) [6, 8–10].
В публикациях последних лет все чаще встречается информация о связи ИГКС с инфекциями. Так, исследователи показали значимую взаимосвязь между использованием ИГКС и риском развития микобактерий у пациентов с хроническими заболеваниями органов дыхания (БА и ХОБЛ) [11].
Zhang et al. [12] обнаружили почти четырехкратное увеличение количества Streptococcus pneumoniae в верхних дыхательных путях у детей с БА при использовании ИГКС. McKeever et al. [13] указали на повышенный риск пневмонии или инфекций нижних дыхательных путей у пациентов с БА в возрасте 18–80 лет при использовании ИГКС, особенно в больших дозах. Другие исследователи обнаружили, что с использованием ИГКС связаны такие осложнения, как снижение плотности костной ткани, глазная гипертензия, возникновение и прогрессирование диабета, подавление роста у детей и снижение иммунитета [14–16]. Установлено, что более высокие дозы ИГКС увеличивают риски развития пневмонии [17]. Ряд ученых из Испании и США выявили, что иммуносупрессивное и противовоспалительное действие ИГКС может влиять на патогенез пневмонии и клинические проявления и, наоборот, их противовоспалительное действие может играть роль вспомогательной терапии при тяжелой пневмонии [18].
Клиническая эффективность низких доз ИГКС по сравнению с высокими дозами
На сегодняшний день ИГКС являются первой линией лечения пациентов с персистирующей БА, имеют хороший профиль эффективности и безопасности [6]. Ряд исследователей оценивали клиническую эффективность разных доз ИГКС [19–21]. В обзоре РКИ Adams et al. показано, что при использовании средних доз ИГКС пациенты достигают контроля БА, сопоставимого с контролем при применении высоких доз ИГКС [22]. В РКИ, проведенных с участием детей и подростков, были показаны схожие результаты [19–21]. Эти и многочисленные другие исследования легли в основу изменений рекомендаций по терапии БА GINA, 2019 г. [6]. Предпочтительная контролирующая терапия (для предотвращения обострений и контроля симптомов) представлена двумя подходами, каждый из которых включает 5 шагов, направленных на увеличение лечебной нагрузки до достижения контроля БА (рис. 1).
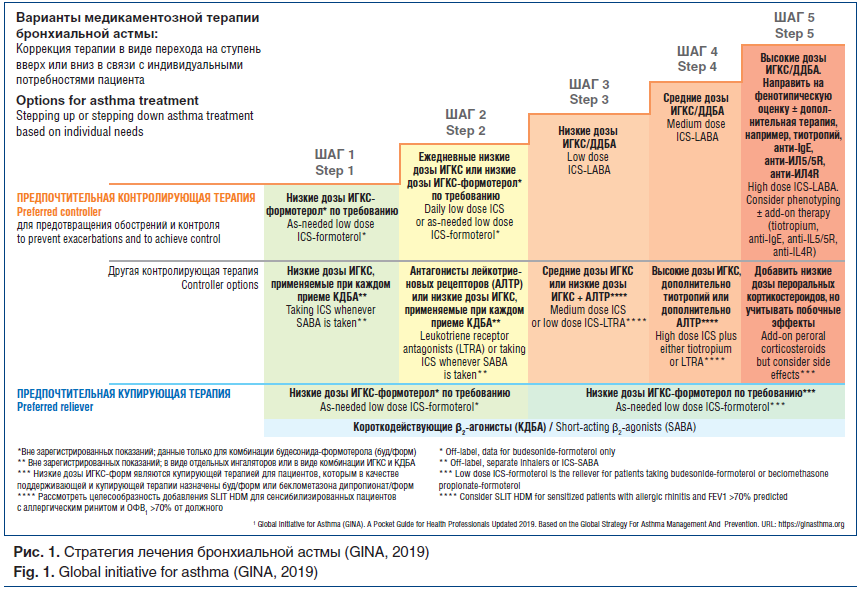
Надо отметить, что в РФ Федеральные клинические рекомендации (2018) предлагают использовать антихолинергический препарат длительного действия тиотропий на шаге 3: низкие дозы ИГКС + тиотропий (тиотропий в ингаляторе, содержащем раствор, зарегистрирован в РФ для лечения пациентов с 6 лет с сохраняющимися симптомами на фоне приема ИГКС или ИГКС/ДДБА). Показание к применению было зарегистрировано в РФ в 2014 г. для взрослых и в 2017 г. для детей.
Роль ацетилхолина в патогенезе бронхиальной астмы
Значимость холинергических сигналов в патофизиологии БА хорошо известна. Стимуляция парасимпатических нервов приводит к бронхоконстрикции, вазодилатации, гиперсекреции слизистых желез [23]. Все эти эффекты осуществляются через мускариновые рецепторы М1, М2 и М3, обнаруженные в дыхательных путях человека [24].
Максимальная плотность M3-рецепторов отмечается в крупных дыхательных путях, поэтому парасимпатическая иннервация контролирует тонус, главным образом, центральных отделов бронхиального дерева [25]. На долю центральных бронхов приходится примерно 90% от общего сопротивления дыхательных путей. Поэтому даже незначительное изменение тонуса центральных бронхов может привести к существенному изменению общего сопротивления дыхательных путей [26].
Ряд факторов могут вызывать повреждение или вовсе устранение М2-рецепторов, что может приводить к дополнительному усилению парасимпатической бронхоконстрикции, т. е. к повышенному высвобождению ацетилхолина (АЦХ). Ими могут быть нейраминидаза вирусов, интерфероны, медиаторы эозинофилов, ирританты (табачный дым) [27].
В целом повышение парасимпатического тонуса при БА обусловлено несколькими механизмами [28]: избыточной афферентной стимуляцией в результате воспалительного процесса в нижних дыхательных путях, нарушенной экспрессией мускариновых рецепторов, увеличенным высвобождением АЦХ из парасимпатических нервных окончаний и снижением уровня нейромодуляторов, уменьшающих парасимпатический тонус. Таким образом, дисфункция холинергической нервной системы принимает значимое участие в патофизиологических механизмах при БА, поэтому применение антихолинергических препаратов длительного действия является обоснованным и патогенетически значимым.
Механизм действия тиотропия бромида при БА
Тиотропий является представителем II поколения антихолинергических препаратов. Тиотропий блокирует действие АЦХ на гладкие мышцы бронхов, ингибируя их сокращение. Преимуществами тиотропия перед другими антихолинергическими препаратами служат его высокая специфическая селективность и сродство с мускариновыми рецепторами. Его сродство с М-рецепторами выше, чем ипратропия бромида, в 6–20 раз [29]. Связываясь со всеми тремя типами М-рецепторов, тиотропий быстро высвобождается из связи с М2-рецептором, что позволяет считать его селективным по отношению к М1- и М3-рецепторам, диссоциация связи с которыми медленная [30]. Этот факт определяет длительность его действия (более 24 ч) и возможность применения 1 р./сут, что значительно повышает приверженность пациентов лечению (рис. 2).
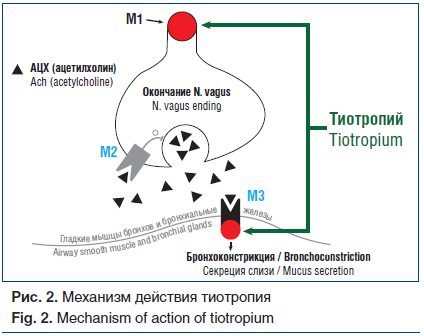
Эффект препарата развивается достаточно быстро, что обусловлено преимущественно местным (дыхательные пути), а не системным действием [31]. Приблизительно 40% от величины ингаляционной дозы осаждается в легких [32]. Низкая степень всасывания со слизистой оболочки дыхательных путей (менее 20%) обеспечивает тиотропию низкий риск развития системных побочных эффектов, т. е. достаточно высокую безопасность [30].
Тиотропий также уменьшает продукцию слизи в дыхательных путях и ремоделирование бронхиальной стенки, оказывает противовоспалительный эффект в отношении эозинофильного и нейтрофильного воспаления [32–34]. Таким образом, механизм действия тиотропия при БА заключается не только в ингибировании М3-рецепторов в дыхательных путях, расслаблении гладкой мускулатуры и снижении бронхиальной гиперреактивности, но и в противовоспалительном влиянии и уменьшении ремоделирования бронхов[28].
Для доставки тиотропия в дыхательные пути разработан уникальный жидкостный ингалятор Респимат®. Достоинством этого ингаляционного устройства является простая ингаляционная техника, хорошая координация (не требуется синхронизации вдоха или особого маневра, доступна детям с 6 лет), которая обеспечивает высокую доставку препарата в дыхательные пути. Двигаясь медленно, частицы аэрозоля из устройства Респимат® чаще избегают столкновения с задней стенкой глотки и языком, что снижает депозицию препарата в полости рта и глотки, тем самым значительно увеличивая его легочную депозицию [35]. При этом около 55% дозы тиотропия в ингаляторе Респимат® выделяется в виде частиц диаметром 1–5 мкм, что также обеспечивает высокую легочную депозицию [36]. Респимат® на сегодняшний день считается одним из наиболее совершенных средств доставки препаратов в дыхательные пути, в т. ч. у детей и подростков.
Клинические исследования применения тиотропия бромида
Действие тиотропия при БА изучалось по крайней мере в 13 РКИ (более 5100 больных БА). Эффективность добавления к проводимой терапии тиотропия Респимат® у взрослых пациентов с отсутствием контроля БА, несмотря на лечение, включающее ИГКС/ДДБА, изучалась в 3 РКИ, в т. ч. в исследовании PrimoTinA-asthma® [37] (48-недельное плацебо-контролируемое исследование). Дизайн: тиотропий Респимат® 5 мкг 1 р./сут или плацебо Респимат® 1 р./сут + высокие дозы ИГКС + ДДБА. Результаты исследования: улучшение легочной функции при терапии тиотропием на 24-й нед. (пикового ОФВ1(0–3ч) до 154 мл и минимального ОФВ1 до 111 мл); вероятность улучшения контроля БА на 48-й нед. на 68% больше по сравнению с плацебо; снижение риска тяжелых обострений БА на 21% и снижение риска ухудшения БА на 31%; профиль безопасности сопоставим с профилем безопасности плацебо.
Исследования у подростков и детей
RubaTinA-asthma® (2016): 398 пациентов подросткового возраста (12–17 лет) с БА средней тяжести, получающих средние дозы ИГКС + АЛТР. Дизайн: тиотропий Респимат® 5 мкг 1 р./сут, или тиотропий Респимат® 2,5 мкг 1 р./сут, или плацебо Респимат® 1 р./сут + средние дозы ИГКС ± АЛТР. Результаты: значимое улучшение легочной функции на 24-й нед. при терапии тиотропием; улучшение до 174 мл пикового ОФВ1(0–3ч),улучшение минимального ОФВ1 при применении тиотропия 5 мкг (117 мл) и AUC(0–3ч) при применении обеих доз (до 181 мл); улучшение ответа пиковой максимальной объемной скорости 25–75%
на 24-й нед. и ответа пиковой скорости выдоха на 24-й и 48-й нед. при терапии тиотропием; относительная доля пациентов с ответом на лечение в соответствии с ACQ-6 и ACQ-7 выше в обеих группах приема тиотропия; профиль безопасности сопоставим с профилем безопасности плацебо. Вывод: тиотропий Респимат® в дополнение к поддерживающей терапии способствовал значимому улучшению функции легких, контроля симптомов БА, а также качества жизни. При этом наибольший эффект достигается при использовании дозы 5 мкг/сут. Безопасность и переносимость тиотропия Респимат® сопоставимы с профилем безопасности и переносимости плацебо [38].
CanoTinA-asthma® (2016): 403 пациента (6–11 лет) с БА средней тяжести с выраженными симптомами, получающих средние дозы ИГКС ± АЛТР. Дизайн: тиотропий Респимат® 5 мкг 1 р./сут, или тиотропий Респимат® 2,5 мкг 1 р./сут, или плацебо Респимат® 1 р./сут + средние дозы ИГКС ± АЛТР. Результаты: улучшение легочной функции на 24-й нед. при применении тиотропия (пикового ОФВ1(0–3ч) на 170 мл и 164 мл и минимального ОФВ1 на 116 мл и 118 мл для тиотропия в дозах 5 мкг и 2,5 мкг соответственно); улучшение показателей легочной функции, выявленное на 24-й нед., сохранялось до 48-й нед.; на 24-й нед. более 80% пациентов, получавших тиотропий, считались ответившими на лечение; профиль безопасности сопоставим с профилем безопасности плацебо [39].
PencieTinA-asthma® (2016): 392 пациента (12–17 лет) с тяжелой БА, получающих высокие/средние дозы ИГКС с одним контролирующим препаратом и более (ДДБА, АЛТР и др.). Дизайн: тиотропий Респимат® 5 мкг 1 р./сут, или тиотропий Респимат® 2,5 мкг 1 р./сут, или плацебо Респимат® 1 р./сут. Вывод: у подростков с тяжелой БА тиотропий Респимат 5 мкг/сут можно рассматривать в качестве опции для увеличения объема терапии. Безопасность и переносимость тиотропия сопоставимы с безопасностью и переносимостью плацебо [39].
Особый интерес представляет исследование безопасности тиотропия у детей дошкольного возраста (1–5 лет) при симптоматической персистирующей БА, выполненное Bisgaard et al. (2016). Дизайн: тиотропий Респимат® 5 мкг, или тиотропий Респимат® 2,5 мкг, или плацебо Респимат® в качестве дополнения к стандартной терапии в течение 12 нед. Заключение: применение тиотропия 1 р./сут в виде дополнения к стандартной терапии хорошо переносится и может уменьшить обострения у детей дошкольного возраста (1–5 лет) с неконтролиру-
емой БА [40].
Тиотропий Респимат® демонстрирует универсальность в достижении контроля, он одинаково эффективен независимо от фенотипа БА [37].
Kerstjens et al. оценили эффективность и безопасность тиотропия Респимат® в сравнении с салметеролом при среднетяжелой и тяжелой БА (233 центра, 14 стран), не контролируемой средними дозами ИГКС. Было показано, что у пациентов с тяжелой БА тиотропий улучшает функцию легких и уменьшает риск обострения при добавлении к ИГКС [41].
В недавнем обзоре проведено сравнение влияния тиотропия, ДДБА и АЛТР на функцию легких и обострения у детей и подростков (4–17 лет) с БА в качестве дополнения к лечению ИГКС. В этих исследованиях тиотропий и ДДБА обеспечили большее улучшение функции легких по сравнению с АЛТР, чем плацебо в качестве такого дополнения к ИГКС. Профиль безопасности тиотропия сопоставим с профилем безопасности плацебо [42].
Несмотря на использование предпочтительной контролирующей терапии (включая ИГКС с ДДБА или без ДДБА), значительная часть больных БА имеют недостаточный контроль заболевания и подвержены риску повторных симптомов и обострения астмы [6]. Это вызывает снижение качества жизни, увеличивает бремя БА [43] и оказывает негативный экономический и социальный эффект [44]. Поэтому важно выбрать соответствующее
лечение БА для достижения хорошего контроля симптомов и минимизировать риск обострений. Дополнительная терапия тиотропием 5 мкг продлевала время до первого обострения БА по сравнению с плацебо, что соответствовало снижению риска на 21% (отношение рисков 0,79; 95% ДИ 0,62–1,00; р=0,03). Таким образом, показано, что у взрослых с симптоматической тяжелой БА, несмотря на терапию ИГКС/ДДБА, дополнительная терапия тиотропием уменьшает сезонные пики обострения БА, обеспечивая годичный период ремиссии [45].
В резолюции Совета экспертов Педиатрического респираторного общества (2017) рекомендуется добавить тиотропий Респимат® в дозе 5 мкг/сут к базисной (контролирующей) терапии среднетяжелой и тяжелой БА у детей и подростков в возрасте 6 лет и старше, у которых не достигается контроль БА при монотерапии ИГКС в средних/высоких дозах или комбинацией ИГКС/ДДБА в средних/высоких дозах [46]. Добавление тиотропия (например, Спирива® Респимат®) к терапии БА, включающей ИГКС, является предпочтительным и безопасным вариантом увеличения объема терапии по сравнению с увеличением дозы ИГКС до высоких независимо от фенотипа заболевания [46]. Тиотропий Респимат® сопоставим с ДДБА по бронхолитическому эффекту, при этом тиотропий оказывает бронхопротективное действие у пациентов с особенностями заболевания (вызываемые респираторными вирусными инфекциями обострения, постнагрузочный бронхоспазм, признаки вегетативной дисфункции, выраженные ночные симптомы) или триггерными факторами (воздействие табачного дыма) [46]. Оценку эффективности тиотропия Респимат® следует проводить не ранее чем через 3 мес. от начала терапии [46].
Собственные результаты
Нами проведено собственное наблюдательное исследование [47], целью которого являлась оценка функционального состояния детей с БА после применения Спирива® Респимат® в течение 3 мес. в условиях реальной клинической практики. В исследование были включены 12 детей в возрасте 6–11 лет, страдающих БА средней и тяжелой степени с недостаточным контролем БА при монотерапии ИГКС в средних/высоких дозах или комбинацией ИГКС/ДДБА в средних/высоких дозах. Этим пациентам добавляли Спирива® Респимат® в дозе 5 мкг/сут. Эффективность оценивали путем мониторинга пиковой скорости выдоха (ПСВ), ОФВ1 до введения бронходилататора, симптомов БА, потребности в бронходилататорах короткого действия (КДБА) и количества обострений. Контроль БА и качество жизни оценивались с помощью опросников (ACT, ACQ и AQLQ соответственно). Результаты исследования. На 1-м визите: ПСВ 54,8±1,7%; суточная вариабельность ПСВ 35,3±2,3%; ФЖЕЛ 58,4±9,6% от нормы; ОФВ1 62,3±4,7%; ОФВ1 (среднее значение) 1,629 л, увеличение максимального ОФВ1 (среднее значение) +0,263 л. Дневные симптомы за неделю — 4,7±2,9 балла; ночные симптомы — 3,2±2,1 балла. Потребность в КДБА за неделю — 6,2±3,9. Средний балл по АСТ: 19 (16–23) (от 0 до 25). Средний общий балл по ACQ: 2,71±1,9 (от 0 до 6). Средние суммарные баллы по AQLQ (от 1 до 7) составили 5,31±1,05 для контролируемых пациентов, 5,01±0,68 для частично контролируемых и 4,03±0,35 для неконтролируемых пациентов (p<0,001). На 2-м визите (через 3 мес.): ПСВ 92,5±2,7%; суточная вариабельность ПСВ 7,8±1,6%; ФЖЕЛ 84,2±7,2% от нормы; ОФВ1 80,4±2,6%; ОФВ1 (среднее значение) 2,869 л; увеличение максимальной ОФВ1 (среднее значение) +0,422 л. Дневные симптомы за неделю — 1,4±2,1 балла; ночные симптомы — 1,0±0,9 балла. Потребность в КДБА за неделю — 2,2±1,8. Средний балл по АСТ: 21 (19–25). Средний общий балл по ACQ: 2,71±1,9. Средний общий балл по AQLQ: 5,65±0,49. Обострений заболевания за период наблюдения не отмечено. Побочных явлений не наблюдалось. В то же время терапевтический успех был достигнут без увеличения доз ИГКС у каждого пациента. Нами сделан вывод: у детей с умеренной и тяжелой БА при добавлении к поддерживающей терапии Спирива® Респимат® (5 мкг) улучшаются функция легких и качество жизни, уменьшаются выраженность симптомов и частота обострений [47].
Заключение
Резюмируя вышесказанное, подчеркнем, что антихолинергический препарат длительного действия тиотропий (например, Спирива® Респимат®) рекомендован к применению у взрослых и детей старше 6 лет экспертами GINA, Российского респираторного общества и Педиатрического респираторного общества. Текущие подходы к терапии БА не позволяют добиться успеха у всех пациентов, поэтому тиотропий (например, Спирива® Респимат®) становится новым инструментом достижения контроля БА.
Благодарность
Публикация осуществлена при поддержке компании ООО «БЕРИНГЕР ИНГЕЛЬХАЙМ» в соответствии с внутренней политикой и действующим законодательством РФ. ООО «БЕРИНГЕР ИНГЕЛЬХАЙМ», его работники либо представители не принимали участия в написании настоящей статьи, не несут ответственности за содержание статьи, а также за любые возможные относящиеся к данной статье договоренности либо финансовые соглашения с любыми третьими лицами. Мнение ООО «БЕРИНГЕР ИНГЕЛЬХАЙМ» может отличаться от мнения автора и редакции.
Acknowledgement
The publication is supported by LLC “Boehringer Ingelheim” according to the internal policies and existing legislation. LLC “Boehringer Ingelheim”, its employees or representatives did not participate in the writing of this paper and are not responsible for either content or any financial or other agreements with third parties regarding this paper. Boehringer Ingelheim’s view can be different from that of the authors and Editorial Board.
Сведения об авторе:
Чурюкина Элла Витальевна — к.м.н., доцент, ORCID iD 0000-0001-6407-6117.
ФГБОУ ВО РостГМУ Минздрава России. 344022, Россия,
г. Ростов-на-Дону, Нахичеванский пер., д. 29.
Контактная информация: Чурюкина Элла Витальевна, e-mail: echuryukina@mail.ru. Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.12.2019.
About the author:
Ella V. Churyukina — MD, PhD, Assistant Professor, ORCID iD 0000-0001-6407-6117.
Rostov State Medical University. 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation.Contact information: Ella V. Churukina, e-mail: echuryukina@mail.ru. Financial Disclosure: the author doesn’t have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.12.2019.
Информация с rmj.ru






