Введение
Фенилкетонурия (ФКУ, PKU; OMIM 261600) — наследственное заболевание обмена веществ, характеризующееся высокой концентрацией фенилаланина (ФА) в крови вследствие изменений в гене фенилаланингидроксилазы (ФАГ) (Phenylalanine hydroxylase (РАН); ЕС1.14.16.1). ФАГ катализирует превращение ФА в тирозин с помощью кофермента тетрагидробиоптерина [1]. Впервые неонатальный скрининг на ФКУ был организован в 1962 г. в штате Массачусетс (США) Робертом Маккриди совместно с Робертом Гатри, который разработал метод тестирования сухих пятен крови. В России массовый неонатальный скрининг на ФКУ введен в 1993 г. Нейротоксические эффекты накопления ФА у пациентов, страдающих ФКУ, хорошо известны. Коррекция диеты может предотвратить такие исходы за счет поддержания концентрации ФА крови в пределах определенного безопасного диапазона — 120–360 мкмоль/л [2].
С 60-х годов прошлого столетия разработана и доказана высокая эффективность диетотерапии, и на сегодняшний день диета включает в себя использование небольшого количества натурального белка в зависимости от переносимости, специализированных продуктов лечебного питания (СПЛП), в частности аминокислотных смесей (АКС), без ФА, а также заменителей белка (в ряде стран — пероральных добавок с микроэлементами). СПЛП часто называют заменителями белка или «Формулой», их назначают после постановки диагноза в рамках программы массового обследования новорожденных в среднем с возраста 7 дней пожизненно. Такой подход в лечении может использоваться самостоятельно или в комбинации с введением кофермента ФАГ (дигидрохлорида сапроптерина) [3]. Контрольными показателями в процессе лечения и диетотерапии служат уровни ФА и тирозина в плазме крови.
Тирозин играет ключевую роль в лечении ФКУ, являясь условно-незаменимой аминокислотой для пациентов с этим заболеванием. При ФКУ нарушается преобразование ФА в тирозин, что приводит к его дефициту в организме [4]. Для компенсации этого дефицита пациентам с ФКУ рекомендуется принимать 4–6 г тирозина в день, а беременным женщинам с ФКУ — до 7,6 г в день[1].
Лечение ФКУ является непростой задачей, и, несмотря на успешное предотвращение неврологических нарушений, появляется все больше информации о долгосрочных последствиях лечения этого диетозависимого заболевания, включая нарушение кислотно-щелочного баланса, низкую минеральную плотность костной ткани и нарушение функции почек [5–7]. Исследования показали, что большинство АКС с нулевым содержанием ФА характеризуются высоким показателем потенциальной почечной кислотной нагрузки (Potential Renal Acid Load, PRAL), что увеличивает экскрецию кальция и магния, способствуя повышению риска остеопороза и метаболической нефропатии [8, 9]. Кроме этого, у взрослых пациентов с ФКУ часто встречаются такие нарушения, как избыточная масса тела и гастроэнтерологические заболевания [10]. Это также может быть связано с кислым составом заменителей белка, потенциально способным подкислять весь рацион [11]. Исследование, опубликованное в 2017 г. [8], рассматривает влияние АКС и гликомакропептидных лечебных продуктов (ГЛП) на кислотную нагрузку организма у пациентов с ФКУ. Авторы выявили, что большинство АКС для ФКУ обусловливают в 1,5–2,5 раза более высокий уровень PRAL по сравнению с ГМП. Там же отмечена повышенная экскреция кальция (на 40%) и магния (на 30%) у пациентов, принимающих АКС, в отличие от ГЛП, которые обладают более щелочным эффектом. У двух участников исследования отмечена низкая минеральная плотность костной ткани [8]. Таким образом, большинство АКС без ФА оказывают выраженное закисляющее воздействие на организм, что может негативно сказываться на костной системе пациентов с ФКУ [10, 11].
В настоящее время ассортимент СПЛП постоянно расширяется, в том числе и благодаря современным высокоэффективным технологическим процессам. Актуальным стал вопрос индивидуального подхода в организации диетотерапии1. Правильный персонифицированный подбор СПЛП имеет решающее значение в предотвращении осложнений, формировании адекватного психосоматического, интеллектуального и социального статуса [12]. Большое внимание уделяют органолептическим свойствам СПЛП, так как доля суточного потребления такого продукта достигает 80% от общего рациона пациента [13]. Большой ассортимент СПЛП позволяет подобрать АКС без ФА с адекватным для возраста пациента белковым эквивалентом, количеством тирозина. Помимо тирозина, АКС должны содержать оптимальное количество других незаменимых и заменимых аминокислот, витаминов, минералов и микроэлементов для различных возрастных групп, учитывая их специфические потребности1.
С этой целью итальянской компанией DMF Pharma FoodAR Srl разработана линейка СПЛП АнтиФен с составом, характеризующимся отрицательным значением PRAL для нормализации кислотно-щелочного баланса пациентов с ФКУ.
Формула расчета PRAL для аминокислотных смесей: PRAL = (2 × (0,00503 × мг метионина)) + (2 × (0,0062 × мг цистеина)) + (0,037 × мг фосфора) + (0,0268 × мг хлорида) — (0,021 × мг калия) — (0,026 × мг магния) — (0,013 × мг кальция) — (0,0413 × мг натрия).
Продукты различаются содержанием белка на 100 г смеси в соответствии с возрастными потребностями (табл. 1). Макро- и микронутриентный состав продуктов сбалансирован по аминокислотам, обогащен всеми необходимыми витаминами — А, В1, В2, В6, В12, С, D, Е, К, РР, пантотеновой и фолиевой кислотами, биотином, инозитом, L-карнитином, холином, а также минеральными веществами (натрий, калий, кальций, магний, фосфор, медь, йод, марганец, железо, цинк) с учетом физиологических потребностей разного возраста.
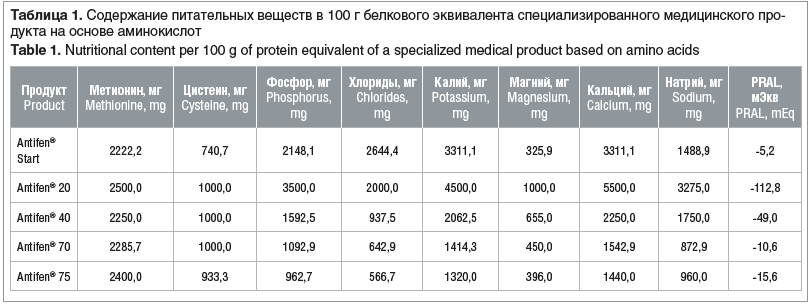
В связи с появлением данной линейки СПЛП на отечественном рынке мы решили провести исследование, целью которого было оценить эффективность, безопасность и переносимость СПЛП линейки АнтиФен/AntiFen® у детей и взрослых, больных ФКУ. Выведение чистой почечной кислоты и биомаркеров обновления костной ткани в рамках настоящего исследования не оценивали, так как это требует более длительного наблюдения.
Содержание статьи
Материал и методы
Проведено открытое одноцентровое проспективное нерандомизированное неконтролируемое исследование. Работа проводилась с 09.10.2023 по 20.03.2024 на базе ФГБНУ «МГНЦ». Клиническая апробация проведена в соответствии с основополагающими этическими нормами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации, трехстороннем соглашении по надлежащей клинической практике (ICH GCP), Рекомендациях Комитета по этике, осуществляющего экспертизу биомедицинских исследований ВОЗ и EFGCP (2000 г.), письме Минздрава России от 01.09.2016 № 28-1/2406, а также в соответствии с действующим законодательством и международными нормативными актами.
Критерии включения: диагноз классической ФКУ (МКБ-10 Е70.0), установленный на основании клинических, биохимических и молекулярно-генетических данных; подписанное пациентом или его законным представителем информированное согласие на участие в исследовании.
Критерии исключения: индивидуальная непереносимость исследуемого продукта (ИП); отказ родителя пациента от участия в клинической апробации или отзыв информированного согласия; развитие нежелательных явлений, препятствующих дальнейшему проведению терапии; возникновение острых сопутствующих соматических заболеваний/симптомов или обострение хронических заболеваний, не связанных с применением продукта (по усмотрению врача-исследователя).
В исследование включили 29 пациентов в возрасте от 3 мес. до 31 года, получавших СПЛП линейки АнтиФен/AntiFen® в зависимости от возраста:
АнтиФен СТАРТ / AntiFen® START для детей первого года жизни (ИП-1) — 5 пациентов (3 мальчика и 2 девочки) в возрасте от 3 до 8 мес.;
АнтиФен 20 / AntiFen® 20 для детей старше 1 года (ИП-2) — 5 пациентов (3 мальчика, 2 девочки) в возрасте от 11 мес. до 2 лет 8 мес.;
АнтиФен 40 / AntiFen® 40 для детей старше 1 года (ИП-3) — 4 пациента (2 мальчика и 2 девочки) в возрасте от 4 лет до 7 лет 7 мес.;
АнтиФен 70 / AntiFen® 70 для детей старше 1 года и взрослых (ИП-4) — 6 пациентов (3 мальчика и 3 девочки) от 7 до 16 лет включительно;
АнтиФен 75 / AntiFen® 75 для детей старше 1 года и взрослых, в том числе беременных женщин (ИП-5) — 9 пациентов (4 пациента мужского пола и 5 пациентов женского пола) в возрасте от 15 лет до 31 года.
Все продукты выпускаются в виде сухой смеси и имеют нейтральный вкус.
Оценку клинической эффективности и безопасности проводили в соответствии с принципами надлежащей клинической практики на основании динамики уровня ФА и тирозина и данных по частоте и тяжести нежелательных явлений на фоне приема ИП.
Пациенты принимали СПЛП амбулаторно. Длительность приема составила 30±2 дня. Протоколом было предусмотрено два визита к врачу-исследователю: визит включения (визит 1) в день 0 и визит в конце апробации (визит 2) в день 30±2.
Во время обоих визитов проводили сбор анамнестических и клинических данных, определяли содержание ФА и тирозина в крови. На визите 2 оценивали безопасность ИП и удовлетворенность терапией.
Сбор и анализ жалоб, анамнеза жизни и болезни осуществляли путем непосредственного опроса пациентов или их родителей и анализа медицинской документации. Оценка соматического статуса предусматривала осмотр пациента с определением общего состояния, состояния кожи и слизистых, проводилась оценка функций отдельных органов и систем. Выявляли наличие/отсутствие аллергических реакций, диспепсических явлений, отказ от употребления ИП.
Анализ физического развития у детей с рождения до 18 лет проводили с использованием модулей программ WHO Anthro и WHO AnthroPlus по антропометрическим показателям — массы и длины тела. Измеряли эти показатели с помощью электронных весов и ростомеров.
Всем пациентам на визите 1 был назначен ИП, проведен расчет питания с постепенным переводом с применяемого СПЛП на ИП в соответствии с клиническими рекомендациями Минздрава России1.
Для определения содержания ФА использовали периферическую кровь, взятую на бланк-фильтр (форма № 903). Анализ осуществляли флуориметрическим методом. Рекомендуемый безопасный показатель ФА крови у детей 0–12 лет на фоне приема СПЛП должен составлять 2–6 мг/дл, у детей старше 12 лет и взрослых — 2–10 мг/дл1.
Уровень тирозина определяли методом тандемной масс-спектрометрии с использованием сертифицированного набора NeoBase MS/MSkit (Perkin Elmer, Финляндия). Референсные значения уровня тирозина крови составляют: у детей от 8 дней до 6 мес. — 10–300 мкмоль/л, старше 6 мес. — 15–235 мкмоль/л.
Во время визита 2 оценивали степень удовлетворенности родителей пациентов и врача-исследователя диетотерапией при помощи шкалы Лайкерта: 1 — «Нет, не удовлетворен»; 2 — «По большей части нет»; 3 — «Удовлетворен, но только до некоторой степени»; 4 — «По большей части удовлетворен»; 5 — «Полностью удовлетворен».
Статистическая обработка. Интервальные (количественные) данные были оценены на соответствие закону нормального распределения с помощью критерия Шапиро — Уилка и на основании полученных данных представлены в виде медианы, нижнего и верхнего квартилей (Me [Q1; Q3]), минимума и максимума (min–max). Категориальные (качественные) данные представлены в виде абсолютных и относительных (%) частот. Сравнение групп по непрерывным параметрам проводили с помощью непараметрического критерия Манна — Уитни. Уровень статистической значимости различий был принят равным 5% (р=0,05).
Результаты исследования
Исходная антропометрическая характеристика пациентов представлена в таблице 2.
![Таблица 2. Антропометрическая характеристика пациентов, Me [Q1; Q3] (min–max) Table 2. Anthropometric characteristics of patients, Me [Q1; Q3] (min–max) Таблица 2. Антропометрическая характеристика пациентов, Me [Q1; Q3] (min–max) Table 2. Anthropometric characteristics of patients, Me [Q1; Q3] (min–max)](https://medblog.su/wp-content/uploads/2025/03/1741604219_559_Otsenka-klinicheskoj-effektivnosti-PRAL-optimizirovannyh-spetsializirovannyh-produktov-dlya-dieticheskogo-lechebnogo-pitaniya.png)
Анализ содержания ФА выявил его снижение на фоне приема всех ИП (табл. 3).
![Таблица 3. Динамика уровня ФА в крови (мг/дл) на фоне приема ИП, Me [Q1; Q3] (min–max) Table 3. Changes of PA level in blood (mg/dl) during SD intake, Me [Q1; Q3] (min–max) Таблица 3. Динамика уровня ФА в крови (мг/дл) на фоне приема ИП, Me [Q1; Q3] (min–max) Table 3. Changes of PA level in blood (mg/dl) during SD intake, Me [Q1; Q3] (min–max)](https://medblog.su/wp-content/uploads/2025/03/1741604219_912_Otsenka-klinicheskoj-effektivnosti-PRAL-optimizirovannyh-spetsializirovannyh-produktov-dlya-dieticheskogo-lechebnogo-pitaniya.png)
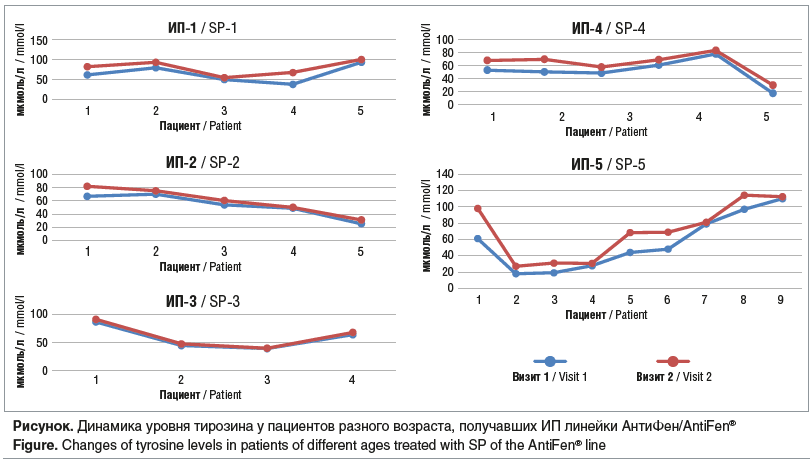
Кроме того, у всех пациентов на визите 2 было выявлено повышение уровня тирозина относительно визита 1 (табл. 4, см. рисунок).
![Таблица 4. Динамика уровней тирозина (мкмоль/л) на фоне приема ИП, Me [Q1; Q3] Table 4. Dynamics of tyrosine levels (μm/l) during SP intake, Me [Q1; Q3] Таблица 4. Динамика уровней тирозина (мкмоль/л) на фоне приема ИП, Me [Q1; Q3] Table 4. Dynamics of tyrosine levels (μm/l) during SP intake, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/03/1741604219_963_Otsenka-klinicheskoj-effektivnosti-PRAL-optimizirovannyh-spetsializirovannyh-produktov-dlya-dieticheskogo-lechebnogo-pitaniya.png)
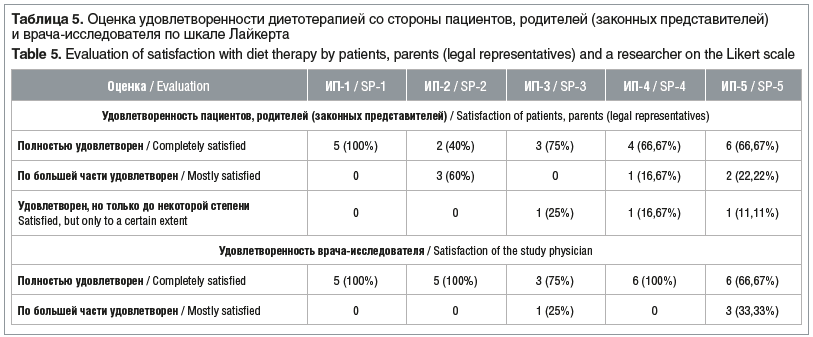
При использовании всех ИП никто из пациентов не отказался от их приема. Большинство семей были полностью удовлетворены или большей частью удовлетворены качеством продукта. Удовлетворенность врача-исследователя также была на довольно высоком уровне (табл. 5).
Ни у одного пациента не было зарегистрировано клинически значимых отклонений от нормы по результатам физикального обследования и измерения жизненно важных показателей.
Заключение
В настоящее время обеспечение максимальной эффективности медицинской помощи пациентам с ФКУ, по сути, невозможно без адекватного подбора СПЛП, не только отвечающих органолептическим потребностям пациента и не вызывающих нежелательных явлений, но и снижающих риски метаболической нефропатии и системного остеопороза.
Представленные результаты клинической апробации продемонстрировали высокую эффективность и отличную переносимость специализированных смесей линейки АнтиФен/AntiFen®, что выражалось в значимом снижении уровня фенилаланина и стабилизации уровня тирозина у всех пациентов. Смеси АнтиФен/AntiFen® полностью соответствуют установленным требованиям к СПЛП для пациентов с наследственными нарушениями обмена ФА.
Ключевым преимуществом этой линейки является использование формул с отрицательным PRAL, что способствует поддержанию кислотно-щелочного баланса и снижению риска развития долгосрочных метаболических осложнений, включая остеопороз и нефропатии. Внедрение продуктов АнтиФен/AntiFen® в клиническую практику может рассматриваться как перспективное направление в диетотерапии пациентов с ФКУ, направленное на улучшение качества жизни пациентов, минимизацию сопутствующих метаболических нарушений и снижение нагрузки на систему здравоохранения.
Сведения об авторах:
Елена Андреевна Шестопалова — ассистент кафедры организации здравоохранения, общественного здоровья и медико-генетического мониторинга, врач-генетик ИВиДПО ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0002-8137-0921
Байдакова Галина Викторовна — к.б.н., заведующая Центром коллективного пользования «Метаболом», доцент кафедры биохимической генетики и наследственных болезней обмена веществ ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0001-8806-5287
Куцев Сергей Иванович — академик РАН, д.м.н., профессор кафедры медицинской генетики ИВиДПО ФГБНУ «МГНЦ», директор ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0002-3133-8018
Контактная информация: Елена Андреевна Шестопалова, e-mail: elshest@mail.ru
Источник финансирования: исследование проведено при поддержке ООО «Медресурс».
Конфликт интересов отсутствует.
Статья поступила 20.12.2024.
Поступила после рецензирования 10.01.2025.
Принята в печать 30.01.2025.
About the authors:
Elena A. Shestopalova — Assistant Professor at the Department of Healthcare Organization, Public Health and Medical Genetic Monitoring, genetic scientist at the Institute of Higher and Additional Professional Education;
Research Center for Medical Genetics; 1, Moskvorechye str., Moscow, 115522, Russian Federation; ORCID iD 0000-0002-8137-0921
Galina V. Baydakova — C. Sc. (Bio.), Head of the Center for Collective Use «Metabolom», Associate Professor of the Department of Biochemical Genetics and Hereditary Metabolic Diseases, Research Center for Medical Genetics; 1, Moskvorechye str., Moscow, 115522, Russian Federation; ORCID iD 0000-0001-8806-5287
Sergey I. Kutsev — Academician of the Russian Academy of Sciences, Dr. Sc. (Med.), Professor of the Department of Medical Genetics at the Institute of Higher and Additional Professional Education, Director, Research Center for Medical Genetics; 1, Moskvorechye str., Moscow, 115522, Russian Federation; ORCID iD 0000-0002-3133-8018
Contact information: Elena A. Shestopalova, e-mail: elshest@mail.ru
Funding Source: the study was conducted with the support of Medresurs LLC.
There is no conflict of interest.
Received 20.12.2024.
Revised 10.01.2025.
Accepted 30.01.2025.
[1] Клинические рекомендации. Классическая фенилкетонурия и другие виды гиперфенилаланинемии. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/482_2 (дата обращения: 10.10.2024).
Информация с rmj.ru




