Введение
Хронический эндометрит (ХЭ) является одной из частых причин нарушения репродуктивной функции. У женщин с репродуктивными потерями в анамнезе частота ХЭ составляет 52%, у пациенток с привычным невынашиванием — 70% и более [1–4].
Хронический эндометрит рассматривается как локальное воспаление эндометрия, непрерывно продолжающееся, при котором наступает дисбаланс между инфекционным агентом и иммунной системой эндометрия, что приводит к аномальному синтезу про- и противовоспалительных цитокинов [5–7].
Лечение ХЭ представляет собой непростую задачу из-за сложности определения этиологических факторов. Часто в эндометрии встречается полимикробная ассоциация (Chlamydia trachomatis, Ureaplasma spp., Enterococcus faecalis, Escherichia coli, Klebsiella spp., Streptococcus agalactiae, Atopobium vaginae, Gardnerella vaginalis); кроме того, этиологическим фактором может быть вирусная инфекция (Herpes simplex virus, Cytomegalovirus, вирус папилломы человека, энтеровирусы, аденовирусы) [2, 7, 8].
В мире не существует единого мнения по поводу эффективности лечения ХЭ антибактериальными и нестероидными противовоспалительными препаратами [4, 9, 10]. Несмотря на современные знания о природе латентно протекающего ХЭ, единого подхода к диагностике и лечению этой патологии не выработано. Постоянно идет поиск новых решений проблемы нарушения процессов в эндометрии [10].
Принимая во внимание тот факт, что при ХЭ в эндометрии формируется дисбаланс про- и противовоспалительных цитокинов, вполне обоснованным является назначение данным пациенткам иммуномодулирующей терапии. Значительными иммуномодулирующими способностями обладает местная цитокинотерапия. К этой группе препаратов относится лекарственное средство Суперлимф®[1]. Препарат Суперлимф® представляет собой комплекс природных пептидов и цитокинов (фактор, угнетающий миграцию макрофагов, интерлейкин 1, интерлейкин 6, фактор некроза опухоли, трансформирующий фактор роста). Он обладает иммуномодулирующим, противовирусным, противогрибковым и противомикробным действием и стимулирует функциональную активность клеток фагоцитарного ряда.
Цель исследования: оценить эффективность применения цитокинового препарата в качестве адъювантной терапии ХЭ у женщин с репродуктивными потерями.
Содержание статьи
Материал и методы
Проведено проспективное когортное рандомизированное клиническое исследование. Под наблюдением в Центре профилактики и лечения невынашивания беременности при СПб ГБУЗ «Родильный дом № 1» находилось 60 женщин с репродуктивными потерями в анамнезе, обратившихся на прегравидарном этапе с целью выявления возможных причин потери беременности и подготовки к предстоящей беременности. У пяти женщин потери беременности были в сроки 14–18 нед., у остальных — в ранние сроки до 10 нед.
Критерием включения в исследование было наличие умеренно выраженных и выраженных признаков ХЭ, верифицированных гистологически и иммуногистохимически.
Критерии невключения: значимая соматическая и аутоиммунная патология, аллергические реакции на белки животного происхождения, проведение внутриматочных манипуляций в течение предыдущих 6 нед. и обострение хронического сальпингоофорита в последние 6 мес.
Случайным образом пациентки были разделены на 2 группы по 30 человек: группу сравнения (средний возраст 33,5±7,5 года) и основную группу (средний возраст 32,9±7,1 года). Курс лечения ХЭ состоял из двух этапов. Первый этап включал прием пероральных антибактериальных препаратов, назначаемых в зависимости от вида выделенных микроорганизмов, согласно руководству CDC (Centers for Disease Control and Prevention) и клиническим рекомендациям Минздрава России[2] [11] (использовались цефалоспорины III поколения (цефиксим, цефотаксим), доксициклин, макролиды (джозамицин)), и системную энзимотерапию (вобэнзим), снижающую токсическую нагрузку на ЖКТ и имеющую вспомогательный характер. Пациентки группы сравнения получали только эту стандартную терапию. В основной группе дополнительно назначалась адъювантная экзогенная цитокинотерапия (Суперлимф®) ректально (25 Ед в свечах) на протяжении 20 дней. Второй этап состоял из реабилитационных мероприятий, которые проводились на протяжении двух менструальных циклов и включали симптоматическую терапию (по показаниям назначались нестероидные противовоспалительные препараты, метаболиты (цитофлавин), физиотерапевтические процедуры, гестагены (дидрогестерон)).
Все пациентки проходили микробиологическое обследование (посевы, бактериоскопия), а также исследование с использованием полимеразной цепной реакции для молекулярной идентификации возбудителя в соскобах эпителия цервикального канала и влагалища.
Содержание прогестерона в крови оценивали иммуноферментным методом в среднюю лютеиновую фазу менструального цикла (на 19–23-й дни цикла).
До лечения и через 1 мес. после окончания курса лечения выполняли контрольные исследования эндометрия (аспирационная биопсия с использованием системы Пайпель) на 21–23-й дни овариального цикла. Для изучения биоптатов эндометрия использовали стандартное гистологическое исследование с окраской гематоксилином и эозином. До настоящего времени отсутствует международный консенсус в отношении диагностических критериев ХЭ. В настоящей работе диагноз ХЭ при морфологическом исследовании устанавливали на основании наличия в эндометрии воспалительных инфильтратов, преимущественно из плазматических и лимфоидных элементов, наличия склеротических изменений сосудов и очагового фиброза стромы [12].
Иммуногистохимическое исследование проводили на парафиновых срезах по стандартному одноэтапному протоколу с использованием первичных антител (DakoCytomation, Дания) в стандартных разведениях: CD16, CD20, CD138, HLA-DR. Заключение о степени выраженности признаков ХЭ формулировалось индивидуально по совокупности данных: анамнеза, уровня исследуемых маркеров [11], морфологических признаков воспалительного процесса (фиброз, склероз сосудов, мононуклеарная инфильтрация в строме).
У всех обследованных женщин было получено письменное информированное согласие на выполнение инвазивного исследования (биопсии эндометрия), хранение блоков тканей эндометрия, проведение гистологических и иммуногистохимических исследований, использование результатов и изображений гистопатологических исследований, а также назначение индивидуального лечения ХЭ с включением адъювантной терапии.
Статистическая обработка данных была проведена с использованием пакетов статистического анализа Microsoft Office Excel 2016, Statistica v.10 Stat Soft Corporation. Численные значения анализируемых показателей при соответствии закону нормального распределения, установленном на основании расчета критерия Шапиро — Уилка, представляли в виде среднего значения (М) и стандартного отклонения (SD), в противном случае — в виде медианы (Ме) и верхнего и нижнего квартилей [Q1; Q3]. Межгрупповое сравнение выполняли с использованием U-критерия Манна — Уитни. Внутригрупповое сравнение проводили с помощью W-критерия Уилкоксона. Для сравнения качественных переменных использовали критерий χ2 Пирсона с поправкой Йейтса, при размере выборки менее 5 человек применяли односторонний критерий Фишера. Критическим уровнем статистической значимости считали p=0,05.
Результаты исследования
В структуре соматической патологии существенное место занимали заболевания щитовидной железы (узловой нетоксический зоб, диффузный нетоксический зоб, аутоиммунный тиреоидит). В основной группе они встречались у 15 (50%) женщин, в группе сравнения — у 13 (43,3%) (p>0,1). Каждая десятая пациентка имела гипотиреоз, получала заместительную терапию и на момент выполнения исследования находилась в эутиреоидном состоянии. Заболевания мочевыделительной системы (хронический цистит, хронический пиелонефрит, мочекаменная болезнь) наблюдались у 5 (16,7%) женщин основной группы и у 10 (33,3%) — группы сравнения (p>0,1), заболевания органов дыхания (хронические синуситы, тонзиллиты, бронхиты) — у 4 (13,3%) и 9 (30%) пациенток соответственно (p=0,08). Наличие в анамнезе герпесвирусной инфекции отмечали 8 (26,7%) женщин в основной группе и 12 (40%) — в группе сравнения (p>0,1).
Среди гинекологических заболеваний преобладал хронический сальпингоофорит: у 8 (26,7%) женщин в основной группе и у 10 (33,3%) — в группе сравнения (p>0,1). Синдром поликистозных яичников выявлен у 3 (10%) женщин в основной группе и у 4 (13,3%) — в группе сравнения (p=0,288), лейомиома матки (до 3 см) — у 4 (13,3%) и 3 (10%) пациенток соответственно (p=0,288). Нарушение менструального цикла в основной группе отмечали 7 (23,3%) пациенток, в группе сравнения — 6 (20%) (p>0,1). У 4 (13,3%) пациенток в основной группе и у 2 (6,7%) — в группе сравнения проводилось гистероскопическое удаление полипов эндометрия (p=0,238).
На момент обследования хронические заболевания в обеих группах были компенсированы.
Как видно из таблицы 1, статистически значимо чаще привычное невынашивание беременности наблюдалось у пациенток группы сравнения. У всех женщин при потере беременности проводилось выскабливание полости матки. По количеству абортов, срочных и преждевременных родов группы были сопоставимы.

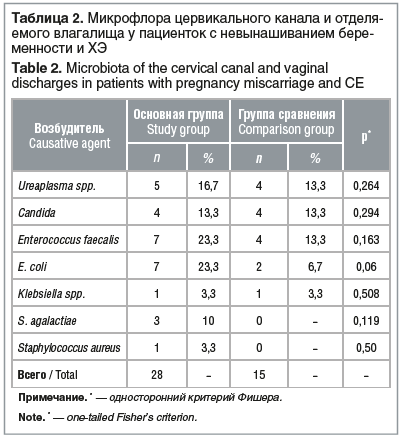
Условно-патогенная флора в диагностически значимом титре (≥104 КОЕ/л) выявлена у 18 (60%) пациенток в основной группе и у 13 (43,3%) — в группе сравнения (p>0,1) (табл. 2), Сочетание двух и более возбудителей наблюдалось у 7 (23,3%) и у 2 (6,7%) обследованных соответственно (p=0,06).
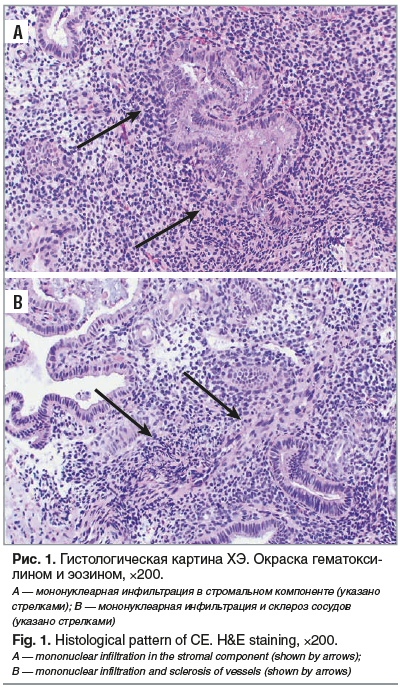
При анализе гистологической картины биопсии эндометрия у всех пациенток в обеих группах была выявлена умеренная лимфоидная инфильтрация в строме. У 5 (8,3%) пациенток отмечено утолщение стенок спиральных артерий, у 4 (6,7%) — железистый полип эндометрия, у 3 (5,0%) — инфильтрация вокруг сосудов, у 5 (8,3%) — очаговый фиброз, у 17 (28,3%) — скопления лимфоцитов в виде фолликулов (рис. 1).
В целом у 25 (41,7%) из 60 женщин диагностирована неполноценность секреторной трансформации эндометрия: у 13 (43,3%) в основной группе и у 12 (40%) в группе сравнения (χ2=0,069, p>0,1), при этом только у 6 (24%) из 25 содержание прогестерона в крови в день исследования эндометрия соответствовало 14,5 [12,1; 15,0] нмоль/л, что было статистически значимо ниже, чем у 35 женщин с эндометрием, соответствующим дню цикла (24,5 [19,0; 30,5] нмоль/л, p<0,001), и свидетельствовало о гормональной недостаточности желтого тела. Выявленная недостаточность лютеиновой фазы цикла (НЛФ) служила основанием для назначения дидрогестерона в прегравидарном периоде [13]. Установленная неполноценная секреторная трансформация эндометрия у 19 (76%) из 25 женщин, возможно, связана с нарушением экспрессии рецепторов прогестерона в эндометрии, так как уровень этого гормона в крови соответствовал овуляторному циклу и был равен 26 [21,1; 32,5] нмоль/л, что было сопоставимо со значениями гормона у женщин с эндометрием, соответствующим дню цикла, в котором проводилось исследование (p=0,394).
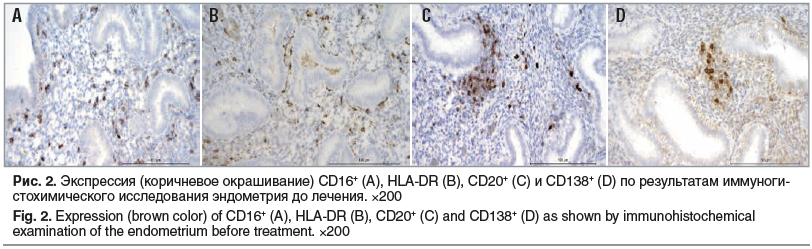
По данным иммуногистохимического исследования в основной группе у 16 (53,3%) пациенток выявлены признаки умеренно выраженного ХЭ, у 14 (46,7%) — выраженной степени ХЭ, в группе сравнения — у 21 (70,0%) и 9 (30,0%) соответственно (рис. 2, 3).
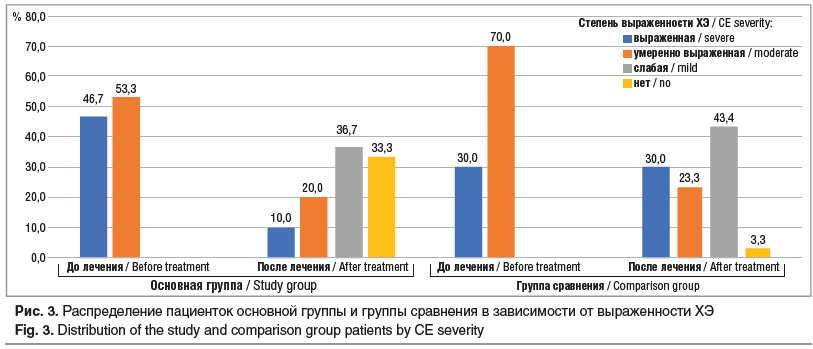
Исследование показало, что включение цитокинотерапии в курс лечения ХЭ у пациенток с невынашиванием в анамнезе привело к значительным изменениям. Так, лечение ХЭ без эффекта в основной группе было только у 6 (20,0%) пациенток, в группе сравнения — у 14 (46,7%) (у 9 пациенток было лечение без эффекта — показатели выраженности воспаления не изменились, а у 5 — ухудшились). У 70% в основной группе показатели выраженности воспаления в эндометрии уменьшились. В группе сравнения степень выраженности воспаления уменьшилась только у 46,7%. В группе с цитокинотерапией у каждой третьей (33,3%) пациентки признаки активности ХЭ не выявлены, в группе сравнения признаки ХЭ не выявлены только у 1 (3,3%) женщины.
На фоне цитокинотерапии выявлено снижение частоты выраженного ХЭ с 46,7 до 10,0%, тогда как в группе сравнения данный показатель остался прежним (30%) (см. рис. 3). Применение цитокинотерапии позволило снизить частоту ХЭ с умеренной степенью выраженности в 2,7 раза (с 53,3 до 20,0%). В группе сравнения также отмечено снижение частоты ХЭ с умеренной степенью выраженности в 3 раза (с 70,0 до 23,4%).
Частота НЛФ после проведенной терапии ХЭ статистически значимо не снижалась ни в основной группе (43,3% (13 из 30) до лечения и 23,3% (7 из 30) после лечения, χ2=2,700, p>0,1), ни в группе сравнения (40,0% (12 от 30) до лечения и 26,7% (8 из 30) после лечения, χ2=1,200, p>0,1). Возможно, это свидетельствует о вовлечении в воспалительный процесс малого таза тканей яичников, что приводит к нарушению их функции, на это указывают и другие авторы [14].
Иммуногистохимическое исследование показало, что применение цитокинотерапии при лечении ХЭ у женщин с невынашиванием приводит к улучшению показателей местного иммунитета в эндометрии (табл. 3). Снизилось количество CD16+ (представляет собой низкоаффинный рецептор на NK-клетке, обладающий максимальной цитотоксической активностью), CD20+ (В-лимфоциты являются предшественниками плазматических клеток, участвуют в выработке антител), HLA-DR+ (молекула главного комплекса гистосовместимости II класса, маркер ранней активации иммунного ответа, характеризует активность воспалительного ответа) и плазматических клеток CD138+ (является маркером плазматических клеток sindecan-1, выявляется только при наличии воспаления). Плазматические клетки после лечения верифицированы в единичных количествах (что соответствует норме) в основной группе у 17 (56,7%) пациенток, в группе сравнения — у 3 (10,0%).
![Таблица 3. Содержание маркеров воспаления (в поле зрения) в эндометрии женщин с невынашиванием беременности и ХЭ до и после комбинированной терапии (Me [Q1; Q3]) Table 3. Found inflammation markers (in the field of vision) in the endometrium of women with Таблица 3. Содержание маркеров воспаления (в поле зрения) в эндометрии женщин с невынашиванием беременности и ХЭ до и после комбинированной терапии (Me [Q1; Q3]) Table 3. Found inflammation markers (in the field of vision) in the endometrium of women with](https://medblog.su/wp-content/uploads/2023/06/1687244303_163_Otsenka-effektivnosti-tsitokinoterapii-v-lechenii-hronicheskogo-endometrita-u-zhenshhin-s.png)
Обсуждение
При привычном невынашивании беременности локальный иммунный профиль меняется на патологический, что препятствует нормальному течению процессов адгезии, инвазии, ангиогенеза, а значит, имплантации и плацентации. Молекулярные механизмы передачи сигнала являются неотъемлемой составляющей локальных клеточных взаимодействий в эндометрии и формируются на основе системы факторов роста, хемокинов и цитокинов. Становление локального иммунитета происходит посредством баланса стимуляции или ингибирования цитокинами, которые продуцируются иммунокомпетентными клетками стромы в случае их активации. Важным аспектом исследования явилось включение адъювантной экзогенной цитокинотерапии в стандартную схему лечения ХЭ в основной группе пациенток.
Назначение экзогенной цитокинотерапии для лечения ХЭ позволило снизить частоту ХЭ выраженной степени в 4,7 раза, умеренной степени — в 2,7 раза. При этом неэффективным лечение оказалось лишь у 20% пациенток. Количество В-лимфоцитов (CD20+) как предшественников плазматических клеток снизилось в 2,3 раза. После курса лечения частота выявления плазматических клеток (CD138+) снизилась в 4,2 раза. Наличие плазматических клеток является специфическим морфологическим признаком ХЭ. По результатам проведенного исследования выявлено значимое снижение плазматических клеток после воздействия экзогенных цитокинов, а также других иммуногистохимических маркеров ХЭ, что позволяет рассмотреть возможное включение адъювантной экзогенной цитокинотерапии в комплексное лечение патологии эндометрия. Полученные нами данные подтверждают выявленный ранее эффект адъювантной цитокинотерапиии в коррекции нарушений, ассоциированных с наличием ХЭ [15, 16]. Результаты проведенной работы предполагают дальнейшие исследования, позволяющие оценить течение и исход беременности у женщин с репродуктивными потерями в анамнезе после прегравидарной подготовки.
К сожалению, в рамках настоящего исследования не проводилось бактериологического исследования содержимого полости матки и вирусологического обследования пациенток, которые могли бы помочь в установлении причины ХЭ, что следует рассматривать как ограничение исследования.
Заключение
Дополнительное назначение цитокиновых препаратов в качестве адъювантной терапии ХЭ снижает выраженность проявлений воспалительного процесса в эндометрии в 80% случаев. Применение локальной цитокинотерапии у пациенток с привычным невынашиванием беременности является эффективным и позволяет существенно улучшить морфофункциональное состояние эндометрия. Коррекция локального иммунного профиля способствует нормализации процессов имплантации и плацентации, улучшению показателей течения и исходов беременности у женщин с привычным выкидышем.
Сведения об авторах:
Плужникова Тамара Александровна — к.м.н., врач акушер-гинеколог Центра профилактики и лечения невынашивания беременности СПб ГБУЗ «Родильный дом № 1»; 199178, Россия, г. Санкт-Петербург, 14-я линия Васильевского острова, д. 19; ORCID iD 0000-0002-4269-4077.
Алябьева Екатерина Анатольевна — врач акушер-гинеколог амбулаторно-консультативного отделения СПб ГБУЗ «Родильный дом № 1»; 199178, Россия, г. Санкт-Петербург, 14-я линия Васильевского острова, д. 19.
Самарская Ирина Владимировна — врач акушер-гинеколог Центра профилактики и лечения невынашивания беременности СПб ГБУЗ «Родильный дом № 1»; 199178, Россия, г. Санкт-Петербург, 14-я линия Васильевского острова, д. 19.
Контактная информация: Плужникова Тамара Александровна, e-mail: plutam@mail.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 25.12.2022.
Поступила после рецензирования 24.01.2023.
Принята в печать 16.02.2023.
About the authors:
Tamara A. Pluzhnikova — C. Sc. (Med.), obstetrician and gynecologist of the Center for Miscarriage Prevention and Treatment, Maternity Hospital No. 1; 19, 14th line of Vasilyevsky Island, St. Petersburg, 199178, Russian Federation; ORCID iD 0000-0002-4269-4077.
Ekaterina A. Alyabeva — obstetrician and gynecologist of the Outpatient and Consultation Department, Maternity Hospital No. 1; 19, 14th line of Vasilyevsky Island, St. Petersburg, 199178, Russian Federation.
Irina V. Samarskaya — obstetrician and gynecologist of the Center for Miscarriage Prevention and Treatment, Maternity Hospital No. 1; 19, 14th line of Vasilyevsky Island, St. Petersburg, 199178, Russian Federation.
Contact information: Tamara A. Pluzhnikova, e-mail: plutam@mail.ru.
Financial Disclosure: the authors have no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 25.12.2022.
Revised 24.01.2023.
Accepted 16.02.2023.
Информация с rmj.ru

