Содержание статьи
Остеоартроз у пациентов с семейной гипермобильностью суставов: клинико-генеалогический анализ, риск возникновения и тяжесть течения
И. А. Викторова, доктор медицинских наук, профессор
Н. В. Коншу
Д. С. Киселева, кандидат медицинских наук
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Актуальность проблемы гипермобильности суставов и синдрома гипермобильности суставов определяется не только распространенностью среди работоспособного населения, но и высоким риском развития раннего остеоартроза (ОА) [1, 2].
Гипермобильность суставов (ГМС) — состояние, при котором амплитуда активных и/или пассивных движений в суставах превышает условную среднестатистическую норму [1]. Синдром гипермобильности суставов (СГМС) — это наличие жалоб со стороны опорно-двигательного аппарата у пациентов с чрезмерно подвижными суставами [3].
В зависимости от возраста, пола, расовой принадлежности обследуемых эпидемиологические показатели ГМС варьируют от 6,9% до 31,5% [4]. Проведенные семейные исследования показывают сосуществование в одной родословной ГМС (особенно среди родственников I степени родства) [5]. M. Castori и коллеги определили тип наследования этого семейного признака как аутосомно-доминантное с неполной пенетрантностью, вариабельной экспрессивностью [5, 6].
Для диагностики гипермобильности суставов существует общепринятый скрининг-тест Бейтона [3]. Этот тест был модифицирован Шиллингом для выявления «гипермобильных лиц», склонных к ОА. Суть модификации заключается в дополнении тестов Бейтона «синдромом Паганини» для рук [7]. Шиллинг дает следующее описание «синдрома Паганини» (9 тестов): 1) активная ульнарная девиация II–V пальцев кисти за счет отклонения в пястно-фаланговых и межфаланговых суставах, иногда с подвывихом в указанных суставах; 2) активное переразгибание II–V пальцев кистей рук; 3) переразгибание запястно-пястного сустава большого пальца кисти; 4) выступание ногтевой фаланги за ульнарный край ладони при фиксации большого пальца поперек ладони; 5) пассивное приведение большого пальца к тыльной стороне кисти руки; 6) активное сгибание в дистальных межфаланговых суставах II–V пальцев кистей рук, которое может напоминать «шею лебедя»; 7) поперечное растяжение пальцев в противоположном направлении в пястно-фаланговых суставах в виде шпагата, этот тест проверяется попарно в II–III, III–IV пальцах кисти; 8) пассивное поочередное укладывание III, IV, V пальцев кистей друг на друга, «палец-улитка»; 9) поворот руки на 360 градусов в плечевом и локтевом суставе.
Брайтонские диагностические критерии СГМС сохраняют свою актуальность, но подвергаются модификации различными авторами. Малые критерии ГМС были дополнены А. Г. Беленьким [4] и включают hallux valgus, сколиоз, сандалевидную щель, полую стопу, брахидактилию, деформации грудной клетки и пролапс митрального клапана. Ф. Шиллинг модифицировал большие критерии, добавив к ним «синдром Паганини», к малым критериям — врожденную дисплазию тазобедренного сустава, «щелкающее бедро», варусную, вальгусную деформацию коленных суставов, подростковую хондромаляцию надколенника, вросшие мочки уха [7].
К настоящему времени накоплены факты, показывающие связь гипермобильности суставов и остеоартроза. ГМС из-за связочной слабости считается фактором риска остеоартроза, хотя исследования имеют противоречивые результаты [8–13].
Большинство авторов придерживаются мнения, что гипермобильность суставов является фактором риска для развития остеоартроза, который развивается у этой категории лиц чаще и раньше, чем в общей популяции [8–11]. Однако существуют другие исследования, свидетельствующие о противоположном [12, 13].
Материалы и методы исследования
С целью определения маркеров риска (клинических, генеалогических) возникновения и тяжести течения ОА у лиц с семейной гипермобильностью суставов для оптимизации его ранней диагностики за период с 2011 по 2013 гг. в исследование включен 61 пациент с диагнозом ОА и наличием гипермобильности суставов. Для выявления генеалогических маркеров риска возникновения и тяжести течения ОА на фоне гипермобильности суставов обследованы семьи этих пациентов: пробанды (n = 61) и 184 их родственника I, II, III cтепени родства. Группу контроля составили 60 пациентов с диагнозом ОА без гипермобильности суставов, а также 121 их родственник.
Исследование пациентов включало опрос жалоб, общий осмотр, оценку индекса массы тела, фенотипических признаков дисплазии соединительной ткани, клиническое обследование суставов и периартикулярных тканей, оценку степени выраженности ГМС, выявление синдрома гипермобильности суставов. Пациентам проводилось рентгенологическое и ультразвуковое исследование пораженных суставов. Оценка тяжести ОА определялась при помощи альгофункциональных индексов: Lequesne для коксартроза и гонартроза, WOMAC, визуально-аналоговой шкалы боли (ВАШ). Для оценки наследственной отягощенности обследованы родственники пробанда, подробно изучались амбулаторные карты членов семей.
Статистическая обработка данных выполнена с использованием пакетов прикладных программ Statistica 10 и SAS JMP 10. Статистическая значимость различий значений признаков в двух группах определялась с использованием непараметрического критерия Манна–Уитни. При сравнении категориальных переменных оценка значимости различия проводилась с использованием критерия χ2 Пирсона. Для выявления взаимосвязей между переменными был использован коэффициент ранговой корреляции Спирмена. Статистическая значимость была зафиксирована на уровне 0,05. Для моделирования оценки риска развития ОА у гипермобильных пациентов использовались деревья классификаций. Для оценки качества построенных деревьев применялся ROC-анализ.
Результаты и обсуждение
В основной группе пациентов с ОА на фоне гипермобильности суставов (n = 61) было 54 женщины и 7 мужчин; средний возраст 50 лет (40; 61). Контрольную группу (n = 60) составили 49 женщин, 11 мужчин; средний возраст 52 года (47; 63) с ОА, без гипермобильности суставов. Пациенты были сопоставимы по полу, возрасту, индексу массы тела, числу обследованных поколений. Группы значимо отличались по показателям альгофункциональных индексов: боли по ВАШ (U = 1114,0, p = 0,000), индексу Lequesne (U = 1016,5, p = 0,000), суммарному индексу WOMAС (U = 1272,0, p = 0,003), индексу боли по WOMAС (U = 1123,0, p = 0,000) и функциональной недостаточности (U = 1420,50, p = 0,033). Высокие значения альгофункциональных индексов характеризуют тяжесть течения ОА, что наблюдалось в основной группе пациентов с ОА на фоне гипермобильности суставов.
В основной группе возраст начала ОА составил 32 года (24; 42), в контрольной 45,5 лет (40; 49) (U = 704,0, p = 0,000). Это свидетельствует о том, что ОА у пациентов с гипермобильностью возникает раньше, чем в общей популяции [5, 8].
Самой распространенной жалобой в группах была артралгия. Пациенты с ОА на фоне гипермобильности чаще предъявляли жалобы на чувство нестабильности суставов в отличие от пациентов без гипермобильности (χ2 = 12,001; p = 0,000), которые чаще жаловались на ограничение объема движений (χ2= 9,601; p = 0,001), увеличение размеров (χ2 = 22,426; p = 0,000) и крепитацию суставов (χ2 = 14,071; p = 0,000).
Нестабильные суставы более склонны к подвывихам или вывихам, что может быть предшественником ОА [2, 8]. По локализации вывихов/подвывихов в группе пациентов с гипермобильностью суставов и остеоартрозом преобладали голеностопный сустав, коленная чашечка, плечевой, височно-нижнечелюстной, тазобедренный сустав (4,9%), сустав большого пальца кисти.
Наличие рецидивных растяжений связок голеностопного сустава было больше в основной группе пациентов (χ2 = 10,722; р = 0,001).
Не отмечалось значимых различий по количеству пораженных суставов в двух группах. Особенностью пациентов с ОА на фоне гипермобильности суставов явилась большая распространенность коксартроза (χ2 = 7,738; p = 0,005).
В группе пациентов с гипермобильностью суставов преобладали II (53,6%), III (54,5%), IV (100%) рентгенологические cтадии, однако при сравнении с контрольной группой выявить различие при помощи метода χ2 не удалось (р = 0,06).
Пациенты с ОА на фоне гипермобильностьи суставов имели функциональную недостаточность суставов (ФНС) III (70,3%) и II (55,3%) степени по сравнению с группой без гипермобильности суставов (р = 0,000).
В основной группе пациентов чаще наблюдался пролиферативный синовит (9,8%) по сравнению с группой контроля (6,7%), различия приближались к статистической значимости (χ2 = 0,401; p = 0,526).
По характеру течения ОА выявлены значимые различия в группах. У пациентов с ОА на фоне ГМС течение было быстропрогрессирующим (χ2 = 51,092; p = 0,000) по сравнению с пациентами без гипермобильности суставов, у которых часто наблюдался медленно прогрессирующий тип течения ОА (χ2 = 13,982; p = 0,000). Поскольку тяжесть течения ОА определяется типом прогрессирования, можно сделать вывод, что в группе пациентов с гипермобильностью суставов отмечалось более тяжелое течение ОА.
Методом критерия χ2 для сравнения двух групп по качественному признаку выявлено, что все тесты синдрома Паганини характерны с высокой значимостью для пациентов с ОА на фоне гипермобильности суставов (χ2 = 51,101; p = 0,000) (табл. 1)

Большое влияние в основной группе пациентов с ОА на фоне гипермобильности оказала систематическая интенсивная физическая нагрузка (χ2 = 4,365; p = 0,03) и статическая нагрузка (χ2 = 12,979; p = 0,000). Систематические занятия физической культурой в сочетании с длительными статическими нагрузками у гипермобильных лиц оказывают достоверное влияние на развитие ОА, что согласуется с другими исследованиями [5, 9].
Факторы риска ОА, такие как курение, остеопороз, остеопения, значимо не отличались в двух группах (χ2 = 0,264, p = 0,607; χ2 = 2,592, p = 0,107 и χ2 = 0,000, p = 0,990 соответственно).
Наличие щелкающих суставов (пальцев, бедра, челюсти) достоверно выше в основной группе пациентов с ОА на фоне гипермобильности суставов (χ2 = 22,569; p = 0,012) и является значимым фактором риска возникновения ОА.
Болевая дисфункция височно-нижнечелюстного сустава отмечалась в основной группе — 14,8% (χ2 = 6,834; p = 0,009). Боль в различных отделах позвоночника была характерна для обеих групп, в основной группе преобладающими были боли в шейном (χ2 = 6,274; p = 0,012) и грудном отделах (χ2 = 6,436; p = 0,011).
Периартикулярные поражения по данным литературы считаются одним из типичных проявлений СГМС [4]. Однако эти поражения часто встречаются среди людей с нормальным объемом движений в суставах, особенно во второй половине жизни. В нашем исследовании периартикулярные поражения по локализации статистически значимо не отличались между двумя группами. Однако в основной группе часто наблюдался синовит мелких суставов кистей и стоп (χ2 = 5,130; p = 0,023). Синдром запястного канала также был характерен для пациентов основной группы (χ2 = 12,522; p = 0,000).
Преждевременный ОА может возникнуть на фоне сопутствующих ортопедических аномалий: плоскостопия, Х- или О-образных искривлений нижних конечностей, дисплазии тазобедренных суставов и т. д. Доказана ассоциация гипермобильности суставов с плоскостопием [4]. В нашем исследовании ортопедические аномалии часто встречались в группе гипермобильных лиц: среди них дисплазия тазобедренного сустава (р = 0,000), Х-образные ноги (р = 0,0005), продольное плоскостопие (р = 0,006), поперечное плоскостопие (р = 0,003) и его осложнение hallux valgus (р = 0,002).
Поскольку гипермобильный синдром является патологией всей соединительной ткани, то у таких пациентов может быть большое разнообразие признаков дисплазии [1]. У пациентов из контрольной группы чаще встречались: нефроптоз (р = 0,003), пролапс митрального клапана (р = 0,000), кисты внутренних органов (р = 0,02), голубые склеры (р = 0,000), миопия (р = 0,000), готическое небо (р = 0,001), уздечка языка (р = 0,03), сколиоз грудного отдела позвоночника (р = 0,002), выраженный поясничный лордоз (р = 0,000), воронкообразная деформация грудной клетки (р = 0,009), долихостеномелия (р = 0,000), арахнодактилия (р = 0,000), сандалевидная щель (р = 0,005), II палец стопы > I (р = 0,003), астенический тип конституции (p = 0,000).
При обследовании родственников пробандов основной и контрольной группы выявлено, что ОА чаще обнаруживался в группе с гипермобильностью суставов у родственников I (р = 0,000), II (р = 0,003), III (р = 0,04) степени родства, преимущественно по женской линии (р = 0,04).
При проведении корреляционного анализа по Спирмену в основной группе выявлена отрицательная связь средней силы (rs = –0,62, p = 0,000) между возрастом начала ОА и степенью выраженности гипермобильности суставов по Бейтон. Выявлена отрицательная связь между функциональной недостаточностью по WOMAC и степенью выраженности ГМС суставов (rs = –0,47, р = 0,000). Поэтому у пациентов с ОА и гипермобильностью суставов сохраняется в достаточном объеме способность к выполнению ряда бытовых навыков у лиц с III степенью ФНС.
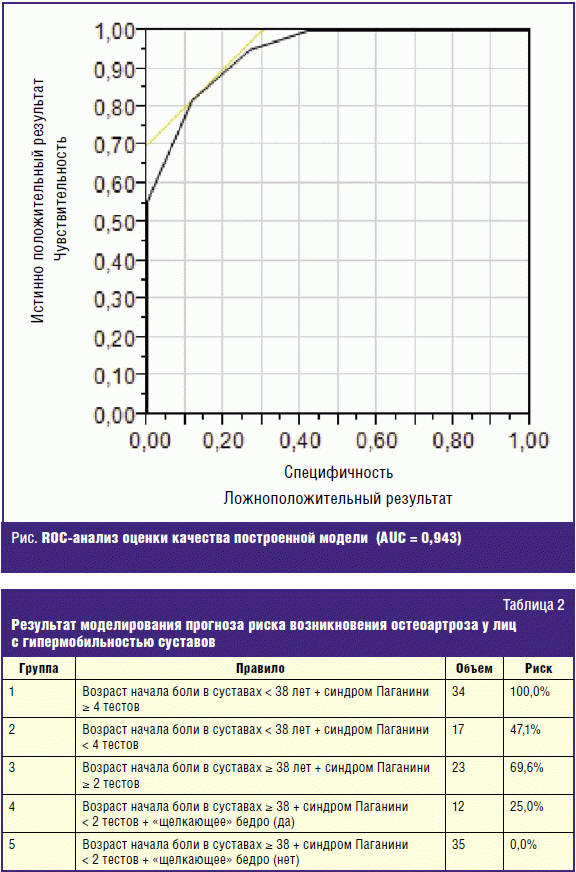
В нашем исследовании определен перечень показателей (n = 154), вносящих вклад в различие между основной и контрольной группами и проведена их интерпретация. Для выявления пациентов с гипермобильностью суставов, имеющих высокий риск развития ОА, применялся метод дерева классификации с построением ROC-кривой и оценкой качества полученной модели (рис.). Дерево классификации позволяет построить группы пациентов с разными уровнями рисков развития ОА на основе комбинации значимых показателей. Само дерево классификации представляет собой простую, интуитивно понятную структуру в виде дендрограммы, на которой в каждом узле указаны: объем выделенной группы, риск развития ОА (табл. 2).
Выводы
- У пациентов с гипермобильностью суставов остеоартроз возникает на тринадцать лет раньше, чем у пациентов без гипермобильности суставов, и характеризуется тяжелым течением (быстропрогрессирующим типом течения, III степенью функциональной недостаточности суставов, высокими показателями альгофункциональных индексов: боль по ВАШ, индекс Lequesne, суммарный индекс, индекс боли и функциональной недостаточности по WOMAС). Возраст развития остеоартроза обратно коррелирует с выраженностью гипермобильности суставов по Бейтон.
- Генеалогические маркеры риска возникновения остеоартроза у лиц с семейной гипермобильностью суставов — наличие остеоартроза у родственников всех степеней родства по женской линии.
- Разработана модель прогноза риска возникновения остеоартроза у лиц с гипермобильностью суставов, обладающая диагностической чувствительностью 82%, специфичностью 88,3%, эффективностью 85,2%.
- У пациентов с гипермобильностью суставов, дебютом суставных болей в возрасте до 38 лет и наличием четырех и более тестов синдрома Паганини риск развития остеоартроза составляет 100%.
- У пациентов с гипермобильностью суставов, дебютом суставных болей в возрасте 38 лет и более, наличием двух и более тестов синдрома Паганини риск развития остеоартроза составляет 69,6%.
- У пациентов с гипермобильностью суставов, дебютом суставных болей в возрасте 38 лет и более, наличием менее двух тестов синдрома Паганини и симптомом «щелкающего» бедра риск развития остеоартроза составляет 25%.
- У пациентов с гипермобильностью суставов, дебютом суставных болей в возрасте 38 лет и более, наличием менее двух тестов синдрома Паганини при отсутствии симптома «щелкающего» бедра риск развития остеоартроза составляет 0%.
- Менее значимыми клиническими особенностями пациентов с остеоартрозом на фоне гипермобильности суставов являются: наличие астенического типа конституции, ортопедические аномалии (дисплазия тазобедренного сустава, Х-образные ноги, продольное плоскостопие, поперечное плоскостопие, hallux valgus).
Литература
- Grahame R. Hypermobility: an important but often neglected area within rheumatology // Nat. Clin. Pract. Rheumatol. 2008. Vol. 4, № 10. Р. 522–524.
- Seidel M. F. Konstitutionelle Hypermobilität // Orthopädie und Unfallchirurgie. 2013. Vol. 8, № 3. P. 251–264.
- Grahame R. The revised (Brighton, 1998) criteria for the diagnosis of benign joint hypermobility syndrome (BJHS) // J. Rheum. 2000. Vol. 27, № 7. P. 1777–1779.
- Беленький А. Г. Гипермобильный синдром — системное невоспалительное заболевание соединительной ткани // Consilium medicum. 2006. Т. 8, № 8. С. 28–32.
- Castori M. Joint hypermobility syndrome (a.k.a. Ehlers-Danlos Syndrome, Hypermobility Type): an updated critique // G. Ital. Dermatol. Venereol. 2013. Vol. 148, № 1. P. 13–36.
- Keer R. J. Hypermobility and the hypermobility syndrome // Man. Ther. 2007. Vol. 12, № 4. P. 298–309.
- Schilling F. Die instabilität der Hand- und Fingergelenke bei der konstitutionellen Hypermobilität: Ein «Paganini –Syndrom» // Akt. Rheumatol. 2007. Vol. 32. P. 355–357.
- Golightly Y. M., Nelson A. E. General joint hypermobility and hip osteoarthritis: the Johnston county osteoarthritis project // Osteoarthritis and Cartilage. 2012. Vol. 20. P. 182.
- Murray K. J. Hypermobility disorders in children and adolescents // Best Pract. Res. Clin. Rheumatol. 2006. Vol. 20, № 2. P. 329–351.
- D. J. Hunter et al. Trapeziometacarpal subluxation predisposes to incident trapeziometacarpal osteoarthritis (OA): the Framingham Study // Osteoarthritis Cartilage. 2005. Vol. 13, № 11. P. 953–957.
- H. Jonsson et al. High hand joint mobility is associated with radiological CMC1 osteoarthritis: the AGES-Reykjavik study // Osteoarthritis Cartilage. 2009. Vol. 17, № 5. P. 592–595.
- Chen H. C. et al. Inverse association of general joint hypermobility with hand and knee osteoarthritis and serum cartilage oligomeric matrix protein levels // Arthritis Rheum. 2008. Vol. 58, № 12. P. 3854–3864.
- Kraus V. B. et al. Articular hypermobility is a protective factor for hand osteoarthritis // Arthritis Rheum. 2004. Vol. 50, № 7. P. 2178–2183.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







