Введение
Урсодезоксихолевая кислота (УДХК) является эндогенной желчной кислотой, которая в небольших количествах вырабатывается в желчи всех млекопитающих, но в существенно больших концентрациях присутствует в желчи некоторых видов медведей [1]. Высушенный порошок медвежьей желчи на протяжении столетий применялся травниками и врачами в Китае для лечения различных заболеваний печени [2]. Однако в связи с проблемой сохранения исчезающих видов медведей были разработаны альтернативные методы получения УДХК путем химического синтеза на основе холевой и хенодезоксихолевой кислот. Таким образом в Японии удалось воссоздать медвежью желчь искусственным путем и получить препарат УДХК [3].
Современные клинические рекомендации включают применение УДХК при широком спектре заболеваний печени. Препарат показан как при состояниях, сопровождающихся синдромом холестаза (первичный билиарный холангит [4], первичный склерозирующий холангит [5, 6], прогрессирующий семейный холестаз и доброкачественный семейный холестаз [7], внутрипеченочный холе-стаз беременных[1][8], при лекарственно-индуцированном поражении печени с холестазом [9], так и при заболеваниях с иным механизмом поражения (алкогольная болезнь печени[2][10], неалкогольная жировая болезнь печени (НАЖБП)[3] [11]); а также при патологии билиарного тракта, включая пероральную литолитическую терапию при желчнокаменной болезни[4][12]. Прочная позиция УДХК в качестве препарата первого выбора при лечении патологии печени и билиарного тракта обусловлена синергизмом нескольких механизмов действия: противовоспалительного, цитопротективного, холеретического, антифибротического, мембраностабилизирующего, антиоксидантного и антиапоптотического [13, 14].
Терапевтические концентрации УДХК способствуют изменению профиля желчных кислот в сторону преобладания гидрофильных форм. Гидрофобные желчные кислоты, такие как дезоксихолевая и хенодезоксихолевая, оказывают токсическое действие на гепатоциты, повышая проницаемость мембран и индуцируя апоптоз. УДХК конкурентно замещает эндогенные гидрофобные кислоты на уровне абсорбции в подвздошной кишке и в гепатоцитах, снижая концентрацию токсичных соединений и повышая долю гидрофильных фракций. В зависимости от дозы УДХК и ее конъюгаты составляют от 19 до 64% общего пула желчных кислот [15].
Холеретический эффект УДХК реализуется через стимуляцию секреции желчных кислот без сопутствующей токсичности, что особенно ценно при холестатических нарушениях. На клеточном уровне УДХК индуцирует везикулярный экзоцитоз в гепатоцитах за счет повышения внутриклеточного уровня кальция, что активирует транспортные белки. Дополнительно УДХК модулирует мембранные транспортеры, экспрессия которых снижена при холестазе [16].
Установлено, что УДХК также демонстрирует иммуномодулирующие свойства: подавляет аберрантную экспрессию антигенов главного комплекса гистосовместимости I класса на гепатоцитах и клетках желчных протоков, что снижает риск иммуноопосредованного повреждения печени [17].
В современных исследованиях активно изучается способность УДХК регулировать процессы аутофагии в клетках печени [18]. Данный эффект реализуется через активацию ключевых регуляторных систем — путей AMPK/mTOR и рецепторов желчных кислот TGR5 (Takeda G protein-coupled Receptor) / FXR (фарнезоидный X-рецептор), что приводит к стимуляции аутофагии и позволяет гепатоцитам эффективно удалять поврежденные органеллы, токсичные белковые скопления и липидные включения, что имеет особое значение при холестатических заболеваниях и НАЖБП [19]. Важно отметить, что УДХК, уменьшая апоптоз и стимулируя аутофагию через фосфорилирование AMPK (аденозинмонофосфат-активируемой протеинкиназы), демонстрирует потенциал для применения в терапии других заболеваний, где индукция аутофагических процессов может стать терапевтически эффективной [20].
Современные научные данные свидетельствуют о том, что УДХК является эффективным регулятором состава кишечной микрофлоры. Важным аспектом действия УДХК является нормализация индекса Firmicutes/Bacteroidetes (индекс Bacillota/Bacteroidota) с повышением численности Akkermansia и Prevotellaceae [21]. Показано, что на фоне лечения УДХК наблюдается увеличение количества представителей семейства Lachnospiraceae, играющих важную роль в синтезе короткоцепочечных жирных кислот и метаболизме желчных кислот [22].
Лечение препаратами УДХК также ассоциировано с увеличением численности таких представителей микрофлоры, как Bifidobacterium [23] и Alistipes [24]. Рост последних, известных своей способностью вырабатывать ацетат, был отмечен в контексте НАЖБП, что может частично объяснить противовоспалительный эффект УДХК.
Способность УДХК влиять на микрофлору имеет важное клиническое значение. Доказано, что она может снижать шанс развития инфекционных заболеваний кишечника, таких как инфекция, вызываемая Clostridioides difficile, благодаря сопротивляемости к колонизации патогенами и модуляции иммунного ответа организма [25].
Таким образом, изменение состава и функциональной активности кишечной микрофлоры представляет собой одно из важных направлений многогранного действия УДХК. Способность препарата увеличивать количество микроорганизмов с противовоспалительным потенциалом, участвующих в поддержании барьерной функции, выработке короткоцепочечных жирных кислот и подавлении воспаления, вносит существенный вклад в ее системные эффекты.
Благодаря своему плейотропному механизму действия УДХК находит применение не только в гепатологии и гастроэнтерологии. Особый интерес представляет применение УДХК у пациентов с коморбидной патологией, включающей НАЖБП, ожирение, сахарный диабет 2 типа, артериальную гипертензию и нейродегенеративные заболевания [26]. Важно отметить, что данные заболевания часто встречаются в сочетании, формируя единый патофизиологический континуум, характеризующийся общими эпидемиологическими чертами, где ключевое место занимает феномен метаболического воспаления (метавоспаления) [27].
Содержание статьи
Метаболическое воспаление
Метаболическое воспаление (метавоспаление) — это хронический вялотекущий воспалительный процесс низкой интенсивности, который развивается в условиях метаболических нарушений и является ключевым патогенетическим звеном ряда хронических неинфекционных заболеваний. В отличие от классического острого воспаления, метавоспаление не имеет ярких клинических проявлений и протекает субклинически, однако приводит к прогрессирующему повреждению тканей и функций [28]. Ключевым механизмом развития метавоспаления является нарушение метаболического гомеостаза, индуцированное диетическими факторами, гиподинамией и генетической предрасположенностью (рис. 1).
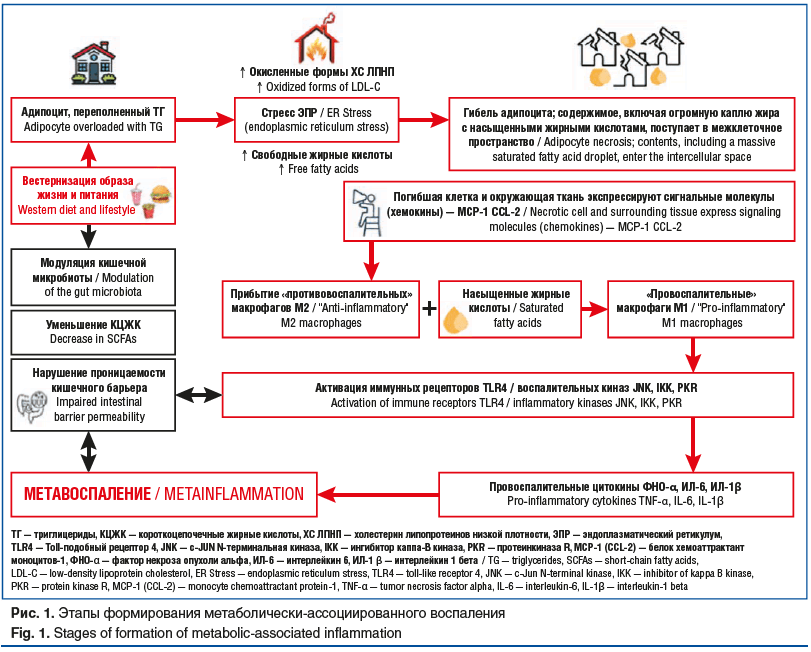
Потребление продуктов, обогащенных насыщенными жирами и простыми сахарами, инициирует каскад таких патологических процессов, как нарушение целостности кишечного барьера и микробного гомеостаза; накопление иммунных клеток в жировой ткани с активацией врожденного иммунитета; дисрегуляция гормонов висцеральной жировой ткани; инсулинорезистентность [29, 30]. Гипертрофия адипоцитов приводит к активации процессов апоптоза и некроза адипоцитов с высвобождением свободных жирных кислот в межклеточное пространство, что приводит к накоплению иммунных клеток, преимущественно макрофагов типа M1, формирующих «коронные структуры» вокруг поврежденных адипоцитов, T-лимфоцитов (CD8+ и Th1-клеток), нейтрофилов и тучных клеток, и далее к цитокиновому дисбалансу, митохондриальной дисфункции, окислительному стрессу [31]. Указанные процессы представляют собой общую схему патогенеза, однако современные исследования концентрируются на детализации молекулярных и клеточных механизмов данного феномена [32]. Изучаются специфические пути передачи сигналов, особенности эпигенетической регуляции, роль отдельных микробных метаболитов [29] и вариабельность ответа у разных пациентов, что подчеркивает многогранность и сложность изучения метавоспаления.
Эффекты УДХК на метаболическое здоровье
Согласно данным двойного слепого плацебо-контролируемого исследования, применение УДХК в суточной дозе 1200 мг в течение 6 нед. сопровождалось значимым снижением индекса массы тела (ИМТ) у пациенток с НАЖБП и ожирением (ИМТ>30 кг/м2) по сравнению с группой плацебо [33]. Согласно данным систематического обзора [34], применение УДХК ассоциировано со снижением массы тела у участников исследования в возрасте до 40 лет.
Механизм снижения массы тела при применении УДХК связан с комплексным воздействием на рецепторы желчных кислот TGR5 (также известный как GPBAR1 — G-белок-связанный рецептор, который связывается с желчными кислотами и играет важную роль в регуляции метаболизма глюкозы, энергетического баланса и иммунных реакций) и FXR [35]. Предполагают, что активация TGR5 стимулирует термогенез и повышает энергозатраты через усиление конверсии гормонов щитовидной железы, в то время как активация FXR опосредует изменения метаболизма липидов и глюкозы через путь FXR-FGF19. Дополнительный вклад вносит модуляция микробиоты кишечника, а именно метаболизм желчных кислот влияет на состав бактериальных популяций и кишечный глюконеогенез [36].
В небольшом исследовании [27] с участием 40 пациентов с метаболическим синдромом изучено влияние УДХК (500 мг/сут в течение 30 дней) на уровни ИЛ-6 и ИЛ-17. Показано достоверное снижение уровня ИЛ-6, более выраженное в подгруппе пациентов с ожирением, тогда как уровень ИЛ-17 у них существенно не изменялся.
В исследовании, опубликованном еще в 2015 г. [37], показано, что у пациентов с НАЖБП и морбидным ожирением короткий курс УДХК (20 мг/кг/сут) действует как антагонист FXR, что приводит к стимуляции синтеза желчных кислот через индукцию холестерол-7α-гидроксилазы (CYP7A1), снижению уровня ХС ЛПНП, активации липогенеза путем индукции стеароил-КоА-десатуразы.
Урсодезоксихолевая кислота демонстрирует выраженный цитопротективный потенциал в отношении кишечного барьера, модулируя ключевые патофизиологические механизмы воспалительных процессов [38]. Доказанная способность УДХК восстанавливать эпителиальную проницаемость посредством ингибирования апоптоза (включая подавление каспазы-3) и восстановления целостности межклеточных контактов открывает новые перспективы для ее терапевтического применения при воспалительных заболеваниях кишечника.
Согласно данным метаанализа 7 рандомизированных контролируемых исследований [39] терапия УДХК ассоциирована со значимым улучшением ключевых маркеров гликемического контроля. Показано достоверное снижение уровня глюкозы натощак, гликированного гемоглобина и концентрации инсулина в плазме крови, что свидетельствует о благоприятном влиянии УДХК на регуляцию углеводного обмена и чувствительность к инсулину. Полученные результаты подчеркивают потенциал УДХК в качестве перспективного средства коррекции метаболических нарушений при нарушениях гомеостаза глюкозы.
Урсодезоксихолевая кислота и НАЖБП
С современных позиций НАЖБП рассматривается как один из компонентов метаболического синдрома, который тесно коррелирует с патологией билиарного тракта, учитывая общность патогенеза [40]. При этом наблюдается своего рода феномен «взаимного отягощения». Так, убедительно показан, с одной стороны, высокий риск формирования холестериновых конкрементов у пациентов с НАЖБП, с другой — риск прогрессирующего течения НАЖБП на фоне желчнокаменной болезни (ЖКБ), в том числе в период после холецистэктомии [41, 42]. Ключевыми предикторами литогенеза при НАЖБП выступают возраст и объем абдоминальной жировой клетчатки (окружность талии) [43]. Также у пациентов с ЖКБ, ассоциированной с метаболическим синдромом, установлены значимые корреляции между выраженностью сонографических признаков стеатоза, отклонениями лабораторных показателей (повышением уровня ХС ЛПНП, глюкозы крови), повышением литогенности желчи и утолщением стенки желчного пузыря [44].
В многоцентровом исследовании (Россия, Казахстан и Узбекистан) [45] с участием 174 пациентов с установленной НАЖБП по данным ультразвукового исследования (УЗИ) показано, что применение в течение 6 мес. УДХК в дозе 15 мг/кг/сут в совокупности с модификацией образа жизни и питания приводит к нормализации аланинаминотрансферазы, аспартатаминотрансферазы, гамма-глутамилтранспептидазы (эффект достигнут в первые 3 мес. лечения); снижению общего холестерина, ХС ЛПНП и ТГ; уменьшению толщины комплекса интима-медиа общей сонной артерии и индекса стеатоза печени. Десятилетний риск развития атеросклеротических сердечно-сосудистых заболеваний значимо снизился у женщин.
Нарушение коллоидного равновесия желчи вследствие гипернасыщения холестерином приводит к ее конденсации и кристаллизации. Этот процесс инициирует билиарную дисфункцию, проявляющуюся дискинезией желчного пузыря, хроническим холециститом и формированием конкрементов. Атерогенная дислипидемия регистрируется у 27–81% пациентов с ЖКБ и у 20–81% больных НАЖБП, подтверждая единство патогенетических механизмов [46]. Согласно данным исследования, посвященного анализу коморбидности НАЖБП с другой гастроэнтерологической патологией, показано 3,5-кратное преобладание сочетанного течения НАЖБП и ЖКБ над иными заболеваниями пищеварительного тракта [47]. Так, калькулезный холецистит (включая пациентов с холецистэктомией в анамнезе) диагностируется у 20% лиц с НАЖБП, тогда как билиарный сладж обнаруживается более чем у 50% этой категории больных.
Референтным препаратом УДХК как в Евросоюзе, так и в Российской Федерации является препарат Урсофальк® с доказанной эффективностью и безопасностью, который входит в список жизненно необходимых и важнейших лекарственных препаратов. Подтверждением более высокой терапевтической эффективности референтного препарата Урсофальк® в сравнении с препаратами УДХК других производителей являются данные метаанализа [48], показавшего, что Урсофальк® оказался значимо эффективнее других препаратов УДХК в растворении билиарного сладжа как при оценке через 3 мес. терапии (отношение шансов (ОШ) 3,183, 95% доверительный интервал (ДИ) 1,495–6,777), так и при 6-месячном курсе. Сравнительная оценка препарата Урсофальк® относительно других препаратов УДХК с помощью теста Манна — Уитни показала, что препарат значимо лучше купирует билиарную боль (p=0,025) и билиарную диспепсию (p=0,039), регресс боли происходит значительно быстрее (p=0,01) — за 21 день. Урсофальк® имеет лучшую переносимость по сравнению с другими препаратами (94,34% против 67,31%; p=0,017). Кроме того, Урсофальк® оказывает большее влияние на регресс билиарного сладжа по результатам УЗИ через 3 мес. (p=0,022) и 6 мес. (p=0,016) [49].
Урсофальк выпускается в двух лекарственных формах — капсулах по 250 мг и таблетках по 500 мг. Таблетка Урсофалька 500 мг по размеру соответствует капсуле Урсофалька 250 мг и в большинстве случаев является удобной лекарственной формой для пациента, повышая его приверженность терапии. Таблетка Урсофалька имеет технологическую риску и специально предназначена для деления на две дозы по 250 мг.
Статистически значимая корреляция между НАЖБП и ЖКБ была подтверждена в систематическом обзоре с метаанализом 12 проспективных когорт [50]. Предполагается, что в реализации данной взаимосвязи важное значение могут иметь желчные кислоты. Современная парадигма рассматривает желчные кислоты не только как эмульгаторы липидов, но и как сигнальные молекулы с плейотропными эффектами, которые координируют метаболический гомеостаз и воспалительные реакции не только в гепатобилиарной системе, но и в отдаленных органах [51]. Экспериментальные и клинические исследования демонстрируют, что накопление токсичных липидных метаболитов и оксидативный стресс в эндоплазматическом ретикулуме при НАЖБП индуцируют каскад последовательных нарушений, включая дисфункцию рецепторных и транспортных систем базально-латеральных мембран, снижение текучести мембранных структур, повреждение цитоскелета с нарушением везикулярного транспорта, все это в конечном итоге приводит к увеличению плазменного уровня желчных кислот, снижению экспрессии транспортеров желчных кислот, дисрегуляции синтеза и внутриклеточного трафика желчных кислот [52, 53], а следовательно, влияет на физико-химические свойства желчи, увеличивая ее литогенность.
Синдром холестаза при НАЖБП может быть собственно проявлением патологии, а также может быть связан с сопутствующей патологией билиарного тракта или иными причинами, что также требует взвешенной оценки в каждом конкретном случае. Вместе с тем интересными с практической точки зрения представляются данные о более агрессивном течении НАЖБП, ассоциированной с холестазом, в частности, ускоренном фиброгенезе и трансформации стеатоза в стеатогепатит с последующим цирротическим ремоделированием печени [54].
Известно, что УДХК демонстрирует многофакторное воздействие на патогенез НАЖБП через несколько взаимо-связанных механизмов [14]. Препарат индуцирует процессы аутофагии в гепатоцитах и подавляет апоптоз, способствуя сохранению функциональной целостности печеночных клеток. УДХК оказывает выраженное влияние на основные метаболические процессы и тормозит развитие фиброза печени. Важным аспектом действия является модуляция активности клеток Купфера с последующим ослаблением провоспалительного ответа. Кроме того, терапия УДХК приводит к снижению ангиогенеза и способствует вазорелаксации сосудов. Ключевым механизмом представляется способность УДХК непосредственно и опосредованно регулировать активность рецепторов TGR5 и FXR через модуляцию уровня желчных кислот, что комплексно влияет на метаболические и воспалительные процессы при НАЖБП (рис. 2).
![Рис. 2. Механизмы терапевтического действия УДХК при НАЖБП (адаптировано из [14]) Fig. 2. Mechanisms of therapeutic action of UDCA in Non-alcoholic fatty liver disease (adapted from [14]) Рис. 2. Механизмы терапевтического действия УДХК при НАЖБП (адаптировано из [14]) Fig. 2. Mechanisms of therapeutic action of UDCA in Non-alcoholic fatty liver disease (adapted from [14])](https://medblog.su/wp-content/uploads/2025/10/1760627605_968_Metavospalenie-novye-gorizonty-primeneniya-ursodezoksiholevoj-kisloty-Livzan-MA-Bikbavova.png)
Антигипертензивные эффекты УДХК
Современная доказательная медицина не подтверждает эффективность УДХК в качестве средства для снижения артериального давления. Таким образом, использование УДХК для антигипертензивной терапии не обосновано. Доказанные эффекты носят лишь вторичный характер и реализуются через регуляцию метаболических параметров, уменьшение системного воспаления и окислительного стресса [34].
Экспериментальная работа 2009 г. на моделях билиарного цирроза выявила способность УДХК снижать портальное давление благодаря антиоксидантным свойствам и подавлению провоспалительных медиаторов (TGF-β1, iNOS, TXA2) [55]. Важным аспектом является модуляция ренин-ангиотензиновой системы — продемонстрировано снижение уровня ангиотензина II после длительного приема УДХК [56].
Клинические исследования подтверждают хороший профиль переносимости УДХК и ее умеренное влияние на диастолическое давление, что связывают с прямым воздействием на гладкомышечные клетки сосудов [57]. Особый интерес представляет взаимодействие УДХК с рецепторами желчных кислот (TGR5, FXR) в сосудистой стенке, опосредующее вазодилатирующие эффекты [58, 59].
Несмотря на перспективные данные доклинических исследований, производное УДХК — NCX-1000, высвобождающее оксид азота, не продемонстрировало значимого влияния на портальное давление у пациентов с циррозом печени. В рандомизированном исследовании фазы 2а препарат не изменил показатели градиента печеночного венозного давления, но вызвал достоверное снижение систолического артериального давления и печеночного кровотока. Полученные результаты свидетельствуют о системном, а не селективном внутрипеченочном действии соединения [60].
Урсодезоксихолевая кислота и нейродегенеративные заболевания
Обсуждение взаимосвязи метаболического синдрома и нейродегенеративных заболеваний представляет собой важное направление ввиду общности патогенетических механизмов (инсулинорезистентность, системное воспаление, митохондриальная дисфункция и оксидативный стресс), двунаправленности взаимного воздействия и эпидемиологической обоснованности с общими демографическими тенденциями [61].
Митохондрии, основной производитель аденозинтрифосфата (АТФ) в клетке, играют ключевую роль в энергообеспечении нейронов и поддержании клеточного гомеостаза. Их дисфункция является универсальным патогенетическим звеном при нейродегенеративных заболеваниях, включая болезни Паркинсона, Альцгеймера и Хантингтона. Одним из ключевых подходов к коррекции митохондриальной дисфункции является снижение окислительного стресса. Нарушение работы митохондриального электрон-транспортного комплекса приводит к избыточному образованию реактивных форм кислорода (ROS), что запускает каскад патологических процессов: повреждение митохондриальной ДНК, активацию провоспалительных сигнальных путей и индукцию апоптоза [62].
Обладая доказанными антиоксидантными свойствами, УДХК демонстрирует значительный потенциал в модуляции этих процессов. Экспериментальные данные свидетельствуют о ее способности подавлять накопление ROS в нейронах, сохранять митохондриальный мембранный потенциал, предотвращать истощение внутриклеточных запасов АТФ, снижать апоптозную активность. Указанные многоуровневые эффекты позволяют рассматривать УДХК в качестве перспективного кандидата для разработки нейропротективных стратегий, направленных на улучшение митохондриальной функции при нейродегенеративных заболеваниях [63].
Проведенный метаанализ трех рандомизированных контролируемых исследований демонстрирует значимое влияние УДХК на митохондриальную активность при болезни Паркинсона. У пациентов, получавших УДХК, отмечено значимое повышение концентрации неорганического фосфата и АТФ по сравнению с контрольной группой. Полученные данные свидетельствуют о способности УДХК поддерживать АТФ-гомеостаз, что указывает на потенциальные болезньмодифицирующие эффекты препарата при нейродегенеративной патологии. Результаты исследования обосновывают перспективность дальнейшего изучения УДХК в качестве средства, влияющего на патогенетические механизмы болезни Паркинсона [64].
Заключение
Таким образом, УДХК представляет собой яркий пример препарата с плейотропным действием, механизмы которого получают новое осмысление в контексте современных научных достижений. Современные исследования демонстрируют, что УДХК: модулирует ключевые воспалительные и метаболические пути (рецепторы FXR, TGR5); оказывает влияние на митохондриальную функцию, энергетический гомеостаз, аутофагию и обладает нейропротективным потенциалом через множественные механизмы. Эти данные трансформируют понимание терапевтического потенциала УДХК, выводя ее за традиционные рамки. Препарат демонстрирует эффективность при комплексных метаболических нарушениях, включая ожирение, инсулинорезистентность, НАЖБП и нейродегенеративные заболевания, объединенных общим патогенетическим звеном — метавоспалением. Таким образом, УДХК представляет собой уникальный пример, когда углубленное понимание молекулярных механизмов действия позволяет расширить применение давно известного препарата для решения задач современной медицины.
Сведения об авторах:
Ливзан Мария Анатольевна — член-корр. РАН, д.м.н., профессор, ректор, заведующая кафедрой факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017
Бикбавова Галия Равильевна — к.м.н., доцент, доцент кафедры госпитальной терапии и эндокринологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9252-9152
Гаус Ольга Владимировна — д.м.н., доцент, профессор кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9370-4768
Каримов Руслан Альбертович — студент 5-го курса лечебного факультета ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0009-0007-6955-2160
Гавриленко Дарья Александровна — ассистент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-5245-7190
Контактная информация: Гаус Ольга Владимировна, e-mail: gaus_olga@bk.ru
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.05.2025.
Поступила после рецензирования 23.06.2025.
Принята в печать 16.07.2025.
About the authors:
Maria A. Livzan — Corresponding Member of the Russian Academy of Sciences (RAS), Dr. Sc. (Med.), Professor, Rector, Head of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017
Galiya R. Bikbavova — C. Sc. (Med.), Associate Professor of the Department of Hospital Therapy and Endocrinology, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9252-9152
Olga V. Gaus — Dr. Sc. (Med.), Associate Professor, Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9370-4768
Ruslan A. Karimov — 5th-year student of the Faculty of Medicine, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0009-0007-6955-2160
Darya A. Gavrilenko — Assistant Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-5245-7190
Contact information: Olga V. Gaus, e-mail: gaus_olga@bk.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.05.2025.
Revised 23.06.2025.
Accepted 16.07.2025.
[1] Клинические рекомендации Минздрава России. Внутрипеченочный холестаз при беременности. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/289_2 (дата обращения: 27.05.2025).
[2] Клинические рекомендации Минздрава России. Алкогольная болезнь печени. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/711_2 (дата обращения: 27.05.2025).
[3] Клинические рекомендации Минздрава России. Неалкогольная болезнь печени. 2024. (Электронный ресурс.). URL: https://cr.minzdrav.gov.ru/preview-cr/748_2 (дата обращения: 27.05.2025).
[4] Клинические рекомендации Минздрава России. Желчнокаменная болезнь. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/877_1 (дата обращения: 27.05.2025).
Информация с rmj.ru




