Содержание статьи
Введение
В 1993 г. ботулинический токсин типа А (БТА) впервые был использован для коррекции спастичности у детей с детским церебральным параличом (ДЦП). Исследования применения препаратов БТА, проведенные в первые годы использования, подтвердили краткосрочное снижение мышечного тонуса (до 4–5 мес.), предотвращение мышечных контрактур и, в связи с этим, деформаций в суставах, улучшение функции ходьбы. В дополнение к этим положительным эффектам местная внутримышечная инъекция препарата оказалась безопасной и редко сопровождалась побочными реакциями. Безопасность и эффективность препаратов БТА стали основанием для их использования в клинической практике врача-невролога с целью купирования спастичности у детей с ДЦП. До недавнего времени применение препарата Релатокс® разрешалось только у детей в возрасте от 6 лет и старше. Чрезмерный мышечный тонус у детей раннего возраста ухудшает мышечный контроль или вовсе приводит к его отсутствию, препятствует поддержанию постурального баланса. Спастичность ограничивает моторное развитие, препятствует освоению важнейших моторных вех: в младшем детском возрасте затрудняет ползание, позже — освоение вертикального положения и развитие ходьбы [1].
Опасения по поводу более высоких рисков и возможных побочных эффектов у детей ранней возрастной группы были опровергнуты рядом исследований [1, 2]. В одной из работ [3] авторы изучали эффект применения ботулинотерапии у детей младшего возраста (средний возраст обследуемых — 16 мес.). Оценку изменений спастичности мышц нижних конечностей и показателей ходьбы проводили в двух группах. В основной группе дети получали 2 инъекции БТА и ежедневно выполняли растяжку, в контрольной группе проводилась только ежедневная растяжка. Было отмечено уменьшение тонуса спастичных мышц через 1 и 3,5 года от момента терапии, но более выраженное изменение наблюдалось в группе БТА. Исследование показало, что раннее лечение ботулотоксином у детей со спастической формой ДЦП может снизить мышечный тонус и замедлить развитие стойких контрактур к 5 годам и старше. Высокий профиль безопасности, подтвержденный множеством исследований, позволяет рекомендовать использование ботулинотерапии в качестве эффективного и безопасного средства для купирования спастичности верхних и нижних конечностей при ДЦП, в том числе у детей младшего возраста.
Безусловно, следует помнить, что перед выполнением инъекций ботулотоксина маленьким пациентам необходимо тщательно взвешивать ожидаемые риски и преимущества. Особенной трудностью является получение обратной связи и оценки от пациента. Для преодоления затруднений такого рода в настоящее время продолжается изучение валидности шкал оценки состояния детей данной возрастной группы [4].
Препараты БТА входят в базисную терапию локальной спастичности при ДЦП более 30 лет [5–7]. Своевременная целенаправленная коррекция мышечного тонуса способствует улучшению опороспособности нижних конечностей, вертикализации, изменению паттерна ходьбы, овладению новыми двигательными навыками и существенному улучшению качества жизни пациентов [8–10].
Препарат Релатокс® токсин ботулинический типа А в комплексе с гемагглютинином (далее Релатокс®) — БТА отечественного производства, выделенный из Clostridium botulinum в комплексе с гемагглютинином; очищенный двумя методами: методом гель-хроматографии и лиофилизацией [11]. Препарат показан к применению при блефароспазме, эстетических дефектах, спастичности. Выпускается в виде лиофилизата для приготовления раствора. Доклинические исследования показали высокий профиль безопасности и гипоаллергенности, что обусловлено безальбуминовым стабилизирующим составом. Производственный штамм для получения препарата Clostridium botulinum 501 в течение многих лет используется для производства российской противоботулинической вакцины. Производителями запатентован также состав питательной среды. По результатам экспериментальных данных, эта среда оптимальна для сбалансированного токсино- и гемагглютининообразования. В производстве препарата применяется оригинальная трехступенчатая технология очистки природного комплекса ботулинического нейротоксина. Процесс очистки исключает риск попадания в конечный продукт химических компонентов осаждающих жидкостей. Процент очистки по белку и по нуклеиновым кислотам соответствует стандартам производства зарубежных аналогов.
Исследования препаратов БТА, вплоть до последних лет, были посвящены изучению влияния препаратов на спастичность нижних конечностей. Клинические испытания препарата Релатокс® были направлены на расширение показаний к его применению и увеличение количества мышц (в том числе мышц верхних конечностей), включаемых в протокол инъецирования, при лечении спастических форм ДЦП. Данные исследования проходили в несколько этапов. В 2014–2016 гг. проводилась оценка безопасности и эффективности препарата Релатокс® у детей со спастическими формами ДЦП в возрасте 13–17 лет, с 2016 по 2018 г. — в возрастной группе 7–12 лет. В 2018–2019 гг. российская компания «Микроген» провела исследование эффективности препарата БТА Релатокс® у детей с ДЦП в возрасте от 2 до 6 лет [12]. В настоящей статье впервые публикуются результаты этого исследования.
Цель исследования: оценить безопасность и эффективность препарата Релатокс® у детей со спастическими формами ДЦП в возрасте от 2 до 6 лет.
Материал и методы
В 3-м этапе простого слепого рандомизированного сравнительного исследования приняли участие 100 детей со спастической формой ДЦП в возрасте от 2 до 6 лет.
Все участники после подписания родителями информированного согласия проходили процедуру типового обследования, в том числе с использованием модифицированной шкалы Эшворта (Modified Ashworth Scale — MAS) для оценки мышечного тонуса и 10-балльной визуальной аналоговой шкалы (ВАШ) для оценки выраженности боли. Критерии невключения в исследование: пациенты с аллергическими реакциями на компоненты препарата; получающие или планирующие лечение физиотерапевтическими методами; пациенты с острыми заболеваниями; пациенты с атонически-астатической формой ДЦП; ранее получавшие лечение ботулотоксином, фенолом; получавшие миорелаксанты других групп препаратов. По результатам скрининга врачом-исследователем принималось решение о возможности включения в исследование.
После рандомизации слепым методом конвертов было сформировано 2 группы пациентов, которым в спастичные мышцы вводили препарат Релатокс® (n=51) или эталонный препарат БТА Ботокс® (n=49). На визите 1 оценивали переносимость препаратов, на последующих визитах (визиты 2–5) проводили типовое обследование: физикальный и неврологический осмотр, лабораторные исследования, оценку по MAS и ВАШ. Кроме того, родителям выдавали дневники самонаблюдения, заполняемые самостоятельно или со слов ребенка между визитами в исследовательский центр. В дневниках фиксировались все наблюдаемые неблагоприятные явления, а также другие принимаемые препараты.
В каждой группе были выделены 2 подгруппы. В 1-ю подгруппу вошли испытуемые с синдромами спастичности с преимущественным вовлечением мышц нижних конечностей (25 пациентов из группы эталонного препарата БТА, 24 пациента из группы Релатокс®). Ведущими синдромами спастичности в данной подгруппе были:
спастическая эквинусно-варусная установка стопы (динамический эквинус или трицепс-синдром), вовлекаюший m. gastrocnemicus (икроножная мышца), m. soleus (камбаловидная мышца), m. tibialis posterior (задняя большеберцовая мышца);
аддукторный синдром, вовлекающий m. adductor longus (длинная приводящая мышца бедра), m. adductor brevis (короткая приводящая мышца бедра), m. adductor magnus (большая приводящая мышцы бедра);
Hamstring-синдром (синдром, сопровождающийся повышением тонуса в заднемедиальной группе мышц бедра), вовлекающий m. biceps femoris (двуглавая мышца бедра), m. semimembranosus (полуперепончатая мышца), m. semitendinosus (полусухожильная мышца);
Rectus-синдром (синдром повышения спастичности в четырехглавой мышце бедра), вовлекающий m. rectus femoris (прямая мышца бедра), m. vastus lateralis (латеральная порция четырехглавой мышцы бедра).
Во 2-ю подгруппу вошли дети с преимущественным вовлечением мышц верхних конечностей (24 пациента из группы эталонного препарата БТА, 26 пациентов из группы Релатокс®). В подгруппе наблюдались следующие синдромы спастичности:
синдром сгибательно-пронаторной установки предплечья, вовлекающий m. pronator teres (круглый вращатель предплечья), m. pronator quadrates (квадратный вращатель предплечья), m. biceps brachii (двуглавая мышца плеча), m. brachialis (плечевая мышца);
синдром приведения плеча и его внутренней ротации, вовлекающий m. pectoralis major (большая грудная мышца);
синдром сгибательной установки кисти, вовлекающий m. flexor carpi ulnaris (локтевой сгибатель запястья), m. flexor carpi radialis (лучевой сгибатель запястья);
синдром сгибательной установки 2–5 пальцев кисти, первого пальца кисти, установка приведения первого пальца кисти, вовлекающий m. flexor digitorum superficialis (поверхностный сгибатель пальцев), m. flexor digitorum profundus (глубокий сгибатель пальцев), m. flexor pollicis longus (длинный сгибатель большого пальца кисти), m. flexor pollicis brevis (короткий сгибатель большого пальца кисти), m. adductor pollicis (мышца, приводящая большой палец кисти), m. opponens pollicis (мышца, противопоставляющая большой палец кисти).
Мышцы, которые включали в протокол инъецирования БТА, врач-исследователь определял индивидуально в зависимости от паттерна спастичности.
Для проведения статистической обработки полученных данных использовали программы: Statistica 6.0, SPSS. Для статистической обработки полученных данных использовались параметрические и непараметрические методы статистики, выбор которых будет обусловлен характером распределения изучаемых признаков: для сравнения количественных признаков использовали t-критерий Стьюдента или дисперсионный анализ, для качественных и порядковых признаков — критерии Манна — Уитни и Хи-квадрат.
Результаты исследования
Все добровольцы получили дозы исследуемых препаратов в соответствии с протоколом клинического исследования [5]. Доза рассчитывалась в зависимости от степени спастичности и количества мышц, вовлеченных в патологический процесс. Дозы препарата Релатокс®, вводимые исследуемым, соответствовали значениям, представленным в инструкции [12]. Дозы, использованные во время исследования для введения в верхнюю конечность, были одобрены и внесены в инструкцию к препарату [12].
Максимальная суммарная разовая доза ботулотоксина на инъекционную сессию составляла 60–200 ЕД. При проведении инъекций БТА по поводу сгибательной установки кисти и пальцев кисти исследователи, опасаясь развития слабости инъецированных мышц и нарушения манипулятивных функций, придерживались принципа минимально возможных разовых доз. Суммарное количество препарата, вводимого в мышцы сгибатели кисти и сгибатели пальцев, не превышало 80 ЕД. В большинстве случаев наблюдалась корреляция введенных доз препаратов Релатокс® и Ботокс® в диапазоне 10–15 ЕД. Средняя доза на одно введение для верхней конечности для препарата Релатокс® составила 116 ЕД, для Ботокс® — 113 ЕД; для нижней конечности — 127 ЕД и 138 ЕД соответственно. Анализ введенных доз по подгруппам показал отсутствие статистической значимости между количеством введенных препаратов в соответствующих подгруппах (t-критерий Стьюдента, p>0,05). Развивались схожие клинические эффекты вне зависимости от используемого препарата.
После введения препарата Релатокс® на контрольных визитах при оценке мышечного тонуса наблюдалось стойкое и выраженное уменьшение спастичности по MAS
(рис. 1A). Не было выявлено статистически значимых межгрупповых различий как по общему баллу MAS, так и при оценке показателя на нижних и верхних конечностях на визитах 1–5, также отсутствовали различия изменений относительно исходного уровня (p>0,05).
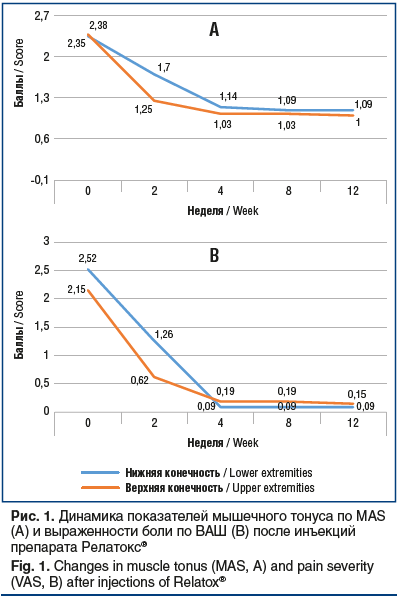
Как видно на рисунке 1B, после введения препарата Релатокс® наблюдалось статистически значимое уменьшение выраженности боли при оценке как общего балла, так и балла отдельно для нижней и верхней конечности уже с визита 2. Статистически значимое различие относительно исходного значения сохранялось до конца периода наблюдения (через 12 нед.). Максимальное снижение общего балла отмечали на визите 5.
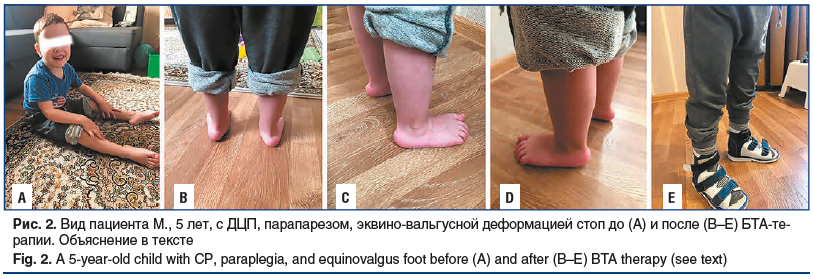
На рисунке 2 представлено клиническое наблюдение пациента М., 5 лет, с диагнозом «ДЦП: парапарез, эквино-вальгусная деформация стоп». Исходно у пациента отмечалась динамическая контрактура, затрудняющая коррекцию ортезами любого типа, в том числе обувью (рис. 2А). На рентгенограмме стоп наблюдалось низкое стояние ладьевидной кости с дефектом положения пяточной кости (угроза стопы-«качалки»), что впоследствии может стать показанием к оперативному лечению. Пациенту проведена БТА-терапия препаратом Релатокс® по протоколу исследования [12] при паттерне спастической эквинусно-вальгусной установки стопы. В результате удалось добиться полной коррекции эквинуса с сохранением явлений двусторонней плосковальгусной деформации стоп (рис. 2B–D), появилась возможность для коррекции ортезами (рис. 2E).
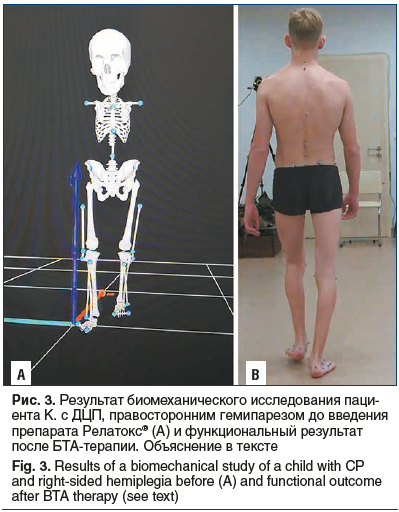
На рисунке 3 представлен пациент К.,17 лет, с диагнозом: «ДЦП, правосторонний гемипарез. В 4 года получил первую инъекцию БТА с хорошим результатом (купирована эквинусная установка). По причине смены места жительства были вынуждены сменить врача, который проводил инъекции. Однако очередной этап БТА-терапии не дал отчетливого результата и введение БТА было прекращено. Повторно обратились в 16 лет. Наблюдались эквинусная и тяжелая вальгусная деформации стоп. Проведено биомеханическое исследование, которое подтвердило наличие деформаций, заподозренных при осмотре (тяжелой вальгусной и эквинусной деформаций), обнаружена пронация стопы и отведение бедра правой ноги в фазу переноса (компенсация эквинусной деформации) (рис. 3А). Проведена БТА-терапия препаратом Релатокс®, в результате которой значительно уменьшились, но сохраняются: вальгусная деформация правого голеностопного сустава, тыльное сгибание правой стопы, разгибание правого коленного сустава; восстановилась опорность правой стопы, остаточные явления деформаций суставов не препятствуют ходьбе, что является хорошим результатом у детей старшей возрастной группы (рис. 3B). Важно отметить, что большой вклад в положительный исход у данного пациента внесло своевременное (раннее) проведение БТА-терапии, что благодаря расширению показаний к применению препарата Релатокс® теперь возможно с 2 лет.
Местные и системные реакции оценивались в ходе клинического исследования как один из критериев безопасности. Степень выраженности реакций оценивалась по 4-балльной шкале, где 0 баллов — это отсутствие реакции, 1 балл — незначительно выраженная реакция, 2 балла — умеренно выраженная реакция, 3 балла — выраженная реакция. Фиксировались данные, полученные при осмотре исследователями, а также из дневников самонаблюдения. Наблюдались местные реакции, типичные для внутримышечных инъекций: боль, кровоизлияния, раздражение, отечность области инъекции. Реакции на внутримышечные инъекции саморазрешались в течение нескольких дней, имели слабую или среднюю степень выраженности. У единичных пациентов наблюдались системные реакции, типичные для препаратов БТА: артралгии, головная боль, мышечная слабость, депрессия, нарушение координации. Все перечисленные реакции купировались самостоятельно в течение
1 дня, имели слабую степень выраженности. Анализ данных по побочным реакциям показал отсутствие статистически значимых различий между группами пациентов.
Обсуждение
По результатам исследования установлена безопасность введения препарата Релатокс®, соответствующая эталонному препарату сравнения (Ботокс®). При применении у детей со спастическими формами ДЦП препарат показал эффективность, эквивалентную эталонному препарату. Перечень мышц, исследуемых для возможности введения изучаемого препарата, был расширен, что позволило проводить инъекции с учетом двигательных паттернов, наблюдаемых у пациента.
Расширение количества мышц, рекомендованных к введению препарата, — огромное достижение данного рандомизированного исследования. Так, спастичность большой грудной мышцы приводит к приводящей контрактуре плечевого сустава, что препятствует полноценному колебанию руки при ходьбе. Спастика большой грудной мышцы препятствует отведению в плечевом суставе — движению, необходимому для поддержания равновесия и захвата предметов при отведении руки в сторону. Нормальный тонус мышц плечевого пояса необходим для поддержания корректной осанки. Отсутствие спастичности большой грудной мышцы необходимо для поддержания баланса при ходьбе [13]. Купирование спастичности большой грудной мышцы облегчает заведение руки за спину.
Четырехглавая мышца бедра является двусуставной и, помимо разгибания в коленном суставе, участвует в сгибании в тазобедренном суставе, что в случае спастичности мышцы провоцирует развитие Rectus-синдрома. Контрактура тазобедренного сустава, развивающаяся впоследствии, негативно влияет на сам сустав и осанку в положении сидя. Введение препарата Релатокс® для купирования Rectus-синдрома у детей до 7 лет не изучено, что обусловливает необходимость дальнейших исследований с целью расширения показаний к применению на более ранний возраст. Спастичность четырехглавой мышцы бедра является непреодолимым препятствием при обучении ребенка ходьбе. Введение БТА в четырехглавую мышцу бедра купирует проявления Rectus-синдрома, чем способствует, в первую очередь, улучшению переноса ноги вперед, комфортному расположению ребенка в коляске и облегчает уход за ним.
Спастичность у детей с ДЦП часто проявляется определенными паттернами [13]. Спастичная мышца способна (посредством взаимодействий между нейронами спинальных локомоторных генераторов) усугублять спазм другой мышцы, задействованной в одном с ней паттерне [13]. Таким образом, для полноценного восстановления двигательных функций ребенка необходимо иметь возможность включать в протокол инъекционной сессии максимальное количество мышц. На территории Российской Федерации самым широким перечнем мышц, в которые возможно делать инъекции при спастических формах ДЦП, обладает препарат Релатокс®.
Заключение
Препарат Релатокс® обладает выраженным и стойким противоспастическим и противоболевым эффектом. На основании проведенного исследования выявлено минимальное системное действие и низкая частота нежелательных реакций. Уровень эффективности и профиль безопасности соответствуют таковым препаратов-аналогов. Количество мышц, включенных в показания к применению при спастической форме ДЦП, наибольшее среди всех аналогов. Препарат производится отечественной фирмой, что обусловливает его относительно меньшую стоимость, что экономически выгодно. Положительные свойства препарата Релатокс® делают его препаратом выбора для купирования спастичности у детей с ДЦП в возрасте от 2 до 18 лет.
Сведения об авторах:
Красавина Диана Александровна — д.м.н., заведующая кафедрой травматологии, ортопедии, медико-социальной экспертизы, протезирования и реабилитации ФГБУ ДПО СПбИУВЭК Минтруда России; 194044, Россия, г. Санкт-
Петербург, Б. Сампсониевский пр., д. 11/12; профессор кафедры хирургических болезней детского возраста ФГБОУ ВО СПбГПМУ; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-4255-7029.
Иванов Юрий Иванович — старший лаборант, аспирант кафедры травматологии, ортопедии, медико-социальной экспертизы, протезирования и реабилитации ФГБУ ДПО СПбИУВЭК Минтруда России; 194044, Россия, г. Санкт-Петербург, Б. Сампсониевский пр., д. 11/12; ORCID iD 0000-0002-6832-1711.
Контактная информация: Красавина Диана Александровна, e-mail: krasa-diana@yandex.ru.
Источник финансирования: исследование выполнено при поддержке компании «Микроген».
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 26.08.2021.
Поступила после рецензирования 17.09.2021.
Принята в печать 29.09.2021.
About the authors:
Diana A. Krasavina — Dr. Sc. (Med.), Head of the Department of Traumatology, Orthopedics, Medical Social Expertise, Prosthetics, and Rehabilitation, St. Petersburg Institute of the Advanced Training of Experts; 11/12, Bolshoy Sampsonievskiy lane, St. Petersburg, 194044, Russian Federation; professor of the Department of Surgical Diseases of Children,
St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0003-4255-7029.
Yuriy I. Ivanov — senior lab assistant, postgraduate student of the Department of Traumatology, Orthopedics, Medical Social Expertise, Prosthetics, and Rehabilitation, St. Petersburg Institute of the Advanced Training of Experts; 11/12, Bolshoy Sampsonievskiy lane, St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-6832-1711.
Contact information: Diana A. Krasavina, e-mail: krasa-diana@yandex.ru.
The study was supported by «Microgen».
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 26.08.2021.
Revised 17.09.2021.
Accepted 29.09.2021.
.
Информация с rmj.ru






