Содержание статьи
Введение
Известно, что скорость клубочковой фильтрации (СКФ) является маркером повреждения почек и клиническим признаком прогрессирования хронической болезни почек (ХБП) при артериальной гипертонии (АГ) [1–5]. Также установлено, что СКФ ассоциируется со многими факторами риска (ФР) АГ, имея либо положительную, либо отрицательную взаимосвязь [6, 7], и различается в зависимости от пола пациента. При этом различия касаются не только выраженности ФР, но и их комбинаций. Установлено, что АГ является одной из причин развития ХБП, а в сочетании с любыми ФР убыстряет ее возникновение с развитием гипертонического нефросклероза и ассоциируется с повышением кардиальной смертности. Все это характеризует кардиоренальный синдром 2-го типа [8, 9].
В России вариабельность стандартизованных показателей смертности от гипертонической болезни с поражением сердца и почек [10] широко варьирует в зависимости от региона, наиболее высокие показатели отмечаются в республиках Северная Осетия — Алания (6,64), Хакасия (6,83), Чукотском автономном округе (45,79). В настоящее время проводится успешное изучение ассоциаций биохимических и молекулярно-генетических маркеров повреждения почек при АГ [11], которые можно использовать в клинической практике.
Для уточнения стадии ХБП и определения снижения СКФ используется формула СКD-EPI, критерием выступает уровень СКФ <60 мл/мин/1,73 м2, при котором почка уже утратила 50% количества нефронов. Маркерами повреждения почек является альбуминурия/протеинурия, изменение мочевого осадка, канальцевая дисфункция, гистологические и структурные изменения [8, 12], однако чаще всего ХБП у больных АГ протекает малозаметно. При этом общие ФР АГ, ХБП и хронической сердечной недостаточности (ХСН) тесно связаны между собой [12]. Интерес вызывает комбинация ФР, которая выявляется при снижении СКФ до 60 мл/мин/1,73 м2 и может стать определяющей для ранней диагностики ХБП у больных АГ с ассоциированными клиническими состояниями.
Цель исследования: оценить математическую модель, построенную для выявления снижения СКФ по значимости независимых ФР у больных АГ с ассоциированными клиническими состояниями в зависимости от пола.
Материал и методы
Было обследовано 98 (45 мужчин и 53 женщины) больных с верифицированным диагнозом АГ с ассоциированными клиническими состояниями в ГБУЗ «ОКБ» (г. Тверь) на фоне показанной терапии. Пациенты были разделены по полу на 2 группы: 1-ю группу составили мужчины (средний возраст 65,58±9,12 года), 2-ю группу — женщины (средний возраст 65,19±10,02 года). Все больные получали показанную лекарственную терапию. У всех пациентов была проведена оценка длительности заболевания, массы тела, уровня общего холестерина крови (ОХ), липопротеинов низкой плотности (ЛПНП), триглицеридов, СКФ (по формуле CKD-EPI), показателей клинического анализа периферической крови (гемоглобин, число эритроцитов, лейкоцитов, палочкоядерных (п/я) нейтрофилов, сегментоядерных нейтрофилов, базофилов, эозинофилов, моноцитов). Были отмечены в анамнезе ассоциированные заболевания: постинфарктный кардиосклероз, острое нарушение мозгового кровообращения (ОНМК), наличие сахарного диабета 2 типа. Также проводили контроль артериального давления (АД). Исследовали параметры ЭхоКГ (аппарат General Electric VIVID): гипертрофию левого желудочка, размер левого предсердия, объем левого предсердия (ОЛП), толщину межжелудочковой перегородки (ТМЖП) и задней стенки левого желудочка (ТЗСЛЖ), фракцию выброса, индекс массы миокарда, размер правого предсердия, толщину свободной стенки правого желудочка, диаметр легочной артерии (ЛА), систолическое давление в легочной артерии (СДЛА), амплитуду раскрытия аортального клапана, диаметр аорты и конечный диастолический размер левого желудочка, конечный диастолический объем левого желудочка, конечный диастолический размер правого желудочка.
Для каждого пола была построена математическая модель методом множественной линейной регрессии. Статистическую обработку проводили с использованием пакета программы Microsoft Excel, Biostat-2007, Statistiсa® V5.5A for Windows, коэффициента Спирмена (r). Данные представлены в виде М±SD, r — коэффициент корреляции, значимость коэффициента определяли по таблице корреляции. Различия считались статистически значимыми при p<0,05.
Результаты исследования
Результаты исследования показали, что у всех больных АГ с ассоциированными клиническими состояниями снижен уровень СКФ: среднее значение СКФ у мужчин составило 72,07±17,3 мл/мин/1,73 м2, у женщин — 63,6±17,12 мл/мин/1,73 м2. Таким образом, у женщин данный показатель был статистически значимо ниже, чем у мужчин. ХБП была выявлена у всех больных АГ с ассоциированными клиническими состояниями, тяжелая почечная недостаточность — у 1 мужчины, при этом у мужчин чаще выявлялась I–II стадия ХБП, у женщин — III стадия (табл. 1).
Установлено, что у мужчин наблюдается обратная корреляционная связь уровня СКФ с возрастом (r=-0,30, р=0,05), концентрацией ОХ (r=-0,42, р=0,01), показателем ЛПНП (r=-0,50, р=0,001).
У женщин отмечено, что уровень СКФ обратно коррелирует с возрастом (r=-0,50, р=0,001), ОЛП (r=-0,41, р=0,01), ТМЖП (r=-0,40, р=0,01), ТЗСЛЖ (r=-0,48, р=0,001), размером правого желудочка (r=-0,38, р=0,01), СДЛА (r=-0,30, р=0,05).
С учетом полученных данных корреляционного анализа уровня СКФ по формуле CKD-EPI с гематологическими показателями и параметрами ЭхоКГ у мужчин и женщин с АГ в сочетании с клиническими состояниями методом множественной линейной регрессии была построена математическая модель для каждого пола. Отбор модели был проведен с помощью критерия Акаике как для мужчин, так и для женщин.
Для модели у мужчин с АГ с ассоциированными клиническими состояниями информационный критерий Акаике составил 95,020. Уравнение регрессии приняло следующий вид: СКФмуж = 150,560 — 0,635х1 (72-135) + 13,835х2 (0-2) — 2,205х3 (3,8-9,9) — 4,533х4 (2-27) — 6,434х5 (1-30), где х1 —уровень креатинина крови, мкмоль/л;
х2 —степень регургитации на клапане ЛА;
х3 —уровень глюкозы крови, ммоль/л;
х4 — СОЭ, мм/ч;
х5 — длительность заболевания АГ, лет.
Значимость независимых факторов (предикторов), ассоциирующихся со СКФ, составила соответственно: креатинин — p=0,0001, легочная регургитация —p=0,0001, глюкоза — p=0,001, СОЭ — p=0,006, длительность заболевания — p=0,011. Значение статистики Фишера составило 104,721 (p<0,001). Скорректированный R2 был равен0,954. Остатки имели нормальное распределение (рис. 1).
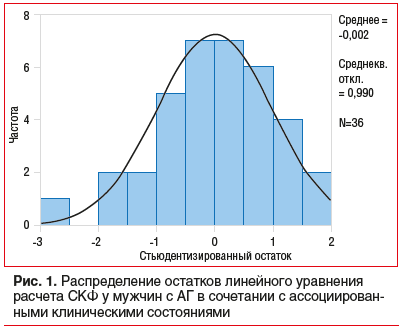
На рисунке 2 показано соотношение предсказанных и действительных уровней СКФ с использованием модели уровней СКФ у мужчин с АГ III cтадии. Расстояние Кука не превышало 0,227.
При построении математической модели для женщин с АГ и ассоциированными клиническими состояниями значение информационного критерия Акаике составило 140,074. Уравнение регрессии приняло следующий вид: СКФжен = 121,180 — 0,750х1 (70-132) — 0,292х2 (24-65) + 0,212х3 (56-101) + 3,721х4 (0-1) — 2,707х5 (0-8), где х1 — уровень креатинина крови, мкмоль/л;
х2 —СДЛА, мм рт. ст.;
х3 —частота сердечных сокращений (ЧСС) за 1 мин;
х4 — отсутствие ОНМК в анамнезе, за «1» принимается отсутствие ОНМК, за «0» — его наличие в анамнезе;
х5 — содержание п/я нейтрофилов в крови, %.
Значимость независимых факторов, ассоциирующихся с уровнем СКФ, составила соответственно: креатинин —p=0,0001, СДЛА — p=0,001, ЧСС —p=0,003, ОНМК —p=0,014, п/я нейтрофилы — p=0,045. Значение статистики Фишера составило 156,505 (p<0,001). Скорректированный R2 былравен 0,942. Остатки имели нормальное распределение, что показано на рисунке 3.
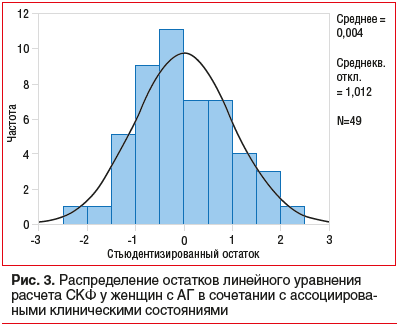
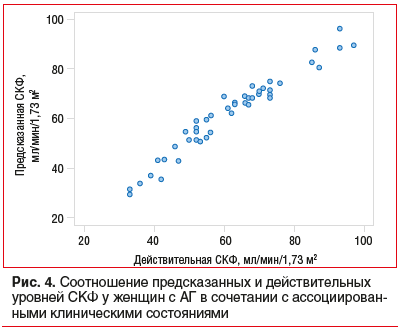
Соотношение предсказанных и действительных уровней СКФ с использованием модели у женщин с АГ представлено на рисунке 4. Расстояние Кука не превышало 0,125.
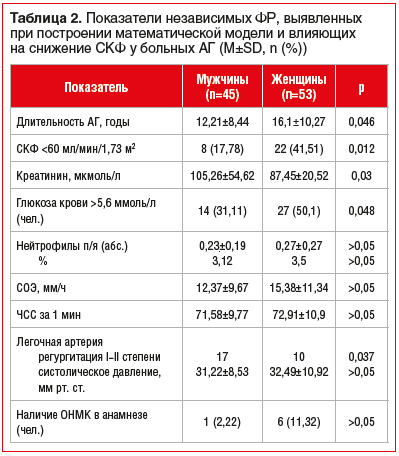
В таблице 2 приведены показатели независимых ФР, влияющих на снижение уровня СКФ для мужчин и женщин с АГ. Установлено, что длительность заболевания у мужчин была на 4 года меньше, чем у женщин. Уровень СКФ ниже 60 мл/мин/1,73 м2 выявлялся чаще у женщин, в то время как уровень креатинина в среднем был в пределах нормальных значений, но у женщин ниже, чем у мужчин. Уровень глюкозы выше 5,6 ммоль/л диагностировался чаще у женщин (в 19 раз). Число нейтрофилов, показатель СОЭ, ЧСС по полу не различались. ОНМК в 6 раз чаще выявлялось у женщин.
Построение математической модели у мужчин и женщин с АГ с ассоциированными клиническими состояниями показало, что на уровень СКФ воздействуют различные независимые ФР. Скорректированный коэффициент R2 в моделиу мужчин равняется 0,954, у женщин — 0,942, он служит мерой адекватности модели: чем ближе значение коэффициента к 1, тем сильнее зависимость и модель признается лучшей. Параметры уравнения регрессии являются статистически значимыми. При этом построенная модель определила влияние каждого фактора не только в отдельности, но и их совокупное воздействие на моделируемый показатель (СКФ), при этом зависимая переменная (СКФ) является следствием влияния независимых переменных (независимые факторы).
Обсуждение
Общеизвестно, что СКФ является независимым ФР сердечно-сосудистых осложнений, частота которых прямо пропорциональна степени снижения СКФ. В то же время полученные нами данные еще раз подтвердили, что этот показатель отражает стадию ХБП при АГ. Построенная математическая модель позволила выявить независимые факторы снижения СКФ в зависимости от пола. У мужчин с АГ в сочетании с ассоциированными клиническими состояниями увеличение регургитации на клапане ЛА ассоциировалось со снижением СКФ. С точки зрения патофизиологии степень регургитации на клапане ЛА следует рассматривать как фактор развития сердечной недостаточности (СН) при перегрузке объемом (гиперволемия), давлением (увеличение постнагрузки) и как фактор структурной перестройки сердца. При повышении нагрузки объемом на сердце увеличивается растяжение устья ЛА и степень регургитации. Возрастание количества глюкозы в крови у мужчин также ассоциировалось со снижением уровня СКФ. Известно, что гипергликемия способствует гиперфильтрации, которая появляется на ранних стадиях ХБП и ведет к увеличению диуреза. По мере прогрессирования АГ повышение показателя глюкозы в крови оказывает отрицательное влияние на эндотелий почечных сосудов, приводит к усилению атерогенеза в них, токсическому влиянию на почки и сопровождается снижением СКФ [11]. Увеличение СОЭ и длительности АГ у мужчин также ассоциировалось со снижением СКФ. Показатель СОЭ является отражением диспротеинемии в крови и косвенно свидетельствует о наличии системного воспаления, вероятно, связанного с прогрессированием атеросклероза сосудов [13]. Длительность заболевания отражает прогрессирование АГ и атеросклеротическое повреждение сосудов почек с формированием ХБП.
У женщин математическая модель позволила выявить иные независимые факторы, которые ассоциировались со снижением СКФ. Это увеличение СДЛА, ЧСС и количества п/я нейтрофилов. Параметр СДЛА патогенетически связан с гиперволемией, увеличением левого предсердия и диастолической дисфункцией левого желудочка, характеризующими ХСН. Влияние ЧСС на уменьшение СКФ, видимо, обусловлено развитием ХСН, увеличением объема циркулирующей крови с повышенной объемной нагрузкой на сердце, которая и вызывает тахикардию. Установлено, что при наличии ОНМК уровень СКФ снижается из-за нарушения гематоэнцефалического барьера, нестабильности гемодинамики и нарушения перфузии почек. Содержание п/я нейтрофилов в крови, возможно, обусловлено системным хроническим воспалением при атеросклерозе сосудов и дестабилизацией атеросклеротических бляшек, возможно, развитием гипертонического нефроангиосклероза, ведущего к эндотелиальной дисфункции почечных сосудов и очагам повреждения в них, ремоделированию микрососудистого русла и почечной ткани, кроме того, не исключено влияние лекарственной терапии на тубулоинтерстициальный аппарат почки.
Следует отметить наличие легочной гипертензии как у мужчин, так и у женщин и полагать, что нарушение функции почек способствует объемной перегрузке сердца и развитию СН.
Заключение
Таким образом, у больных АГ с ассоциированными клиническими состояниями использование математической модели позволило выявить факторы, которые тесно и независимо ассоциируются со снижением СКФ, различаются в зависимости от пола пациента, являются ведущими и могут быть использованы для ранней диагностики ХБП.
У мужчин снижение СКФ ассоциировано с увеличением регургитации на клапане ЛА, уровня глюкозы крови, СОЭ и длительности заболевания; у женщин — с увеличением параметров систолического давления в ЛА, ЧСС, перенесенным ОНМК, повышением количества п/я нейтрофилов. При возрастании значений выявленных независимых факторов следует ожидать снижения СКФ, прогрессии ХБП, увеличения риска развития сердечно-сосудистых осложнений.
Рассмотренные комбинации независимых ФР прогрессирования ХБП у больных АГ в сочетании с ассоциированными клиническими состояниями в зависимости от пола требуют дальнейшего изучения. Перспективным направлением является исследование их корреляционных и ассоциативных связей с показателями новых биомаркеров в ранней диагностике ХБП для разработки эффективных профилактических мероприятий.
Информация с rmj.ru





