Содержание статьи
Введение
Во всем мире фиксируется значительное увеличение количества пациентов с заболеваниями периферических артерий (ЗПА) [1, 2]. В структуре ЗПА наиболее катастрофическое течение отмечается при хронической ишемии, угрожающей потерей конечности (ХИУПК) [3]. Обширные некротические дефекты нижних конечностей, сформировавшиеся на фоне длительно существующей ишемии тканей, нередко рассматриваются как основание для высокой ампутации конечности. Вместе с тем активное распространение эндоваскулярных методик, совершенствование техники открытых операций привели к формированию когорты пациентов с некротическими поражениями, которым была выполнена удачная реконструкция магистрального кровотока. Присоединение антибиотикоустойчивой микрофлоры является значительным фактором риска потери конечности. Положительного конечного результата позволяет добиться только сбалансированная тактика ведения этих больных, включающая хирургические методики, консервативное и местное лечение. В данной работе мы представляем собственный опыт ведения пациентов с язвенно-некротическими поражениями стопы.
Опыт ведения пациентов с язвенно-некротическими поражениями стопы
В отделении сосудистой хирургии ГБУЗ «ЧОКБ» с января по декабрь 2018 г. было выполнено 334 вмешательства у 334 пациентов (средний возраст — 63,2 года; 71% мужчин) с атеросклеротическими окклюзионными заболеваниями артерий нижних конечностей, из них 186 пациентам проводили повторные операции (некрэктомии, ревизия раны, лечение отрицательным давлением (ЛОД) и т. д.). У 144 (43%) пациентов отмечалась окклюзия на уровне аорто-подвздошной зоны, у 190 (57%) больных поражался бедренно-берцовый сегмент. У 212 (63,4%) пациентов имелись язвенно-некротические поражения стопы. В анамнезе у 298 (89,2%) больных была ишемическая болезнь сердца (ИБС). Дополнительным фактором риска являлся сахарный диабет, отмеченный у 101 (30,5%) пациента. Характер некротических изменений варьировался от незначительного поверхностного дефекта на стопе до тотального некроза всех пальцев стопы.
Особенности возникновения некрозов при ишемии обусловливает последовательность хирургического лечения. Классически первым этапом выполняется реваскуляризация конечности. Второй этап — некрэктомия, проводимая либо в конце вмешательства, после «чистого» этапа, либо отсроченно, через 3–7 сут. Изменение последовательности обработки некрозов, как правило, приводит к распространению зоны нежизнеспособных тканей и к увеличению возможности потери конечности. Мы придерживались активной хирургической тактики.
При поступлении пациентов с некрозами на стопе иссекались заведомо нежизнеспособные ткани (рис. 1). Затем проводилась экономная некрэктомия в пределах здоровых тканей после реваскуляризации конечности. Раны на стопе велись открыто, без ушивания, даже при значительной раневой поверхности, с целью предупреждения распространения ишемических некрозов проксимально. Некрэктомия в различном объеме в зависимости от распространенности нежизнеспособных тканей была выполнена у 186 (87,7%) из 212 пациентов с язвенно-некротическими поражениями стопы.
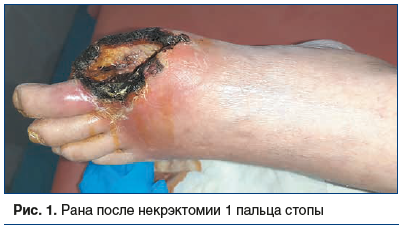
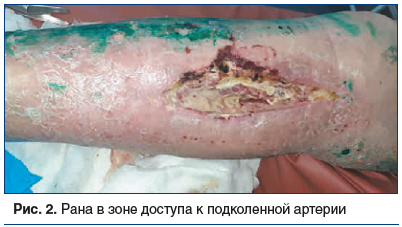
Еще одной проблемой являлось формирование инфицированной раны после реконструкции артерий в месте доступа. Ее появление угрожает не только потерей конечности, но и развитием аррозивного кровотечения. Сформированный во время операции доступ к сосудистому пучку увеличивает вероятность попадания в область инфекции оперированного сегмента артерии или шунта. Наличие в ране искусственного синтетического сосудистого протеза является дополнительным фактором риска массивных кровотечений.
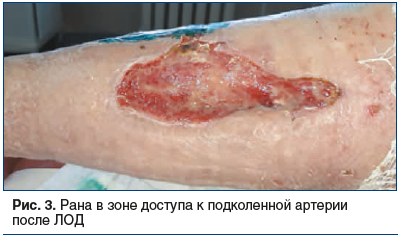
При формировании инфицированной раны в зоне доступа к артерии использовалась методика ЛОД. Применялись способы стационарного вакуума и переносных аппаратов. Вакуумное дренирование раны с последующим постепенным ушиванием ее в условиях операционной позволяло добиться хороших результатов в относительно короткие сроки (рис. 2, 3). ЛОД было применено у 32 (9,6%) больных.
В зависимости от медикаментозного лечения пациентов с язвенно-некротическими поражениями стопы разделили на 2 группы. Добившись формирования поверхностной раны, у пациентов из 1-й группы (n=171) использовали местную терапию мазью для наружного применения с сульфадиазином серебра 1% (Сульфаргин®). Препарат применяли согласно инструкции по медицинскому применению. После хирургической обработки раны и удаления некротических тканей мазь наносили тонким слоем (2–4 мм) 1 раз в день. У пациентов из 2-й группы (n=41) применяли стандартную терапию без использования сульфадиазина серебра. Антибиотики применяли у ограниченного числа пациентов из обеих групп — только при наличии глубоких ран.
У пациентов, в лечении которых использовался сульфадиазин серебра, продолжительность госпитализации составила 21,6±1,2 сут, высокая ампутация выполнена только у 1 (0,6%) пациента, летальных исходов не было. В группе больных с обширными ранами, в лечении которых не использовался сульфадиазин серебра, продолжительность госпитализации составила 30,2±0,6 сут, высокая ампутация выполнена 2 (4,87%) пациентам, летальный исход —
1 (2,4%) пациент после высокой ампутации. Количество этапных некрэктомий в группе пациентов с использованием сульфадиазина серебра было меньше (3,2±0,8 против 5,1±0,2). Контрольные посевы из ран при лечении сульфадиазином серебра фиксировали обычную для длительно существующих ран флору — грамотрицательные бактерии Pseudomonas aeruginosa (n=116, 67,8%) и Acinetobacter spp. (n=55, 32,2%). Антибиотикоустойчивые штаммы метициллинрезистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) выделены из раны у 2 (4,87%) пациентов в группе без применения сульфадиазина серебра.
Обсуждение
В стратегии лечения ХИУПК главным компонентом является выполнение реконструктивной операции на артериях нижних конечностей. Восстановление кровотока позволяет сохранить конечность. Однако основной проблемой даже после успешной реваскуляризации является заживление ран. Длительное пребывание в стационаре, вероятность присоединения больничной флоры, устойчивой ко многим антибиотикам, сниженная репаративная активность тканей, многочисленные вмешательства — факторы, ухудшающие заживление ран у данной категории пациентов [4]. В стационаре пациенты с открытыми ранами и со сниженной репаративной активностью тканей на фоне артериальной патологии подвергаются существенно большему риску инфицирования, чем другие больные. Одним из наиболее часто фиксируемых микроорганизмов у этих пациентов является S. aureus. Его характеризирует способность вырабатывать устойчивость к широко используемым антибиотикам и антисептикам. Эти устойчивые штаммы известны как MRSA. Одной из патогенных особенностей S. aureus является формирование биопленок в ране. В составе биопленок микроорганизм обладает высокой резистентностью к действию антибактериальных препаратов. Присоединение MRSA значительно ухудшает динамику заживления раны после артериальной реконструкции, потенциально угрожая развитием кровотечений и тяжелым сепсисом.
Системная антибиотикотерапия при MRSA-инфекциях ограничена выбором препаратов (ванкомицин, линезолид), а также имеет нежелательные последствия в виде побочных эффектов антибиотиков [5]. Назначение ее обосновано только при доказанной MRSA-инфекции в ране, при этом безотлагательно и на продолжительный период [6]. Для профилактики присоединения внутрибольничных штаммов используются современные антимикробные препараты для наружного применения, активные в отношении MRSA, которые назначаются в зависимости от стадии раневого процесса. В ряде исследований [7, 8] отмечена эффективность соединений серебра в отношении патогенной флоры, в том числе различных штаммов MRSA. Показана также способность соединений серебра препятствовать росту и образованию бактериальных биопленок, что позволяет снизить риски осложнений [9]. В комплексном воздействии препаратов серебра играет роль также подавление локальной воспалительной реакции [10], улучшение микроциркуляции в ране, ускорение регенеративных процессов [11].
Мы отметили положительный эффект от использования сульфадиазина серебра в терапии раневого процесса. Активная положительная динамика заживления позволила избежать повторных некрэктомий. Это отразилось и в уменьшении пребывания в стационаре пациентов, получавших в составе комплексного лечения сульфадиазин серебра. Частично это можно объяснить более тяжелым и обширным характером поражения нижних конечностей у пациентов, в лечении которых мы не смогли использовать препараты серебра. Вместе с тем отсутствие реинфекции по данным клинического наблюдения и результатов посевов из ран, предупреждение присоединения антибиотико-резистентной внутрибольничной флоры, по нашему мнению, характеризуют сульфадиазин серебра в качестве безопасного и эффективного средства для лечения инфицированных ран после операций на артериях.
Заключение
Успешная реконструкция магистрального кровотока у больных с ХИУПК не является залогом положительного результата лечения в целом. Наличие и распространенность некроза, присутствие раневой инфекции являются факторами, определяющими возможность сохранения конечности. Сбалансированная тактика ведения этих больных, сочетающая активное хирургическое лечение с местным воздействием на заживление раны, позволяет предотвратить ампутацию. Использование сульфадиазина серебра (Сульфаргин®, «Гриндекс») в комплексной терапии раневой инфекции у больных с ХИУПК предупреждает присоединение антибиотикоустойчивых штаммов микроорганизмов.
Благодарность
Редакция благодарит компанию «Гриндекс» за оказанную помощь в технической редактуре настоящей публикации.
.
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





